p21亚细胞定位与肿瘤
2019-04-17邓堂刚
刘 妍,邓堂刚,叶 茂
(湖南大学生物学院,中国湖南长沙410082)
p21是一种周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)抑制剂,属于Cip/Kip家族,作为p53下游重要的因子之一,与肿瘤的发生发展紧密相关。近年来研究发现,p21的功能会随着其亚细胞定位的变化而改变。当DNA发生损伤时,细胞核p21与CDKs和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)结合,诱导细胞周期停滞,促使细胞完成DNA损伤修复,从而维持基因组的稳定并抑制肿瘤细胞增殖。细胞质p21的表达与肿瘤发生发展呈正相关。研究发现,细胞质p21在人乳腺癌、肝细胞癌、黑色素瘤、白血病等恶性肿瘤组织中高表达,并且与其侵袭、转移、耐药等不良预后密切相关[1]。由于p21在功能上具有双重性,因此明确p21在不同肿瘤中的生物学功能及其转位作用机制,对靶向p21的肿瘤临床治疗具有重要参考意义。
1 p21的结构
人p21蛋白由CDKN1A基因编码,该基因定位在6号染色体短臂上。p21蛋白包含164个氨基酸,富含精氨酸,相对分子质量约为18 kD。p21蛋白的分子结构如图1所示,其N端特异性结合cyclin/CDKs复合物。其中,位于17~24位氨基酸的cyclin结合基序1(Cy1位点)主要结合cyclin D1/CDK4、cyclin E/CDK2 等 cyclin/CDKs复合物,抑制细胞周期进行。另外,p21的155~157位氨基酸处存在一个亚RXL基序(Cy2位点),该区域同样结合cyclin/CDKs复合物,参与细胞周期的调控[2]。p21通过Tyr-77(Y77)残基与CDKs的ATP结合位点结合,进而抑制CDKs催化活性[2]。p21的143~160氨基酸处存在含有8个氨基酸残基的PCNA互作蛋白盒(PIP-box)结构,可增强p21与PCNA的结合能力[3]。除此之外,p21的66~74位氨基酸和102~119位氨基酸处各包含一个核输出信号(nuclear export signal,NES),与其核输出及泛素化降解有关;140~142位氨基酸处含有一个细胞核定位信号(nuclear localization signal,NLS),负责p21的细胞核定位并实现抑制细胞增殖的功能[4]。
2 p21的生物学功能及作用机制
2.1 p21与细胞周期
2.1.1 细胞核p21与细胞周期
真核生物细胞周期的正常运行主要依赖于CDKs和周期蛋白依赖性激酶抑制因子(cyclin-dependent-kinase inhibitors,CKIs)组成的调控系统。细胞核p21通过调控细胞周期相关蛋白质影响细胞周期进程。在G1期,p21通过抑制cyclin D/CDK4/6复合物的活性,抑制细胞周期运行,促使细胞完成DNA损伤修复。在G1/S期转换过程中,cyclin E/CDK2复合物在G1期对肿瘤抑制蛋白Rb进行磷酸化,释放E2F转录因子,促使细胞进入S期,如果G1期DNA发生损伤,p21则会抑制CDK2活性,阻止细胞进入S期,诱导细胞停滞。PCNA作为DNA聚合酶δ和DNA聚合酶ε的辅助因子,是DNA复制和修复所必需的,在与PCNA之间的相互作用中,p21可能扮演双重角色。如果S期发生DNA损伤,则p21使PCNA失活,从而阻止DNA复制,促使细胞进行DNA损伤修复[5];同时,p21能够通过与PCNA结合的肽段抑制DNA酶1的活性,进而抑制PCNA依赖的碱基错配修复和碱基切除修复[6]。另外,p21与PCNA竞争性结合Myc,同时Myc能够阻断p21和PCNA之间的结合,从而抑制p21活性,促进DNA复制,进而促进G1/S期转换。核蛋白ICBP90(inverted CCAAT box binding protein of 90 kD)也能参与细胞周期的调控,其表达水平在G1期和G2/M期达到峰值,在这两个时期中ICBP90通过结合DNA拓扑异构酶Ⅱα(DNA topoisomeraseⅡ-alpha,TopoⅡα)上的CCAAT盒结构域,促进细胞增殖。DNA损伤能促进p53转录激活p21,从而导致ICBP90的转录水平降低,并促进其蛋白质降解,引起细胞停滞,诱导细胞凋亡[7]。另有研究表明,在染色体组装过程中,ICBP90与组蛋白赖氨酸甲基转移酶G9a结合能够抑制p21的启动子活性[8]。因此,p21与ICBP90之间的平衡也是调控细胞周期的重要机制。此外,因为ICBP90还具有E3连接酶的活性[8],所以ICBP90是否能够介导p21的泛素化降解也值得进一步思考。
G2/M期的转换主要与cyclin B/CDK1复合物有关。与其他cyclin/CDKs复合物相比,cyclin B/CDK1复合物对p21的亲和力较弱,但是当DNA受到损伤时,G2/M检查点被激活,p21与cyclin B/CDK1复合物结合,从而阻断细胞分裂周期因子25(cell division cycle 25,Cdc25)和周期蛋白依赖性激酶激活激酶(cyclin-dependent-kinase activating kinase,CAK)的活化,阻止G2/M期的转换。有研究提出,p21与PCNA的相互作用也可能导致细胞停滞在G2期,推测是由于p21使PCNA失活,造成S期的DNA损伤,进而引起细胞分裂周期因子2(cell division cycle 2,Cdc2)活性降低,将细胞停滞在G2期[9]。Cdc20是后期促进复合物/细胞周期体(anaphase-promoting complex/cyclosome,APC/C)的底物接头蛋白。研究发现,早期有丝分裂抑制因子1(early mitotic inhibitor 1,Emi1)可抑制Cdc20与底物结合,当DNA发生损伤时,p21能够通过下调Emi1进而激活APC/CCdc20复合物,促进其对cyclin A和cyclin B的泛素化降解,引起细胞周期停滞在G2期[10]。
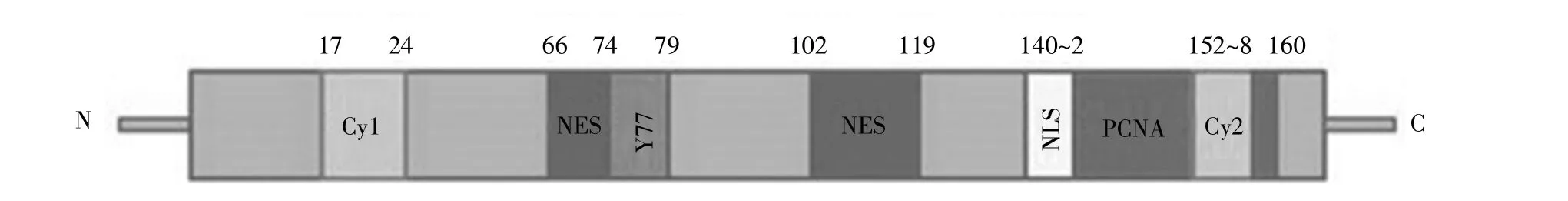
图1 p21蛋白的分子结构示意图Fig.1 The schematic diagram of p21
2.1.2 细胞质p21与细胞周期
细胞质p21也能通过影响CDKs的活性调控G1/S期转换。研究表明,p21的Ser130或Thr145发生磷酸化后,一方面会丧失与细胞核中cyclin/CDKs复合物结合的能力,导致其失去阻滞细胞周期运行的功能;另一方面,p21从细胞核中转移到细胞质中,同时细胞质cyclin E/CDK2表达量升高,两者在细胞质中的结合能够促进G1/S期的转换,但具体的调控机制有待进一步阐明[11]。另有研究表明,在一般情况下,细胞质p21能够抑制细胞凋亡,但当用视磺酸刺激前B淋巴瘤细胞时,p21表达上调,且p21与cyclin E/CDK2形成的复合物水平升高,从而促进前B淋巴瘤细胞的凋亡[12]。以上研究表明,在细胞质中p21仍然会结合cyclin/CDKs复合物,调控细胞周期运行。另外,Thr145磷酸化的p21还可通过激活cyclin D1/CDK4复合物介导G1/S期的转换,同时p21对PCNA的抑制能力减弱可促进DNA合成及S期运行,最终促使细胞增殖[13]。
2.2 p21与细胞凋亡
2.2.1 细胞核p21与细胞凋亡
除参与调控细胞周期外,p21还是细胞凋亡重要的调控因子。作为p53重要的下游靶标分子之一,p21可以响应p53对细胞凋亡的调控。当DNA受到轻度损伤时,p21在p53存在的情况下能够诱导细胞周期停滞在G2期,促使细胞进行DNA损伤修复,进而阻止细胞凋亡;如果DNA损伤严重,p53可直接诱导细胞发生凋亡。
除与p53有关外,p21也能够响应细胞周期相关转录因子 E2F、Myc、核因子-κB(nuclear factor κB,NF-κB)、信号转导和转录活化因子(signal transducer and activators of transcription,STAT)等的调控,进而促进细胞凋亡。p21对Rb磷酸化后能够通过招募染色体重构复合物SWI/SNF(yeast switch in mating type/sucrose non fermentation)抑制E2F的转录活性,进而阻断DNA复制,促进细胞凋亡[14]。Myc可通过与转录抑制因子ZMIZ-1结合抑制p21的功能,同时Myc还能招募转录因子激活增强子结合蛋白4 (activating enhancer bind ing protein 4,AP4)和赖氨酸特异性去甲基化酶5B(lysine-specific demethylase 5B,KDM5B),阻断Myc与p21启动子结合,抑制p21转录,进而诱导细胞凋亡。另外,Myc也可通过miR17-92对p21的mRNA进行剪切,抑制p21的转录,从而促进细胞凋亡[15]。当细胞受到外界刺激时,p21与NF-κB和STAT结合能够抑制B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)、细胞型Fas相关死亡区域蛋白样IL-1β转换酶抑制蛋白(cellular FADD-like IL-1β-converting enzyme-inhibitory protein,c-FLIP)、Bcl-XL(B cell lymphoma-XL)和X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)等抗凋亡蛋白的表达,进而诱导细胞凋亡[16]。p21的上调可促进Bcl-2相关X蛋白(Bax)的表达上调,从而引起细胞中Bax与Bcl-2的蛋白质比例发生变化,最终导致细胞发生凋亡[17]。
2.2.2 细胞质p21与细胞凋亡
细胞质p21能够抑制细胞凋亡。细胞质p21主要通过调控细胞周期蛋白及一些凋亡相关蛋白质的活性实现其抗凋亡的功能,这些因子包括cyclin/CDKs、胱天蛋白酶 3(caspase-3)、caspase-8、凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)、致癌蛋白 Ras(rat sarcoma)及应激活化蛋白激酶(stress-activated protein kinase,SAPK)等。研究表明,细胞质p21促进了乳腺癌细胞的侵袭和转移,并且能够增强其耐药性;免疫组化结果显示,细胞质p21的高表达伴随着细胞质cyclin B1的表达上调,同时乳腺癌患者生存期缩短,由此推测细胞质p21可能通过cyclin B1调控细胞周期并抑制细胞凋亡,但是具体机制还未明确[9]。当细胞受到外界刺激时,caspase-3对p21进行切割降解,减弱p21对cyclin A/CDK2复合物活性的抑制,进而诱导细胞凋亡。此外,p21与caspase-3的相互作用还可阻止由Fas介导的细胞凋亡[18]。p21过表达能够阻断死亡受体4细胞质结构域介导的caspase-8诱导的细胞凋亡[19]。蛋白激酶B(AKT)对p21的Thr145磷酸化后促使其进入细胞质中,随后p21与ASK1形成复合物,抑制促分裂原活化的蛋白激酶激酶4(mitogen-activated protein kinase kinase 4,MAPKK4)和MAPKK6的活化,进而分别抑制下游激酶SPAK和p38的活性,最终抑制细胞凋亡[20]。当细胞受辐射刺激时,肿瘤坏死因子(tumor necrosis factor,TNF)信号通路被激活,而p21能通过抑制该信号通路下游的caspase-3和caspase-9的活化,抑制由辐射诱导的细胞凋亡。Ras通过激活磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxy kinase,PI3K)和MAPKK途径使p21磷酸化,并介导其定位在细胞质,随后与Rho相关卷曲螺旋激酶(Rho-associated coiled-coil forming protein kinase,ROCK)结合,抑制ROCK/LIMIK/coflin途径介导的细胞凋亡[21]。
在单核细胞中人们也发现了细胞质p21的高表达,其通过抑制细胞凋亡阻止细胞终端分化。在外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中,p21从细胞核到细胞质的转位,可增强PBMCs对多种细胞因子刺激的抵抗能力;生化分析结果显示,细胞质p21能够结合并抑制ASK1的活性,同时抑制丝裂原活化蛋白激酶(mitogen activation protein kinase,MAPK)级联反应介导的细胞凋亡[22]。在滋养层巨细胞分化过程中,p21被AKT磷酸化,G1期和S期的细胞质p21蛋白水平均升高,促进细胞存活[23];另外,当人胚胎成纤维细胞的DNA发生轻度损伤时,胞外信号调节激酶(extracellular signal-regulated kinase,ERK)能够对p21进行磷酸化,导致其细胞质转位,从而抑制细胞凋亡[24],上述信息提示细胞质p21对细胞凋亡的抑制与其磷酸化修饰紧密相关。
3 p21细胞质定位的调控机制
蛋白质的磷酸化修饰能够改变其在细胞中的亚细胞定位,从而导致其功能发生改变。p21蛋白含有多个磷酸化位点,目前发现p21的NES和NLS附近有5个磷酸化位点,均与其核质穿梭有关。当磷酸化的AKT对p21的NLS附近的Thr145进行磷酸化时,p21稳定性提高,并且可使其由细胞核加速转向细胞质,同时p21也由抑癌因子变为促癌因子[25]。由于亚细胞定位的不同会使p21具有不同的功能,因此阐明p21在肿瘤细胞中的转位机制对研究p21的功能具有重要意义。p21的转位不仅与多种调控因素有关,还与不同种类的细胞系有关。目前研究较为清楚的是ERK2和AKT对p21的磷酸化介导的细胞质转位。
当表皮生长因子(epidermal growth factor,EGF)刺激细胞时,ERK2被持续激活,并对p21的Thr57和Ser130进行磷酸化,促进p21由细胞核转位至细胞质,同时促进S期激活相关蛋白2(S-phase kinase-associated protein 2,Skp2)介导的p21的泛素-蛋白酶体途径降解[26]。AKT能够直接对p21的Thr145进行磷酸化,而且Thr145靠近p21的NLS,其磷酸化修饰可阻止p21与核输入蛋白结合,从而将p21滞留在细胞质中;另外,AKT还可通过激活蛋白激酶C(protein kinase C,PKC),间接对p21的Ser146进行磷酸化,从而将p21阻滞在细胞质中,并且延长了p21的半衰期[25]。p21中Thr145和Ser146的磷酸化可阻碍p21与PCNA的结合,而游离的PCNA会激活DNA聚合酶,促进S期运行,最终导致DNA错配修复和碱基切除修复缺陷[26],这可能是细胞质p21导致肿瘤细胞恶性增殖的一种机制。除介导p21的磷酸化外,AKT还能通过抑制糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)的活性阻止GSK3对p21的Thr57磷酸化,该位点的去磷酸化可减弱p21与CDKs的结合,进而减弱由CDKs介导的p21降解,所以AKT也可能通过GSK3延长p21的半衰期,并促进其细胞质转位[27],但具体机制还有待进一步阐明。
研究发现,一些激酶也可通过AKT调控p21的细胞质定位,如NF-κB抑制激酶β(inhibitor of nuclear factor kappa-B kinase subunit beta,IKKβ)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)及热激蛋白27(heat shock protein 27,HSP27)等。IKKβ参与了p21在细胞质中的积累,一方面,当细胞受到外界刺激时,IKKβ被肿瘤坏死因子-α(TNF-α)和白细胞介素1(interleukin-1,IL-1)磷酸化激活,释放 NF-κB,促进p21的转录;另一方面,IKKβ促进AKT的Ser473磷酸化,进而促进p21的磷酸化,将其阻滞在细胞质中,而p21在细胞质中的积累可使乳腺癌细胞获得较强的耐药性,最终促进癌细胞存活[28]。Winters等[29]经过连续9年对乳腺癌细胞的研究发现,在细胞培养过程中,HER-2能够诱导p21的细胞质定位,并能够抵抗细胞凋亡,而定位在细胞质中的p21可减弱对细胞核中细胞周期蛋白的抑制,从而促进肿瘤细胞增殖。研究人员推测可能是HER-2通过磷酸化激活了AKT,AKT进一步对p21的Thr145磷酸化,从而使p21由细胞核向细胞质转位,一旦抑制AKT的激酶活性,p21则重新定位到细胞核,并且其促增殖活性降低[30]。HSP27也可通过对AKT进行磷酸化,促进p21向细胞质转位[31]。以上3种蛋白激酶都是通过AKT间接促进p21的细胞质定位,但是这三者是否可通过直接催化p21的磷酸化介导其细胞质定位还有待深入研究。综上所述可知,对AKT进行人为干扰是调节p21的重要手段之一,AKT抑制剂的筛选和开发是重要的研究方向并具有重要的肿瘤临床治疗意义。最先开发出的AKT抑制剂是以 ipatasertib、Nl-71-101、GSK690693等为代表的ATP竞争性抑制剂,目前该类抑制剂家族已有10余种[32]。研究发现,ipatasertib在Ⅰ期临床试验中对实体瘤患者具有较好的疗效以及安全性[33];在Ⅱ期临床试验中,与慰安剂相比,ipatasertib与紫杉醇连用能够延长三阴性乳腺癌患者的无进展生存期[34],可见ipatasertib在肿瘤的临床治疗上具有良好应用前景。但是ATP竞争性抑制剂对AKT同工酶无选择性,对于与AKT结构相似的激酶如PKA、ROCK等的选择性差,因此出现了AKT的变构抑制剂。AKT变构抑制剂主要包括5,6二苯吡嗪 2(1H)、MK-2206、SR13668等,有近 20 种。该类抑制剂具有高选择性和相对较低的毒性,其中,MK-2206与吉非替尼的联合使用已投入非小细胞肺癌的Ⅱ期临床试验[32];同时MK-2206也已经进入晚期乳腺癌的Ⅱ期临床试验[35]。另外,还有一些不可逆转的AKT抑制剂的开发,例如ll-AF101等。目前,该类抑制剂的家族成员较少,是值得深入研究的方向[32]。总的来讲,尽管有很多AKT抑制剂相继被发现,但是应用于肿瘤临床治疗的很少,且单独使用效果不佳,通常需要与一些化疗药物协同使用。
此外,p21与某些蛋白质的物理结合也可能导致其定位改变。有研究发现,阿霉素(DOX)处理人胰腺癌细胞株PANC1后,促进了p65与p21启动子的结合,同时能够促进p21由细胞核转位到细胞质,转位至细胞质后的p21与caspase-3前体(pro-caspase 3)结合,阻止了p21重新向细胞核转位,同时还增加了c-IAP1、Bcl-2等抗凋亡因子的转录水平,从而促进细胞增殖[36]。除以上机制外,DNA损伤后,核苷酸还原酶小亚基p53R2上调,为肿瘤细胞提供dNTP,促使其进行DNA损伤修复,同时还伴随着细胞质p21的上调,进而激活CDK4/6,随后引起Rb对E2F的激活,促进细胞增殖[37]。在大多数癌症中p53发生突变,p53R2对细胞质p21的上调是否依赖于突变的p53值得深入探究。
4 p21与肿瘤
4.1 细胞核p21与肿瘤
4.1.1 白血病
白血病是造血系统的克隆性恶性疾病,髓系分化障碍是其主要的发病机制之一。其根据细胞的分化程度可分为急、慢性白血病。通过对白血病患者的临床样本进行分析发现,p21在白血病细胞中呈低表达,其低表达能够导致白血病细胞分化受阻;采用一定治疗手段后,p21的表达水平升高,这些信息提示p21可作为白血病化疗疗效的评价指标[38]。视磺酸是治疗白血病的主要化疗药物之一,其主要是通过诱导p21转录来促进肿瘤细胞的分化,最终缓解急性早幼粒细胞白血病[39]。因此,p21能够促进白血病细胞分化,进而诱导白血病细胞的凋亡。
近年来人们在白血病细胞中也陆续发现了一些p21的上游调控因子,如NF-κB和克鲁佩尔样因子2(Kruppel-like factor 2,KLF2)。NF-κB 能够直接激活p21的表达,从而响应骨髓白血病细胞中的DNA损伤,进而控制DNA损伤诱导的髓样分化[40]。KLF2是KLF家族锌指转录因子的成员,在白血病细胞Jurkat中,KLF2能够通过上调p21的表达抑制Jurkat细胞生长[41]。因此,NF-κB和KLF2有望作为白血病治疗的分子靶标。
4.1.2 黑色素瘤
黑色素瘤是皮肤癌中最为恶性的肿瘤。Vidal等[42]的研究发现,p21在不同种类的黑色素瘤细胞中的蛋白质表达水平差异很大且功能也具有双重性。在黑色素瘤细胞SK-MEL-110中,p21能阻止由p53诱导的细胞程序性死亡,促进黑色素瘤细胞存活[43];而p21能够抑制黑色素瘤细胞A375和WM1976的增殖[44]。EZH2(enhancer of zeste homolog 2)是表观遗传转录抑制因子,研究发现其在正常的黑色素细胞中不表达,但是在黑色素瘤发生发展过程中表达升高,且可通过抑制p21的活性抑制黑色素瘤细胞的衰老和凋亡[45]。
目前临床上主要采用手术切除和术后放疗的方式治疗黑色素瘤,但是肿瘤常抗放疗。二甲双胍是治疗糖尿病的常用药,近年来有研究将二甲双胍用于黑色素瘤的治疗,且治疗效果显著,在机制上二甲双胍可以通过作用于腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)促进p53的磷酸化,从而间接促进p21的上调,最终促进细胞凋亡[46]。可见,p21可作为黑色素治疗的潜在靶点,同时二甲双胍和双胍衍生化合物类药物可能是治疗黑素瘤的新手段。
4.1.3 肺癌
最新的全球癌症统计报告表明,2018年全球肺癌的死亡人数占癌症总死亡人数的18.4%,是癌症死亡的主要原因[47]。目前针对肺癌的主要治疗手段是手术切除和化疗,但是,非小细胞肺癌(non-small cell lung cancer,NSCLC)对化疗相对不敏感,因此筛选肺癌分子标志物具有重要意义。研究发现,p21的表达与NSCLC的组织分化程度显着相关,p21免疫反应常见于病灶,而且p21表达不依赖于p53,所有p53+/p21-的NSCLC患者在进行手术切除后1年内死亡,说明p21可作为非小细胞肺癌独立的预后因素,是潜在的重要临床标志物[48]。在肺癌中,p21受到过氧化物酶体增殖物激活受体γ(PPARγ)配体的刺激而表达水平升高,进而抑制人肺癌细胞增殖并诱导细胞凋亡[49]。未来可针对肺癌中p21的正调控因子开发激活剂,以提高p21在肺癌中的表达水平,从而抑制肺癌的发生发展。
4.1.4 结直肠癌
Bukholm等[50]发现在原发性结直肠癌中p21的表达偏低,而且p21的缺失与高死亡率密切相关,这提示在临床上p21的表达水平可作为判断原发性结直肠癌是否具有转移风险的指标。Zirbes等[51]连续6年对294名结直肠癌患者的肿瘤样本进行了分析,发现p21表达呈阳性的患者存活率更高,说明p21可能会抑制结直肠癌的发生发展。
4.1.5 前列腺癌
前列腺癌是美国男性癌症中的第二大癌症[47],目前临床上主要采用水飞蓟素(silibinin)进行治疗。研究发现,silibinin能够促进前列腺癌细胞中p21和p27的转录,进而抑制前列腺癌细胞增殖[52]。另外,槲皮素也被应用于前列腺癌的治疗,在槲皮素的作用下,前列腺癌细胞PC-3中的p21表达升高,并将细胞周期阻滞在G2/M期,诱导细胞凋亡[53]。上述研究表明,细胞核p21在前列腺癌中能够响应化疗药物处理引起的细胞凋亡,因此明确这些药物处理后,p21在前列腺癌中具体的上下游调控机制,将有助于针对这类药物开发合适的分子靶标,增强药物靶向性,提高前列腺癌的治疗效率。
4.1.6 膀胱癌
膀胱癌是男性生殖系统常见的恶性肿瘤。目前,临床上采用卡介苗(Bacillus Calmette-Guérin,BCG)进行辅助治疗。在卡介苗治疗过程中,细胞核中的p21和p27表达升高,阻滞细胞周期运转,最终引起细胞凋亡,提示p21和p27在细胞核中的表达水平可能与卡介苗治疗效果呈正相关[54]。因此,p21和p27的共表达量与卡介苗最佳治疗效果的关系可深入研究。
4.2 细胞质p21与肿瘤
4.2.1 乳腺癌
细胞质p21在乳腺癌细胞中很常见。定位在细胞质中的p21能够促进乳腺癌细胞的侵袭和转移,并且能够增强其耐药性。Caffo等[55]长期跟踪观察了261例乳腺癌患者的p21免疫原性,发现p21的过表达与大肿瘤大小、阳性淋巴结状态、组织学分级和高有丝分裂相关,并且与患者短生存期有关,表明p21在细胞质中的定位与乳腺癌的恶性增殖有重要联系,可以作为乳腺癌的预后靶标。但是,由于细胞质中p21的调控机制尚未完全明确,所以到目前为止,并没有针对细胞质p21的药物开发。需要指出的是,现阶段已有针对caspase-3的降解而间接抑制p21活性的促凋亡药物的开发,并有望投入临床应用[56]。此外,有研究报道,细胞质中p21的表达与乳腺癌标志物HER-2的过表达密切相关,细胞质p21的表达与其Thr145磷酸化呈正相关,同时也与HER-2及磷酸化的AKT高度相关[29]。由此可见,在针对乳腺癌的治疗过程中,可使用AKT特异性抑制剂,以抑制其介导的p21转位,同时还可以直接针对细胞质p21及HER-2开发抑制剂,以达到抑制或减缓肿瘤增殖以及增强肿瘤细胞药物敏感性的治疗目的。
4.2.2 卵巢癌
研究发现,p21可能是卵巢癌临床治疗中一个重要的分子靶标。在高级别浆液性卵巢癌细胞(high-grade serous ovarian cancer cells,HGSCs)中,突变的p53能够介导癌蛋白PAX8的促增殖作用,反过来,PAX8能够正向调控p53的表达,从而进一步转录激活HGSCs细胞质中p21的表达,促进细胞增殖[57]。
卵巢细胞癌变过程中,细胞质p21的表达水平升高,促进卵巢癌细胞对顺铂产生耐药性,同时促进卵巢癌复发[58]。与卵巢癌细胞OV2008相比,卵巢癌细胞C13中细胞质p21的表达水平更高,并且低剂量的顺铂能够诱导OV2008细胞中的p21由细胞核向细胞质转移。总之,细胞质p21可以作为治疗耐药性卵巢癌的潜在靶标。
4.2.3 肝癌
部分人类肝癌细胞表达p21,而且p21的高表达与患者短生存期有关,敲减p21则能延缓肝癌的发生发展进程。在慢性肝损伤期间,p21是肝脏祖细胞活化必需的,但p21对肝再生的影响取决于细胞内p21的表达水平,也取决于其在肿瘤微环境中的作用。Shiraki等[59]的研究发现,在多种肝癌细胞中,p21主要定位在细胞质中,并且细胞质p21的表达在分化不完全的肝癌细胞中比分化良好的细胞中高,由此推测细胞质p21能够作为肝癌的预后靶标。
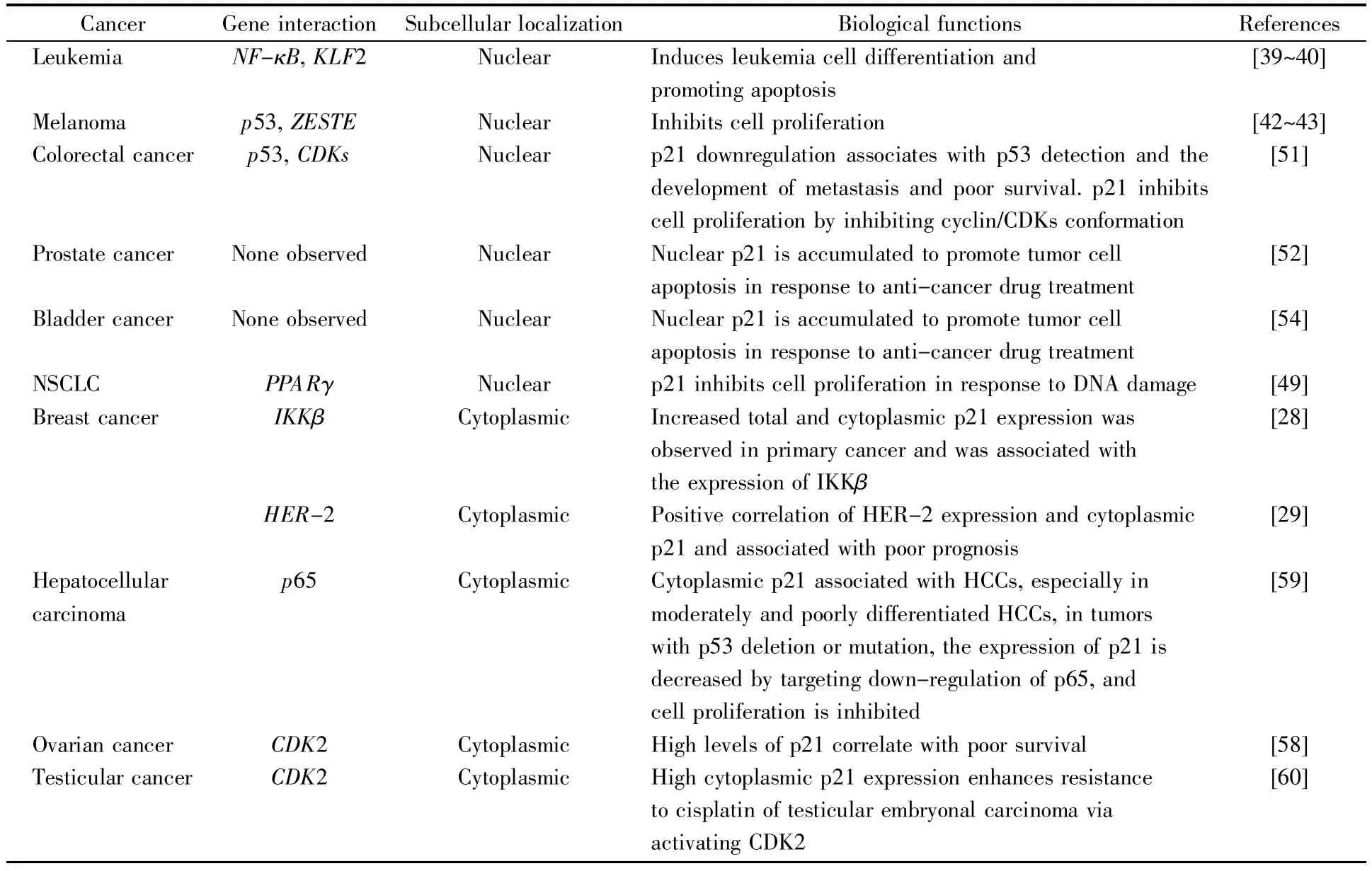
表1 p21在不同肿瘤细胞中的定位及其生物学功能Table 1 Location and biological functions of p21 in different tumor cells
4.2.4 睾丸癌
睾丸癌是泌尿外科中恶性程度很高的肿瘤之一,并且能够对化疗药物产生较强耐受性。研究发现,在睾丸胚胎癌中,细胞质p21表达升高,随后通过抑制CDK2活性使肿瘤细胞产生对顺铂的耐药性,并且这种耐药机制与Oct4/miR-106b/p21调控途径有关[60]。细胞质p21与睾丸癌的恶性程度呈正相关,可能是睾丸癌难以治愈的原因之一,未来可针细胞质p21开发治疗睾丸癌的靶向药物。
5 结语
p21对细胞周期的调控具有重要意义,且同时参与了细胞凋亡、细胞衰老以及基因的转录调控等多种重要的生理过程,对肿瘤细胞的发生发展具有关键的调控作用。多项研究表明,p21既可作为肿瘤抑制因子,也是促癌因子。由于亚细胞定位及肿瘤细胞种类的不同,p21的功能也不同。表1总结了p21在常见肿瘤中的定位及其生物学功能。当p21定位于细胞核时,能够抑制肿瘤的发生和发展;当其定位在细胞质时,能够促进乳腺癌、头颈癌、前列腺癌、睾丸癌等肿瘤细胞的增殖、侵袭、转移及耐药性。因此,充分了解p21的生物学功能及其转位调控机制能够为肿瘤靶向性的治疗提供重要的策略和方向。
