基质微环境力学与细胞生物学行为
2019-04-17朱晓嫚王纪浩谢岩黎
李 倩,朱晓嫚,王纪浩,谢岩黎*
(1.河南工业大学粮油食品学院,中国河南郑州450001;2.河南省粮油食品安全检测与控制重点实验室,中国河南郑州450001;3.中国科学院合肥物质科学研究院强磁场科学中心,中国安徽合肥230031)
在生命体中,从最小的单元——细胞到高级的组织、器官,它们在识别及相互作用过程中不仅存在着生物化学反应,而且存在着力学传导,这些活动广泛参与并影响着有机体的生长、发育、分化等生理及病理阶段。生物力学的概念最早由苏格兰科学家D’Arcy Thompson在其“生长和形式上(On Growth and Form)”的报告中提出[1],之后越来越多的物理学家和生物学家投入到生物力学的研究工作中。随着生物力学的发展,力学传导的研究对象已经从部分、简单的环境转向整体、复杂的生理环境,其研究手段也已经从单一的物理学方法转向与生物化学和分子遗传学等方法联用,这些都为深入理解力学信号如何转换为生物学信号提供了重要基础。
目前,细胞学效应的研究热点集中在细胞的黏附、迁移和分化,研究内容包括黏着斑和骨架蛋白质构象及分布的变化、细胞外基质(extracellular matrix,ECM)的合成和重构以及细胞内信号转导等。微环境产生的力学因素包括静态基质的硬度、拓扑学性质,以及流动环境的剪切应力、拉伸、压力等。细胞生物学效应与力学微环境密切相关。已有研究表明,不同组织、细胞发挥生物学活性的最佳基质弹性模量不同,如脂肪、脑细胞为100 Pa左右,肌肉组织为1 kPa,结缔组织为10 kPa,成骨细胞为100 MPa到15 GPa[2]。除了硬度之外,ECM蛋白质、基质是否连续、研究体系的维度(二维或三维)等都对细胞的黏附、迁移和分化产生重要的影响(图1)。本文将重点阐述静态基质中的力学微环境对哺乳动物细胞的黏附、迁移、分化的影响以及细胞对ECM的力学反馈。
1 基质微环境力学对细胞黏附的影响
首先,基质硬度影响细胞的黏附,黏着斑和细胞骨架蛋白质可直接反映黏附的强度[3]。早期的研究发现,交联度高的胶原蛋白(弹性模量30~100 kPa)上成纤维细胞的黏着斑稳定,黏附强度高,而柔软的凝胶(弹性模量在1 kPa左右)表面黏着斑呈现游离的、动态的变化,黏附强度低[2]。基质硬度与黏附强度的正相关不仅存在于天然的ECM蛋白质上,也存在于人工合成的多聚物凝胶上。Prager-Khoutorsky等[4]制备了不同弹性模量的聚二甲硅氧烷(polydimethysiloxane,PDMS)和聚丙烯酰胺(polyacrylamide,PAM),发现黏附在高硬度(5 kPa)多聚物上的成纤维细胞内黏着斑小且数量多,肌动蛋白分布散乱,而在弹性模量高达2 MPa的凝胶上,细胞内的黏着斑面积大、数量少,细胞骨架贯穿整个细胞。因此,黏着斑的聚集程度和细胞骨架的形貌可作为细胞黏附强度的一个重要指标。此外,基质的硬度亦影响黏着斑的成熟过程。相关研究报道,在硬度高的表面,细胞呈现各向同性的铺展,黏着斑由初始形成到成熟的过程重复出现[5],而在硬度低的表面,只能检测到细胞的初始黏附[6]。Jalali等[7]用原子力显微镜进一步研究发现,在硬度为218.85 Pa、385.58 Pa和933.2 Pa的PAM上,内皮细胞的最大解离力分别为0.28 nN、0.94 nN和1.99 nN,直接证明了硬度和黏附强度之间的量化关系。Rigato等[8]用原子力显微镜扫描发现,在硬度高的表面,细胞内聚集有更紧密的肌动蛋白纤维束。总的来讲,基质硬度作用于黏着斑和细胞骨架蛋白质,引起它们的形貌和组装变化,从而共同影响细胞的黏附强度。
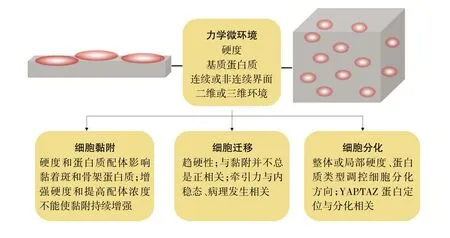
图1 基质微环境力学对细胞黏附、迁移和分化的影响Fig.1 The influence of matrix microenvironment mechanics on cell adhesion,migration and differentiation
其次,细胞黏附受ECM蛋白质的调控[9~12]。作为纤连蛋白序列中研究较多的小肽RGD(arginine-glycine-aspartic acid),它对成纤维细胞黏附的影响表现在其间距上。Arnold等[9]用纳米光刻技术制备了纳米图案化的RGD,发现当RGD的间距在58~73 nm时,细胞黏着斑稳定,而当距离大于73 nm时,细胞黏附能力减弱,这是由于过大的配体位点间距使整合素无法聚集成簇,导致黏着斑形成异常,从而引起细胞骨架蛋白质无法与其有效锚定。Ma等[13]运用微图案化技术也发现,x-y轴上修饰的各向异性纤连蛋白促进了间充质干细胞的黏附。我们制备了纤连蛋白和RGD修饰的钛合金,通过对间充质干细胞的单细胞力谱展开研究,发现在纤连蛋白III8~10结构域修饰的表面,细胞解离力比在RGD修饰的表面大,因此,我们推测基质硬度相似时,细胞黏附强度与蛋白质提供的黏附位点密度有关[14]。
最后,细胞黏附受到基质硬度和蛋白质的共同调控,但过高的硬度和配体浓度并不能使黏着斑持续增大。Oria等[15]指出,当基底的弹性模量在10~100 kPa时,间距100 nm的RGD上人乳腺肌上皮细胞的黏着斑最大,200 nm间距的配体上黏着斑最小,而当基底弹性模量小于10 kPa时,大间距的配体反而促进细胞的黏附。此外,计算机模拟和细胞学实验都表明,基质的高硬度外加高配体浓度使黏附区域中整合素的数量达到饱和,黏附力无法重新分配,从而导致黏着斑瓦解。因此,硬度与配体浓度如何精确调控细胞黏附尚需进一步实验验证,并且细胞类型与力学微环境的关联也需要深入探讨。
2 基质微环境力学对细胞迁移的影响
不同类型的细胞在相同的基质中迁移速度不同,同一类型细胞的迁移又受到其力学微环境(如硬度、基质的连续性和骨架蛋白质拉应力等)的影响。同时,细胞的迁移产生牵引力,在细胞外基质重建及细胞形态调控中发挥重要的作用,与正常生理状态的维持和病理状态的发生密切相关。
2.1 细胞迁移的影响因素
普遍的观点认为硬度高的基质促进细胞迁移,即细胞迁移有趋硬性,这在多种类型的细胞(如成纤维细胞、白细胞、肿瘤细胞等)中均有发现[16~17]。特别是肿瘤细胞,其发生和转移过程中局部基质硬度的变化范围非常大(170 Pa~1.2 kPa)[18],因此,研究硬度与肿瘤细胞转移之间的关系尤为重要,是近些年来的研究热点。已有研究表明,卵巢癌细胞SKOV3能够在PAM表面从低硬度(3 kPa)区域迁移至高硬度(25 kPa)区域[19],神经胶质瘤细胞U251在PAM上的最佳迁移硬度大约是100 kPa[20]。此外,基质的硬度范围对癌细胞的迁移也有重要的影响,例如:在不同硬度范围的PDMS上肺腺癌细胞A549的迁移状态和迁移率均有所不同,在低硬度范围(27~107 kPa)内,细胞呈独立运动形式,迁移速度快,总迁移距离长,而在高硬度范围(1.5~4.8 MPa)内,细胞呈群体运动,迁移速度很慢,总迁移距离短[21]。在此基础上,Duchez等[22]研究了多种类型的癌细胞,包括恶性胶质瘤细胞U87-MG和T98G、乳腺癌细胞MDA-MB-231以及纤维肉瘤细胞HT1080,发现它们仅在低硬度范围(2~7 kPa)内的PAM上有明显的迁移,而在高硬度范围内无明显迁移。除此之外,也有研究表明干细胞的趋硬性和硬度的梯度范围相关。Hadden等[23]发现脂肪源干细胞在基质硬度梯度为2.9~8.2 kPa/mm时,表现出趋硬性,而当基质的硬度梯度在0.5~2.9 kPa/mm时,并无趋硬性。
其次,基质的连续性对细胞迁移有重要的影响,它是通过作用于黏着斑的解体、细胞骨架蛋白质的动力学变化[24~25]来实现的。连续基质是指基质表面缺口很小,与细胞相比可以忽略不计,而不连续基质上的缺口往往达到上百纳米。二维连续基质上细胞的黏附产生正反馈,促进肌动蛋白的动力学组装,加快细胞前端伪足的运动,而在非连续基质,细胞的迁移无法通过黏附得以增强[16]。三维结构内部细胞的迁移更为复杂。在不连续的三维结构内部,Lämmermann等[26]发现,将整合素全部敲除之后,白细胞在胶原蛋白三维体系中的运动未受影响。因此,在微环境中,细胞的迁移是个复杂的过程,然而不可否认的是,黏着斑与细胞骨架蛋白质之间并不总是协同的相互作用。
2.2 细胞迁移对力学微环境的影响
Harris等[27]于1980年发现了硅胶表面黏附细胞产生的褶皱,并首次提出了牵引力的概念。牵引力是细胞对基质产生的作用力,是研究细胞迁移的重要参数,同时,细胞迁移过程中还伴随有细胞内蛋白质的核-质转运、表型的转化以及ECM的重建。力学微环境与细胞迁移之间的相互作用广泛参与一系列生理和病理反应,如B细胞免疫应答、内稳态维持、组织纤维化、癌症转移及心血管疾病发生等。已有研究报道,当PAM凝胶的硬度(0.5~1 kPa)与抗原递呈细胞接近时,B细胞发生免疫应答而被激活,产生10~20 nN的牵引力[28]。在转录因子的定位上,Mckenzie等[19]发现,卵巢癌细胞SKOV3向高硬度的PAM上转移时转录因子YAP1从细胞质转运到细胞核。细胞表型转化研究发现,高硬度的PAM(25 kPa)使胰腺星状细胞发生转化,分泌更多的ECM,导致组织纤维化[29]。Ondeck等[30]在可调控硬度的异丁烯酸甲酯(methacrylated hyaluronic acid,MeHA)上观测到乳腺上皮细胞的癌变过程,并且这个过程还和孵育时间密切相关。人们通过对多种病变组织细胞表型和细胞骨架蛋白质进行鉴定发现,成纤维细胞通常去分化为肌成纤维细胞,分化后的细胞一方面分泌大量的ECM蛋白质,另一方面通过细胞表面蛋白质联合ECM蛋白质对微环境产生巨大的拉力,从而共同提高局部组织的硬度[31~32]。病理组织的细胞牵引力实验也表明,与正常组织细胞相比,类风湿性关节炎和心肌梗塞组织中的B细胞和心肌细胞都产生了更大的牵引力[28,33]。因此,高硬度的基质引起细胞牵引力增大,是组织纤维化的原因之一。有趣的是,较大的牵引力并不总是引发组织纤维化,Elosegui-Artola等[12]提出,虽然局部的病变组织硬度升高,但是细胞却产生了较小的牵引力,使组织又恢复正常的硬度,从而维持机体的内稳态。值得注意的是,基质硬度和牵引力之间的非绝对正相关关系,不仅存在于二维平面上,也被报道存在于三维体系中。Steinwachs等[34]发现乳腺癌细胞在0.6~2.4 mg/mL的胶原蛋白凝胶中的移动速度均匀,产生的牵引力强弱变化规律,不受硬度的影响。此外,在硬度相同的3D胶原蛋白中,Koch等[35]通过比较几种不同的癌细胞,发现虽然侵袭性乳腺癌细胞MDA-MB-231和肺癌细胞A-125较非侵袭性的MCF-7和A-549细胞产生的牵引力大,但是非侵袭性外阴癌细胞A-431却产生了最大的牵引力。因此,牵引力的大小并不能作为衡量癌细胞侵袭力的唯一指标。
综上所述,细胞迁移受到复杂环境的影响,硬度与牵引力、组织纤维化之间的关系尚无定论,细胞牵引力的改变能否作为组织病变的早期检测指标之一也不明确。因此,研究细胞的迁移需要综合考虑所用细胞类型、基底硬度、二维或三维结构等多重因素。
3 基质微环境力学对细胞分化的影响
基底的硬度除了能够诱导细胞短期的黏附和迁移之外,还能够长期影响细胞分化[36~37]。由于凝胶本身并不具备细胞黏附位点,因此在实验中往往以物理吸附或者共价修饰的方法结合ECM蛋白质,如纤连蛋白、胶原蛋白等。大多数的观点认为,基质的局部硬度与干细胞分化方向之间存在正相关。Sun等[38]发现玻连蛋白覆盖的PDMS微阵列柱子可调控人全能干细胞的分化,硬度高的PDMS(1.2 MPa)诱导干细胞分化为成骨细胞,而硬度低的PDMS(5 kPa)则诱导干细胞分化为脂肪细胞,甚至当培养液中加入Smad抑制剂时,干细胞还可被诱导成为脊髓运动神经元。Vertelov等[39]制备了胶原蛋白Ⅰ覆盖的硅胶,发现当硅胶硬度为64 kPa时干细胞向成骨细胞分化,但是当其硬度较低时(0.5~16 kPa)则诱导间充质干细胞向脂肪细胞分化。该研究还发现,培养液的成分是细胞分化的辅助条件。此外,在复杂的海藻酸-琼脂糖和聚乙二醇二甲基丙烯酸酯(poly(ethylene glycol)dimethacrylate,PEGDA)三维系统中,人们发现干细胞也存在着相似的分化趋势[40]。最近,Choi等[41]对骨髓微环境进行分析时发现,当PAM的硬度与骨内膜(44 kPa)接近时,干细胞繁殖快,而当PAM的硬度与血管区(3 kPa左右)接近时,细胞趋向分化。相似的研究表明,当胶原蛋白Ⅰ涂覆的PAM硬度在0.5~10 kPa时,骨髓间充质干细胞向神经细胞和软骨细胞分化趋势明显,而当PAM硬度高于20 kPa时,干细胞向心肌细胞和成骨细胞方向分化不明显[42]。张书宁等[43]比较了不同的基质材料,发现较硬度高(>1 GPa)的玻璃基质,CD34+细胞能够被低硬度(约15 kPa)的PAM诱导分化为内皮系细胞。
然而,目前的研究对干细胞分化与不同材料基质的整体硬度之间的关系并没有得到一致的结论。Trappmann等[44]比较了胶原蛋白共价修饰的PDMS和PAM,发现在整体硬度为0.1 kPa~2.3 MPa的PDMS上,角朊细胞的分化不受硬度改变的影响,间充质干细胞在此范围内都向成骨细胞分化,而在硬度低(0.5 kPa)的PAM表面,角朊细胞和间充质干细胞都向脂肪细胞分化,在硬度高(>2 kPa)的PAM表面,两种细胞都向成骨细胞分化。该研究还指出,即使PDMS和PAM的硬度相同,但是低硬度的PAM孔隙率较大,这直接导致PAM与胶原蛋白的交联度低、蛋白质配体间距大,因此,文章提出的结论是,干细胞的分化受局部锚定位点上胶原蛋白硬度的影响,并不受基底整体弹性模量的控制[44]。针对孔隙率和蛋白质交联度对细胞分化的影响,现有研究也存在不同的结论。Wen等[45]制备了 3 种硬度(4 kPa、13 kPa 和 30 kPa)的PAM,它们可分别诱导干细胞向脂肪细胞、肌肉细胞和成骨细胞分化,当保持PAM的硬度不变时,通过调节孔隙大小在88~160 nm和RGD共价交联浓度在0.1~2.5 mmol/L,发现干细胞的分化方向均无改变。除此之外,相关研究指出,表面修饰蛋白质的类型也会影响干细胞的分化方向,如层粘连蛋白促使干细胞向脂肪细胞分化,纤连蛋白则促使干细胞向成骨细胞分化[41]。综上所述,探究微环境的细胞分化需要综合考虑基底的材料、硬度范围、孔隙率、修饰蛋白质的类型和密度等多种因素。
深入的细胞信号转导分析表明,微环境之所以能够影响细胞分化,主要是由于细胞核是通过LINC(linker of nucleoskeleton and cytoskeleton)-巢蛋白复合物与细胞骨架直接相连的[46],力学信号能够通过细胞骨架传导入细胞核。长期的力学信号刺激可引起相关基因的上调/下调以及相关蛋白质的表达变化,其中研究较多的是YAP(Yes-associated protein)和 TAZ(tafazzin)蛋白[47~48]。Dupont等[48]报道,在间充质干细胞分化过程中,细胞核内的YAP和TAZ蛋白能够直接感受ECM的硬度,其激活过程需要Rho GTP酶的参与,且独立于Hippo/LATS信号通路。Sun等[38]也提出,当PDMS的硬度变化时,人全能干细胞的Rho GTP酶参与的Hippo/YAP通路被激活,与之前研究不同的是,这个通路的激活需要LATS介导。Totaro等[49]在制备纤连蛋白修饰的PAM时发现,当PAM的弹性模量在0.7~2 kPa之间时,YAP/TAZ在细胞质中定位,下游Notch通路被激活,上皮干细胞开始分化;当弹性模量高于8 kPa时,YAP/TAZ转移至细胞核内,Notch通路被抑制,干细胞的干性得以维持。基于上述分析可知,力学微环境产生的信号能够调控细胞核内相关蛋白质的转运,这对于干细胞是否分化起着决定性的作用。
4 总结与展望
综上所述,首先,基质的硬度和蛋白质配体的浓度影响细胞黏附中黏着斑和骨架蛋白质的形貌和分布,然而过高的硬度和配体浓度并不能使黏着斑持续增强;其次,多种类型的细胞迁移有趋硬性,不仅如此,细胞迁移往往还参与了细胞外基质的重建,特别是细胞病变的发生;最后,细胞的硬度在很大程度上影响了细胞的分化,同时基质的孔隙度、蛋白质类型等也是不可忽视的影响因素。
研究力学微环境与细胞生物学效应的关系在医学应用上有着重要的意义。例如,癌症细胞的侵袭和转移受到力学微环境的调控,因此,通过改变肿瘤细胞的微环境,改变其物理化学性质,进而调控细胞对力学信号的响应[31],是研发肿瘤靶向药物的策略之一。在医学工程领域,理想的支架等仿生材料需要满足几个条件:1)精确匹配待修复组织的力学性能;2)具备良好的生物学性能,以达到良好的组织相容性、承重性、降解性等。目前,激光、磁场及原子信号扫描等研究技术已与传统的生物学方法联合,这些先进的研究方法和手段将为深入探索力学微环境下的细胞和分子机制提供一定的技术支持。
