小麦 RPD3/ HDA1基因家族的全基因组鉴定及其对热胁迫的响应
2019-04-16郑文杰党仁美刘媛媛闻珊珊
郑文杰,党仁美,丁 宁,刘媛媛,闻珊珊
(西北农林科技大学 农学院, 陕西杨凌 712100)
基因的转录是高度调控的过程,由组蛋白和DNA组成的染色质状态对基因转录有重大影响。核心组蛋白的核心区域由球形折叠区和N末端结构域组成,而发挥“信号位点”作用的N端常常被组蛋白乙酰转移酶、甲基转移酶及磷酸转移酶等作用,发生共价修饰。常见的组蛋白共价修饰包括乙酰化、甲基化、磷酸化、泛素化等。组蛋白乙酰化由组蛋白乙酰转移酶(histone acetyl transferase,HATs)和组蛋白去乙酰化酶(histone deacetylase,HDACs)共同介导[1],HATs调控的组蛋白乙酰化与基因活性的增加有关,而HDACs导致组蛋白乙酰化的逆转,抑制功能基因的转录,最终使其表达沉默[2]。
基于其同源性,真核生物HDAC可分为3个家族,RPD3/HDA1家族、Sir2家族和HD2家族[3],而RPD3/HDA1又是其中最大的一类,其蛋白的同源性很高,主要分布于细胞核和细胞质中[1],HDA1和RPD3都能介导基因的特异性并且负责全局性的去乙酰化,两者在功能上相互协作[4],催化去乙酰基团的基本结构由Zn2+和相邻的2个天冬氨酸、2个组氨酸及1个酪氨酸组成[5]。最初Pandey等[6]通过序列分析表明,拟南芥(Arabidopsisthaliana)中的RPD3/HDA1家族能够划分为Ⅰ、Ⅱ、Ⅲ类。随后,Fu等[7]对水稻(Oryzasativa)中RPD3/HDA1家族的系统发育分析,鉴定出了第Ⅳ类,Demetriou等[3]在大麦(Hordeumvulgare) 中也鉴定出4类亚家族,与水稻一致。
RPD3/HDA1家族在植物对非生物胁迫的响应中具有重要作用。水稻中RPD3/HDA1家族成员HDA705通过影响种子萌发和植物激素信号传导,参与对盐胁迫的应答过程[8-9];同样的,AtHDA19和它的部分同源基因AtHDA6共同参与对盐、干旱等非生物胁迫的调控,并且涉及到对植物激素表达的影响[10]。AtHDA6突变体对脱落酸和盐胁迫的敏感性高于野生型,且其表达受外源激素茉莉酸(JA)的诱导,有研究还发现,AtHDA6突变体有明显延迟开花的现象[11-13]。玉米(Zeamays)中RPD3/HDA1家族成员ZmHDAC102、ZmHDAC108和ZmHDAC110在低温胁迫下表达量上升,三者都能激活各自低温诱导基因的转录[14],ZmHDA101通过参与组蛋白修饰来调控基因表达,进而影响玉米的生长和发育[15]。
温度对小麦生长发育的影响贯穿整个生长周期,是限制小麦产量和品质的重要因素之一,全球平均气温的升高,直接影响到灌浆期等小麦生长的关键时期,小麦产量和品质受到了前所未有的影响[16]。关于RPD3/HDA1家族在逆境胁迫中的研究在拟南芥[10]、水稻[8-9]和大麦[3]等植物中已有相关报道,小麦中还鲜有研究,且有关RPD3/HDA1基因在高温胁迫下的研究尚未见报道,因此本试验运用生物信息学方法对小麦RPD3/HDA1家族基因进行全基因组鉴定,并对其在热胁迫下的表达模式进行分析,以期能够完善RPD3/HDA1家族基因的功能注释,寻找小麦RPD3/HDA1家族候选耐热基因,为小麦在耐热方面的遗传改良工作提供参考。
1 材料与方法
1.1 小麦的培养和处理
将‘中国春’小麦种植于温度为(23±1) ℃,光/暗周期=16/8 h,相对湿度为60%的BIC-300人工气候箱(博讯,上海)中7 d左右,在两叶一心期时移入[V(基质)∶V(蛭石)=3∶1]比例的混合土壤中,转移到温室中生长。选用正常生长的小麦,在出苗后3 d、出苗后7 d、分蘖期、分蘖-起身期、拔节期、拔节后期、孕穗前期、抽穗期、开花期、灌浆前期、灌浆期和灌浆末期这12个生长时期取材,并在人工气候箱中进行1 h的热胁迫处理,处理温度分别为35 ℃和42 ℃,将未做热处理的小麦做为对照,剪取对照和处理组的叶片置于-80 ℃冰箱冻藏,用于后续qRT-PCR分析。
1.2 小麦 RPD3/HDA1家族基因的筛选
从Ensembl Plants(http://plants.ensembl.org/index.html)下载小麦的所有蛋白质数据,构建本地的BLAST数据库;随后从Pfam(http://pfam.xfam.org/)下载HDAC的隐马尔可夫模型(HMM)(PF00850)作为query,使用HMMER3.0(http://hmmer.org/download.html)的hmmsearch工具包来查找本地蛋白数据库中所有可能的HDAC蛋白序列,参数为E<1.5e-5。利用InterPro(http://www.ebi.ac.uk/interpro/)和NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)排除冗余序列。使用Compute pI/Mw(http://web.expasy.org/compute_pi/)计算其理论等电点(pI)和分子质量(Mw),使用CELLO(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测。
1.3 系统发育树构建、基因结构和蛋白结构分析
利用Clustal_W将小麦、拟南芥和水稻的RPD3/HDA1序列进行多重比对,比对结果用MEGA6.0软件的邻接法(NJ)构建进化树,Bootstrap值设置为1 000;从Ensembl Plants中获取各候选基因的全长、cDNA和CDS序列,使用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)分析RPD3/HDA1基因的外显子/内含子结构,使用MEME工具(http://meme-suite.org/index.html)分析其保守结构域。
1.4 染色体分布、同源复制和顺式作用元件分析
从Ensembl Plants中获取各候选基因的染色体位置信息,根据小麦RPD3/HDA1基因两两之间的BLAST结果获取基因同源复制事件,利用Circos0.67软件将两者结果可视化,其中同源复制事件用曲线连接;运用Plant Care(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 预测各基因的启动子的顺式作用元件。
1.5 小麦 RPD3/HDA1家族基因在热胁迫的表达分析
从WHEAT EXP(https://wheat.pw.usda.gov/WheatExp/)获得各基因在5种不同组织或器官(籽粒、穗、叶、根、茎)的转录组数据。从NCBI Short Read Archive(https://www.ncbi.nlm.nih.gov/sra/)获得了干旱胁迫(SRR1542407和SRR1542409)和热胁迫(SRR1542411和SRR1542413)的转录组数据,利用TopHat和Cufflinks进行转录组reads的全基因组mapping,计算各个RPD3/HDA1基因的FPKM值,鉴定差异表达基因[17],用TBtools汇集并绘制表达图谱。
用Tzizol试剂(生工,上海)提取小麦叶片总RNA,采用Transcriptor First Strand cDNA Synthesis Kit(罗氏,德国)进行反转录,利用Light Cycler 480(罗氏,德国)荧光定量仪,采用Ultra SYBR Mixture(康为世纪,北京)荧光定量试剂进行qRT-PCR分析,程序参照Ultra SYBR Mixture说明书,所用特异性引物如表1,各样品进行3次生物学重复,测定时作3次技术重复,数据处理采用2-ΔΔCt法[18]。

表1 荧光定量PCR引物Table 1 Primers for qRT-PCR
2 结果与分析
2.1 小麦 RPD3/HDA1基因家族成员筛选
利用BLASTP和HMM建模筛选2种方法,从小麦基因组中筛选到60个RPD3/HDA1候选基因,去除蛋白结构不完整的基因,与已经报道的大麦、拟南芥、水稻的RPD3/HDA1家族成员的氨基酸序列进行比对筛选,最终得到36个小麦RPD3/HDA1基因,根据进化树聚类分布以及文献中RPD3/HDA1家族中“HHA”、“DIDIH”等氨基酸残基的特征[3]将其分为Ⅰ、Ⅱ、Ⅲ和Ⅳ 4类,按照其亚组分类和基因在染色体上的位置命名。亚细胞定位预测结果显示,其中26个基因定位在细胞质中,10个基因定位在细胞周质中。这些基因成员的等电点介于4.71~8.73,分子质量介于35.2~59.4 ku,蛋白序列长度为314~698 aa。
2.2 小麦 RPD3/HDA1基因系统进化、基因结构和保守结构域分析
为明确小麦RPD3/HDA1家族成员的分类,基于氨基酸序列,用MEGA6.0将已经报道的水稻、拟南芥的RPD3/HDA1基因与小麦的RPD3/HDA1基因进行聚类分析,结果如图1,这3个物种的基因被分为ClassⅠ、ClassⅡ、ClassⅢ、ClassⅣ 4个类群,水稻和拟南芥的基因分布于每个聚类之中,蛋白序列的相似性说明这3个物种的RPD3/HDA1基因可能具有相似的生物学功能。小麦在ClassⅠ亚族中有16个基因成员,ClassⅡ亚族有14个成员,ClassⅢ和ClassⅣ各有3个成员。
小麦RPD3/HDA1基因家族的聚类(图2-A)与基因结构(图2-B)显示,结构最简单的基因是TaHDAC-Ⅰ-5a和TaHDAC-Ⅰ-5d,其外显子数目只有1个,没有内含子,推测两者的功能具有高度保守性;TaHDAC-Ⅱ-2a和TaHDAC-Ⅱ-2b的结构最为复杂,外显子16个,内含子15个。同一染色体组的基因结构极其相似,而不同染色体组间的基因结构差异明显,ClassⅡ和ClassⅢ亚族之间的基因结构差异较小,内部成员基因结构也基本一致,ClassⅠ亚族内部成员之间差异显著,ClassⅣ和其他亚族间的差异较显著。
小麦保守结构域的组成和数目分析结果如图2-C,小麦RPD3/HDA1家族共有15个保守的蛋白基序,各个聚类内小麦基因的保守结构域比较相似,其中ClassⅢ和ClassⅣ各自的内部保守基序完全一致,基序1、3、5和6最为保守,基本覆盖了全部的家族成员,说明这4个基序与RPD3/HDA1家族的生物学功能有密切联系,但具体功能有待进一步研究。基序9和基序13仅存在于Ⅱ和Ⅳ亚组,基序10和基序2只出现于亚组Ⅰ,基序12在亚组Ⅱ中没有出现过。
2.3 小麦 RPD3/HDA1基因的染色体分布和同源复制
根据Ensembl Plants中的染色体注释信息,将小麦RPD3/HDA1基因在染色体中的位置进行图示(图3),所有的36个基因都分布在A、B、D 3个同源染色体组中, A组有11个,B组有12个,D组有13个,唯独在3A和4A染色体上是空缺的,说明这两条染色体上的RPD3/HDA1基因发生了缺失。基因同源复制结果表明,一共有35个RPD3/HDA1基因组成了28对同源基因对,结合图1和图2-A发现,这些同源基因对基因在进化关系上具有良好的近缘关系。
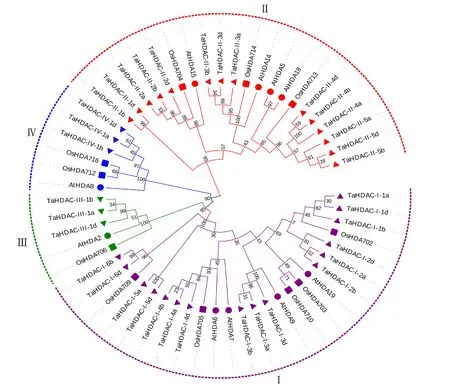
Ta.Triticumaestivum; Os.Oryzasativa; At.Arabidopsisthaliana;三角形代表Ta RPD3/HDA1s,圆形代表AtRPD3/HDA1s,矩形代表OsRPD3/HDA1sTriangles represent TaRPD3/HDA1s, circles represent AtRPD3/HDA1s, rectangles represent OsRPD3/HDA1s;紫色代表ClassⅠ亚家族,红色代表ClassⅡ亚家族,绿色代表ClassⅢ亚家族,蓝色代表ClassⅣ亚家族 Purple represents ClassⅠ subfamily, red represents Class Ⅱ subfamily, green represents Class Ⅲ subfamily, and blue represents ClassⅣ subfamily
图1小麦、拟南芥和水稻RPD3/HDA1基因家族的系统进化树
Fig.1PhylogenetictreeofRPD3/HDA1genesinwheat,Arabidopsisandrice

图2 小麦 RPD3/HDA1基因的系统进化(A)、基因结构(B)和保守结构域(C)Fig.2 Phylogeny relationships(A), gene structure(B) and conserved domain(C) of RPD3/HDA1 genes in wheat
2.4 小麦 RPD3/HDA1基因的顺式作用元件
为进一步了解RPD3/HDA1基因的功能,通过Plant Care网站分析小麦RPD3/HDA1基因的启动子区域,结果如图4表明, 48个顺式作用元件按其功能分为11个组别,所有基因都含有与光(Light)有关的作用元件如G-box元件,表明小麦RPD3/HDA1基因与光合作用有关;36个基因中有75%的基因具有与茉莉酸(JA)激素代谢相关的作用元件,最多的TaHDAC-Ⅰ-1b和TaHDAC-Ⅳ-1b具有8个;77.78%的基因具有脱落酸调控相关元件;其他组别如冷(55.56%)、干旱(77.78%)和热(50%)相关的响应元件中的基因数目都超过1/2;除此以外,还有7个基因含有病害相关的作用元件。
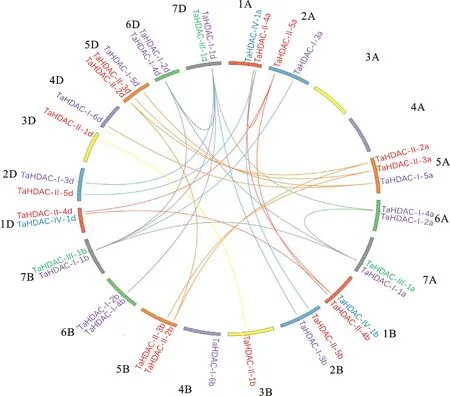
图3 小麦 RPD3/HDA1基因在染色体上的定位及同源基因在A、B和D亚基因组中的关系Fig.3 Localization of wheat RPD3/HDA1 gene on chromosome and relationship of homologous genes in A, B and D sub-genomes
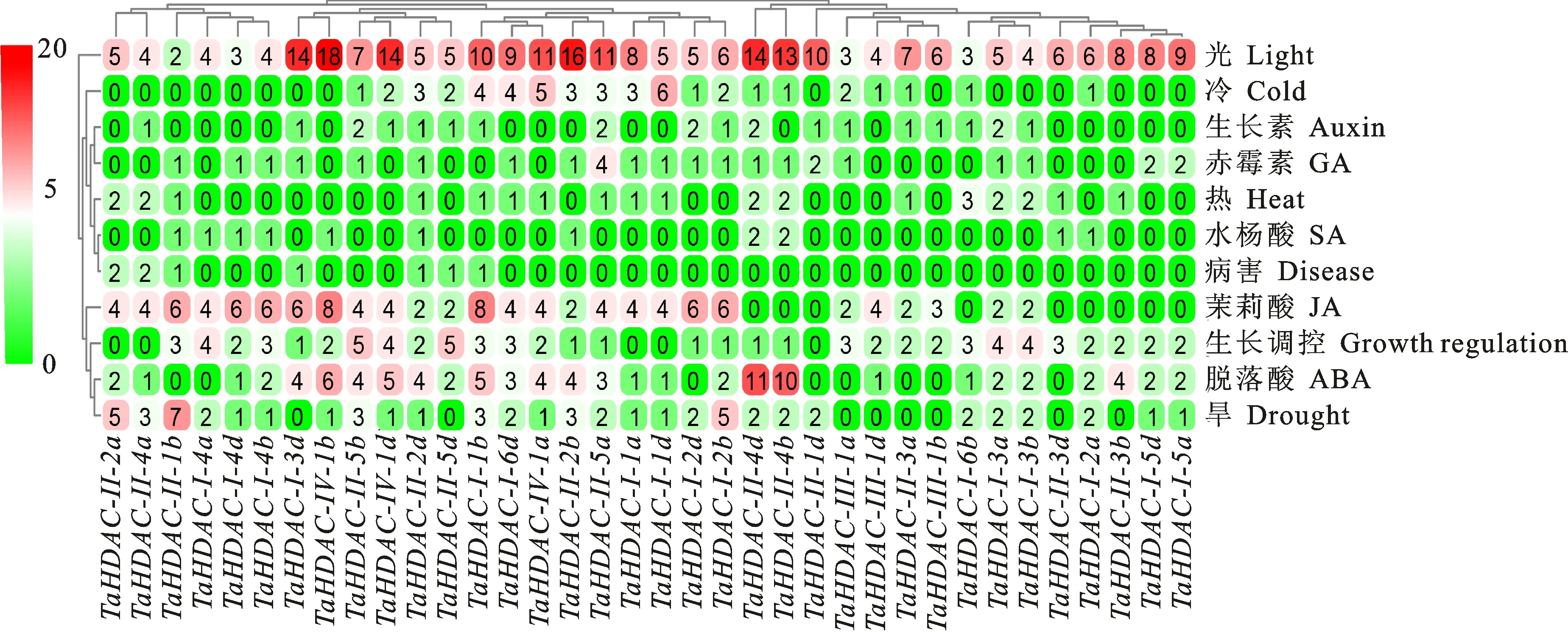
从绿色到红色,顺式作用元件的数目逐渐增多,白色是中间值 From green to red, the numbers of cis-acting elements gradually increase, and white is the intermediate value;矩形中的数字代表顺式作用元件的个数 The number in the rectangle represents the number of cis-acting elements
图4小麦RPD3/HDA1基因的顺式作用元件分析
Fig.4Analysisofcis-actingelementsofwheatRPD3/HDA1genes
2.5 小麦 RPD3/HDA1基因在不同组织和不同胁迫下的表达模式
为探究小麦RPD3/HDA1基因在不同组织(籽粒、穗、叶、根、茎)中的表达模式,从WheatExp中获取小麦RPD3/HDA1基因在各组织中的表达量,利用TBTools软件将结果可视化(图5-A)。小麦RPD3/HDA1不同基因成员在各组织中的表达量差异显著,TaHDAC-Ⅰ-2a、TaHDAC-Ⅰ-2b、TaHDAC-Ⅰ-2d、TaHDAC-Ⅰ-4a、TaHDAC-Ⅰ-4b、TaHDAC-Ⅰ-4d这6个基因在5种组织中的表达量都比较高;TaHDAC-Ⅱ-3a、TaHDAC-Ⅱ-3b、TaHDAC-Ⅱ-3d在叶片中的表达量明显高于其他组织;TaHDAC-Ⅱ-1b在穗中的表达量比位于同一染色体上的TaHDAC-Ⅱ-1d高。 为了进一步研究小麦RPD3/HDA1基因在胁迫下的表达水平,利用SAR数据库中获取的RNA-seq数据,分析小麦RPD3/HDA1家族基因在干旱胁迫1 h、热胁迫1 h以及旱热共胁迫1 h下的表达模式。如图5-B所示,TaHDAC-Ⅰ-2d、TaHDAC-Ⅰ-2a和TaHDAC-Ⅰ-2b的表达量在热胁迫1 h和旱热共胁迫1 h后都出现了不同程度的明显上调,结合干旱胁迫1 h后全部基因的表达情况,TaHDAC-Ⅰ-2d、TaHDAC-Ⅰ-2a在旱热共胁迫下引起的表达量上调是由热胁迫主导的,同理,TaHDAC-Ⅱ-3a、TaHDAC-Ⅱ-3b和TaHDAC-Ⅱ-3d在旱热共胁迫1 h后引起的表达量下降也是由热胁迫主导的。相比这6个基因,其他基因对热胁迫的响应不够显著,所以此6个基因可初步认为是小麦RPD3/HDA1家族里对热胁迫较敏感的基因。
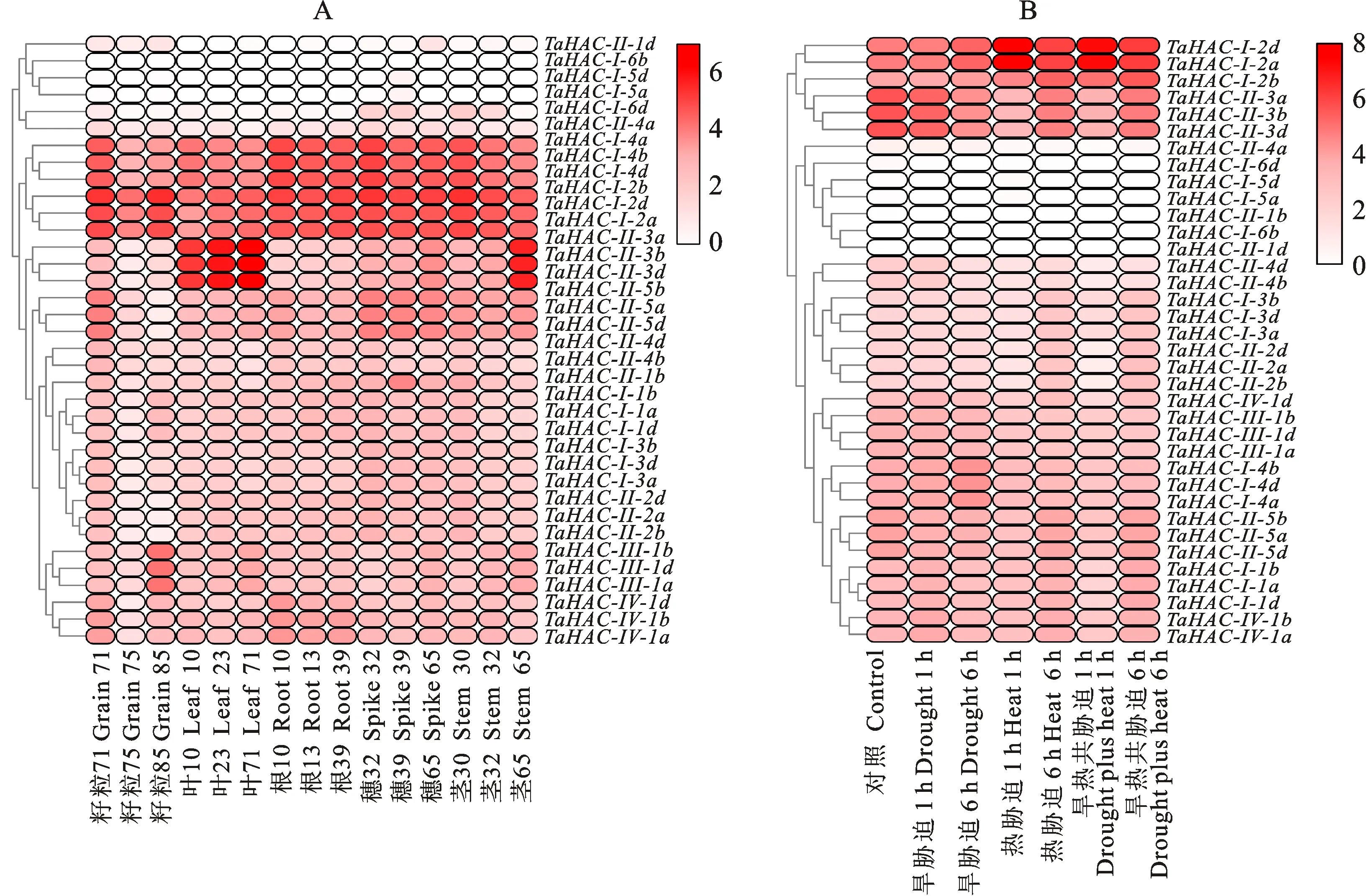
图5 小麦 RPD3/HDA1基因在不同组织中(A)和不同胁迫(B)下的表达模式Fig.5 Expression pattern of wheat RPD3/HDA1 genes in different tissues(A) and different stresses(B)
2.6 RPD3/HDA1基因在小麦不同生长发育时期热胁迫下的表达模式
为了明确RPD3/HDA1基因在热胁迫下的表达模式,选取TaHDAC-Ⅱ-3a、TaHDAC-Ⅱ-3b、TaHDAC-Ⅱ-3d、TaHDAC-Ⅰ-2d、TaHDAC-Ⅰ-2a和TaHDAC-Ⅰ-2b这6个对热胁迫有明显响应的基因,分析其在小麦12个不同生长发育时期短时间热处理后的叶片中的相对表达量。qRT-PCR结果(图6)表明:TaHDAC-Ⅰ-2a在拔节期(是对照组的17.55倍)和灌浆前期(14.2倍)热处理后的表达量有明显的提升,TaHDAC-Ⅰ-2b在出苗7 d(18.41倍)、分蘖-起身期(17.07倍)、抽穗期(37.43倍)和灌浆后期(22.83倍)热处理后的表达量上升最显著;TaHDAC-Ⅰ-2d在分蘖-起身期热处理后检测不到表达信号,但在拔节期(23.92倍)、开花期(34.02倍)和灌浆后期(19.81倍)热处理后表达量上升明显;这3个基因受42 ℃胁迫后的表达量增幅比受35 ℃胁迫后的大,TaHDAC-Ⅰ-2b的在抽穗期有8.51倍的差距;TaHDAC-Ⅱ-3a、TaHDAC-Ⅱ-3b、TaHDAC-Ⅱ-3d的在出苗7 d和拔节期以外的时期均呈现出受热胁迫后表达量下降的趋势,与对照组相比,TaHDAC-Ⅱ-3d在孕穗前期的35 ℃热胁迫后下降14.57倍,TaHDAC-Ⅱ-3b在分蘖期以外的其他时期呈现35 ℃后表达下调然后在42 ℃上调的态势,甚至在拔节期和开花期超过对照组。

A.出苗3 d 3 days after germination;b.出苗7 d 7 days after germination;c.分蘖期 Tillering stage;d.分蘖-起身期 Erecting;e.拔节期 Early jointing;f.拔节后期 Late jointing;g.孕穗前期 Early booting;h.抽穗期 Heading stage; i.开花期 Flowering;j.灌浆前期 Early stage of grain filling;k.灌浆期 Filling;l.灌浆后期 Late grain filling stage
图6RPD3/HDA1基因在小麦不同发育时期热胁迫下的表达水平
Fig.6ExpressionlevelsofRPD3/HDA1genesunderheatstressatdifferentgrowthstagesofwheat
3 讨 论
小麦是全世界广泛种植的粮食作物之一,其应对环境胁迫的能力直接影响产量的高低和品质的好坏。中国作为小麦主要种植产区之一,在小麦抵御高温、干旱等胁迫的研究中都取得了优异的进展。基于小麦基因组的庞大和复杂性,一直以来人们都受限于对新基因的挖掘。小麦基因组序列组装成功,为小麦能应用生物信息学的手段预测候选新基因奠定了坚实的基础。植物的生长与各种基因的时空表达和基因组水平的调控息息相关。由HATs和HDACs共同动态调控的组蛋白乙酰化修饰,与染色质的结构和基因的表达密切相关,其修饰方式参与了植物生长的整个生育期,同时也是研究植物对逆境胁迫的响应机理的切入点之一。前人对组蛋白去乙酰化酶的研究多集中在拟南芥(12个)[19],水稻(14个)和玉米(6个)等物种中[3],而对小麦RPD3/HDA1基因的研究较少,本研究利用生物信息学方法,系统鉴定出小麦的36个RPD3/HDA1基因,并且从结构分析、进化角度以及对热胁迫下的表达模式等方面进行了分析。
前人对拟南芥和水稻的RPD3/HDA1蛋白结构分析[3,7],将其划分为4个亚组,本研究通过进化树分析以及对蛋白基序分析也将小麦的RPD3/HDA1基因划分为Ⅰ、Ⅱ、Ⅲ和Ⅳ类,基因结构以及蛋白基序分析表明,小麦RPD3/HDA1家族基因具有多样的基因结构和保守结构域,这种结构上的多样性导致功能上的分化以更好的适应复杂多变的外界环境。已经报道的水稻和拟南芥的RPD3/HDA1基因与植物生长发育及非生物胁迫有关,例如位于Ⅰ类的AtHDA6、AtHDA19和HDA705[8-10]在生长发育和逆境胁迫中都发挥着作用,由此推测小麦RPD3/HDA1中的Ⅰ类基因可能也具有相似的生物学功能。
AtHDA6的光信号通路研究表明光照能影响拟南芥染色质的状态,这一过程是靠组蛋白修饰因子实现的[20],本研究的顺式作用元件分析显示,所有被鉴定到的RPD3/HDA1基因都含有光响应元件,TaHDAC-Ⅳ-1b和TaHDAC-Ⅱ-2b分别含有18个和16个,但与光合作用的关联仍需进一步的试验去证明;除此以外, 本研究中75%以上的基因含有茉莉酸和脱落酸响应元件,这也与Chen等[10]对AtHDA6参与脱落酸和茉莉酸调控网络的研究一致,具体表现在其突变体对脱落酸的敏感性高,且其表达受外源激素(JA)的诱导。顺式作用元件的数量和分类揭示了小麦RPD3/HDA1基因在激素调控和多种非生物胁迫中都有响应。
Liu等[21]的RNA-seq数据分析表明,小麦RPD3/HDA1基因在不同组织中的表达量并不一致,这与拟南芥在不同发育时期的表达量不同是一致的[22-23],本研究中,同一染色体组基因在不同组织中的表达模式相似,个别的如TaHDAC-Ⅱ-4a、TaHDAC-Ⅱ-1d与其染色体上其他基因在组织内的表达量略有差异,这可能是因为基因在染色体进化的过程中发生了功能的缺失。ZmHDAC102、ZmHDAC108和ZmHDAC110在低温胁迫下其表达量上升[14],本研究根据对逆境胁迫下基因表达模式的分析及qRT-PCR的验证发现,TaHDAC-Ⅰ-2d、TaHDAC-Ⅰ-2a和TaHDAC-Ⅰ-2b在热胁迫1 h后表达量有明显的上调,而TaHDAC-Ⅱ-3a、TaHDAC-Ⅱ-3b、TaHDAC-Ⅱ-3d却恰好相反,因为这两组基因来自不同的聚类,猜测它们在热胁迫中行使的功能是不同的,但从另一方面看,其与热胁迫都有关联。此外多数基因在小麦拔节期、开花期和灌浆后期的表达量明显提高,可能激活了高温诱导基因的转录。荧光定量结果与RNA-seq数据的统计基本一致,TaHDAC-Ⅱ-3d在拔节期的热处理后表达量上升,这与转录组测序数据相反,同一基因在不同时期对热的响应是不同的,结合图6可知,这6个基因对42 ℃高温有更强烈的响应,说明植物对不同温度胁迫的响应并不相同,需要进一步探究热胁迫中温度的变化对基因表达的影响。
