铜催化酰胺和溴代嘧啶胺的碳氮偶联反应
2019-04-15张亚洲王翠玲殷玉英刘毅锋
张亚洲,王翠玲,张 娟,殷玉英,刘毅锋
(1.西北大学 化工学院,陕西 西安 710069;2.西北大学 生命科学学院,陕西 西安 710069)
N-芳基酰胺是许多天然产物中的重要结构单元,对医药、生物、材料科学等领域有着重要影响,一些N-芳基酰胺已被成功的用于靶向治疗癌症[1-3]。基于这类物质广泛的重要性,其合成方法一直是研究人员关注的重点。1901年乌尔曼(Ullmann)首次提出用胺和卤代芳烃反应形成碳氮(C—N)键,从而生成N-芳基胺类化合物。但反应条件苛刻,需要高温(180℃)和化学计量的铜试剂。GoldBerg等在Ullmann反应的基础之上,进行了改良。使得反应条件有所降低,也扩大了底物的种类范围。Hartwig等[4-6]采用钯催化这类反应,在较低的反应温度下方便地合成出了N-芳基胺。但是,钯催化剂价格昂贵,毒性较大,稳定性差,且反应时依赖于剧毒的有机膦做配体。在马大为和Buchwald等人[7-8]采用碘化亚铜做催化剂,二元胺为配体,使得铜催化的C—N偶联反应更加实用化。
上述N-芳基胺的合成方法,同样也适用于以卤代芳烃和酰胺进行C—N偶联反应合成N-芳基酰胺。但是,酰胺的碱性相对于芳香胺弱得多,不易进行C—N偶联反应,反应产率低。所以,提高卤代芳烃和酰胺的C—N偶联反应产率,一直是近年来的研究重点[9-13]。我们采用碘化亚铜作催化剂,二甲基乙二胺(DMEDA)为配体,甲苯为溶剂,同时在碳酸钾,结晶硫酸钠和D-抗坏血酸钠(D-NaAsc)的作用下,在开放的体系中使N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺和一系列芳香酰胺进行反应,并得到了相应的N-芳基酰胺。本方法产率高,方法简便,具有一定实用价值。
1 实验部分
1.1 试剂与仪器
碳酸钾、氢氧化钠,分析纯,天津市瑞金特化学品有限公司;乙酰胺、苯甲酰胺,化学纯,上海化学试剂有限公司试剂一厂;4-(4-甲基哌嗪-1-甲基)苯甲酰胺、对甲氧基苯甲酰胺、间甲基苯甲酰胺和邻甲基苯甲酰胺,自制[14];异丙醇,分析纯,天津市富宇精细化工有限公司;甲苯、二甲苯,化学纯,天津科密欧化学试剂开发中心;5-溴-2-甲基苯胺、乙酰吡啶、N,N-二甲基甲酰胺二甲缩醛、50%单氰胺、碘化亚铜、D-抗坏血酸钠和二甲基乙二胺,化学纯,上海阿拉丁试剂;结晶硫酸钠、正己烷、乙二醇,分析纯,天津化学试剂有限公司。
熔点仪:WRS-1B数字熔点仪(温度计未校正)(上海易测仪器设备有限公司);元素分析仪:PE-2400型元素分析仪(美国, PerkinElmer公司);核磁共振仪:VARIAN INOVA-400MHz超导核磁共振仪(美国,瓦里安公司)。
1.2 实验方法
1.2.1 嘧啶溴苯胺的合成
1)3-(二甲基氨基)-1-(3-吡啶基)-2-丙烯-1-酮(6)的合成
在100mL三口反应烧瓶中,分别加入乙酰吡啶(0.1mol)和N,N-二甲基甲酰胺二甲缩醛(0.12mol),并加入30mL二甲苯溶剂,回流温度下搅拌12h。然后,经过冷冻结晶、过滤得到粗产物,再用二甲苯重结晶,正己烷洗涤,再烘干后,得到淡黄色晶体15.2g,产率86.0%,熔点:81.1~81.8℃(文献值[15]:81.5~82.2℃)。
2)5-溴-2-甲基苯胍硝酸盐(5)的合成
在100mL三口反应烧瓶中,加入2-甲基-5-溴苯胺14.9g和甲醇30mL,在搅拌下,慢慢加入65%(体积分数)硝酸8.7g,然后慢慢滴加50%单氰胺10.1g,约1h加完,然后,再加入65%硝酸3.0g。加完后继续回流反应12h后,蒸出约60%的甲醇,倒入烧杯,冷却结晶,过滤,干燥,得到淡黄色晶体18.4g,产率79.0%,熔点:183~184℃。
3)N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺(7)的合成
在100mL三口反应烧瓶中,加入5-溴-2-甲苯基胍硝酸盐18.4g,3-(二甲胺基)-1-(3-吡啶基)-2-丙烯-1-酮12.3g,碳酸氢钠5.3g,并加入溶剂乙二醇单甲醚30mL,然后,回流8h。降温至80℃,热过滤除去硝酸钠,再倒入烧杯,冷却结晶,过滤,用水洗涤,得到白色粉末状固体14.7g,产率68.2%。
1.2.2 N-芳基酰胺的合成 在50mL三口反应烧瓶中,分别加入1mmol N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺,1.2mmol芳香酰胺,0.2mmol CuI,2mmol K2CO3,0.16mmol结晶硫酸钠,0.1mmol D-抗坏血酸钠,0.1mmolDMEDA,以及20mL甲苯,加热至回流,反应24h。反应完成后趁热倒出,有固体析出,冷却至室温,抽虑,干燥后加水煮沸,再次进行抽虑,最后用异丙醇溶解,滤除不溶物,母液冷却静置后析出结晶,过滤,并在70~80℃烘干,得到目标产物。
N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺 (7)
白色粉末状固体,m. p. 158.4-158.9℃,元素分析(C16H13BrN4)/%:计算值:C 56.32;H 3.84;N 16.42;实测值:C 56.45;H 3.79;N 16.46。1H NMR (400 MHz, CDCl3)δ9.28 (s, 1H), 8.76 (d,J=3.6 Hz, 1H), 8.55 (d,J=5.2 Hz, 1H), 8.41 (d,J=8.0 Hz, 1H), 7.47 (m,J=7.9, 4.9 Hz, 1H), 7.24 (d,J=5.2 Hz, 1H), 7.21-7.14 (d, 1H), 7.10 (d,J=8.1 Hz, 1H), 7.03 (s, 1H), 4.09 (s, 1H), 2.34 (s, 3H)。
N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 乙酰胺(1a)
白色粉末状晶体,m. p.219.5~219.7℃,(文献值[16],m. p.220~221℃)。元素分析(C18H17N5O)/%:计算值:C 67.70;H 5.37;N 21.93。实测值:C 67.64;H 5.39;N 21.90。
1H NMR (400 MHz, CDCl3)δ9.26 (s, 1H), 8.50 (d,J=5.1 Hz, 1H), 8.44 (d,J=7.9 Hz, 1H), 8.01 (s, 1H), 7.95 (d,J=11.2 Hz, 1H), 7.50-7.31 (m, 2H), 7.17 (d,J=5.3 Hz, 3H), 6.99 (s, 1H), 4.00 (s, 1H), 2.32 (s, 3H), 2.17 (s, 3H)。
N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 苯甲酰胺(1b)
淡黄色粉末状晶体,m. p. 187.1~188.6℃。元素分析 (C23H19N5O)/%:计算值:C 72.42;H 5.02;N 18.36。实测值:C 72.38;H 5.09;N 18.34。1H NMR (400 MHz, CDCl3)δ9.25 (s, 1H), 8.60 (d,J=1.4 Hz, 1H), 8.52 (d,J=4.9 Hz, 1H), 7.92 (s, 1H), 7.89 (d,J=7.1 Hz, 1H), 7.59-7.24 (m, 6H), 7.24-7.11 (m, 3H), 7.04 (s, 1H), 4.03 (s, 1H), 2.35 (s, 3H)。
2-甲基-N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 苯甲酰胺(1c)
白色粉末状固体,m. p. 206.8~207.1℃,元素分析(C24H21N5O)/%:计算值:C 72.89;H 5.35;N 17.71。实测值:C 72.86;H 5.39;N 17.78。1H NMR (400 MHz, CDCl3)δ8.90 (s, 1H), 8.56 (d,J=9.6 Hz, 2H), 8.02-7.97 (m, 3H), 7.87-7.84 (m, 2H), 7.27-7.23 (m, 2H), 7.19 (dd,J=15.1, 6.2 Hz, 3H), 7.07 (s, 1H), 4.02 (s, 1H), 2.52 (s, 3H), 2.33 (s, 3H)。
3-甲基-N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 苯甲酰胺(1d)
白色粉末状固体,m. p. 190.2~190.5℃,元素分析(C24H21N5O)/%:计算值:C 72.89;H 5.35;N 17.71。实测值:C 72.81;H 5.29;N 17.78。1H NMR (400 MHz, CDCl3)δ8.91 (s, 1H), 8.66-8.48 (m, 1H), 7.94 (s, 0H), 7.79-7.61 (m, 1H), 7.36 (dd,J=16.4, 7.2 Hz, 1H), 7.27 (d,J=5.6 Hz, 0H), 7.21 (dd,J=11.7, 5.6 Hz, 1H), 7.08 (s, 0H), 4.01 (s, 0H), 2.45 (s, 1H), 2.36 (s, 1H)。
4-甲氧基-N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 苯甲酰胺(1e)
浅黄色粉末状固体,m. p. 178.9~179.2 ℃,元素分析(C24H21N5O2)/%:计算值:C 70.06;H 5.14;N 17.02。实测值:C 69.95;H 5.18;N 17.11。1H NMR (400 MHz, CDCl3)δ8.93-8.87 (s, 1H), 8.58 (d,J=17.3 Hz, 2H), 7.96-7.72 (m, 3H), 7.26 (dd,J=28.2, 9.4 Hz, 5H), 7.06 (d,J=8.3 Hz, 2H), 7.00 (s, 1H), 4.08 (s, 1H), 3.89 (s, 3H), 2.37 (s, 3H)。
4-[(4-甲基-1-哌嗪)甲基] -N-[4-甲基-3-[[4-(3-吡啶基)-2-嘧啶基] 胺基] 苯基] 苯甲酰胺(1f)
白色粉末状固体,m. p. 206.5~206.9℃,(文献值[17],m. p. 206~209 ℃)。元素分析,(C29H31N7O)/%:计算值:C 70.56;H 6.33;N 19.86。实测值:C 70.55;H 6.29;N 19.90。1H NMR (400 MHz, CDCl3)δ9.24 (s, 1H), 8.55 (d,J=31.9 Hz, 2H), 7.92 (s, 1H), 7.83 (d,J=7.8 Hz, 1H), 7.44 (d,J=7.7 Hz, 3H), 7.21 (ddd,J=54.2, 35.9, 28.1 Hz, 6H), 4.02 (s, 1H), 3.56 (s, 2H), 2.48 (d,J=2.2 Hz, 6H), 2.35 (s, 3H), 2.29 (s, 3H)。
2 结果与讨论
以芳香腈类物质为原料,用偏铝酸钠作为催化剂,使芳香腈高选择性地水解成了相应的芳基酰胺[14]。然后,使其和N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺进行C—N偶联反应,生成N-嘧啶胺基苯基取代苯甲酰胺类化合物。总反应式如图1所示。
2.1 碱的种类对C—N偶联反应的影响
为了考察碱的种类对酰胺和卤代芳烃的C—N偶联反应的影响,我们以N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺和4-(4-甲基哌嗪-1-甲基)苯酰胺的偶联反应为模型,分别选用了CsCO3,K3PO4,KOH和K2CO3作为适配碱,并采用2倍于反应底物量的碱进行反应。其他反应条件为:催化剂0.2mmol CuI;配体:0.1mmol DMEDA,0.16mmol结晶硫酸钠;抗氧剂0.1mmol D-NaAsc;溶剂甲苯。反应结果如表1所示。
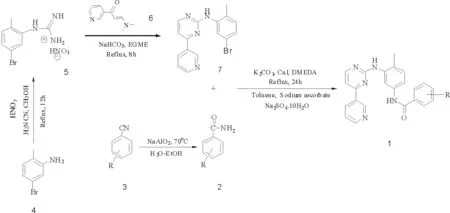
图1 N-嘧啶胺基苯基取代苯甲酰胺类化合物合成路线图Fig.1 Schematic synthetic procedure of N-pyrimidine aminophenyl substituted benzamides
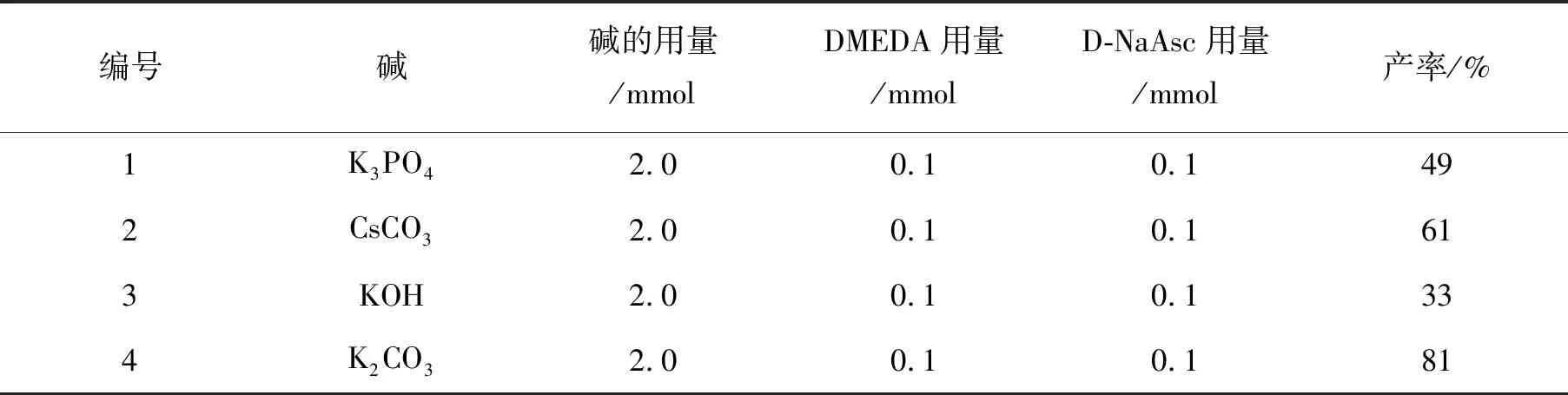
编号碱碱的用量/mmolDMEDA用量/mmolD-NaAsc用量/mmol产率/% 1K3PO42.00.10.149 2CsCO32.00.10.161 3KOH2.00.10.133 4K2CO32.00.10.181
可以看出,碱性的强弱不是影响这个反应产率的主要因素。虽然KOH碱性最强,但获得的产率却相对较低。这与文献曾经报道的过强的碱性会阻碍反应进行相符。以往C—N偶联反应常用的碱K3PO4和CsCO3,也没有获得理想的产率。因此,K2CO3是这个C—N偶联反应的首选。
2.2 抗氧剂的用量对C—N偶联反应的影响
以N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺和4-(4-甲基哌嗪-1-甲基)苯酰胺的C—N偶联反应为模型反应,碳酸钾为碱,甲苯为溶剂。CuI和DMEDA等的用量和2.1节所述相同,给反应体系加入不同数量的抗氧剂D-NaAsc,进行C—N偶联反应,结果见表2。

表2 D-抗坏血酸钠的用量对C—N偶联反应的影响Tab.2 Effect of the amounts of D-sodium ascorbate on the C—N coupling reaction
结果表明:抗氧剂D-抗坏血酸钠的用量,对这个C—N偶联反应具有很明显的影响,当D-NaAsc用量为0.1mmol时,反应产率最高,继续再增加抗氧剂用量,产率不再提升,反而会逐渐下降。因此,抗氧剂D-抗坏血酸钠的最佳用量为0.1mmol。
2.3 溶剂类型对C—N偶联反应的影响
采用4-(4-甲基哌嗪-1-甲基)苯酰胺和N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺为模型反应的底物,碳酸钾为反应用碱,碱用量为2.0mmol,配体为0.1mmol DMEDA,抗氧化剂为0.1mmol D-NaAsc。分别用不同极性的溶剂进行反应,观察溶剂对C—N偶联反应产率的影响情况,结果如表3所示。

表3 溶剂对C—N偶联反应的影响Tab.3 Effect of solvent on the C—N coupling reaction
结果表明:对于极性较大的溶剂,如二氧六环与N-甲基吡咯烷酮(NMP),反应的产率较低。而且,最终产物难以分离出来。用二甲苯和甲苯做溶剂,效果明显好于极性溶剂。甲苯比二甲苯更适合做该反应的溶剂,由于甲苯沸点低,也较容易除去。所以,该反应的理想溶剂为甲苯。
2.4 酰胺的结构类型对C—N偶联反应的影响
按照上述试验筛选的优化反应条件,分别采用不同结构的酰胺和N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺进行C—N偶联反应,合成出了抗白血病药物伊马替尼和一系列具有相似结构的N-嘧啶胺基苯基取代酰胺类衍生物。其中,大部分反应条件是相同的,只是对个别底物的反应条件进行了略微调整。在进行邻甲基苯甲酰胺、邻氯苯甲酰胺与N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺的反应时,由于位阻的影响,反应产率不够理想。所以,将催化剂的用量增加到了0.3mmol,并且,反应时间也延长到28h。结果如表4所示。
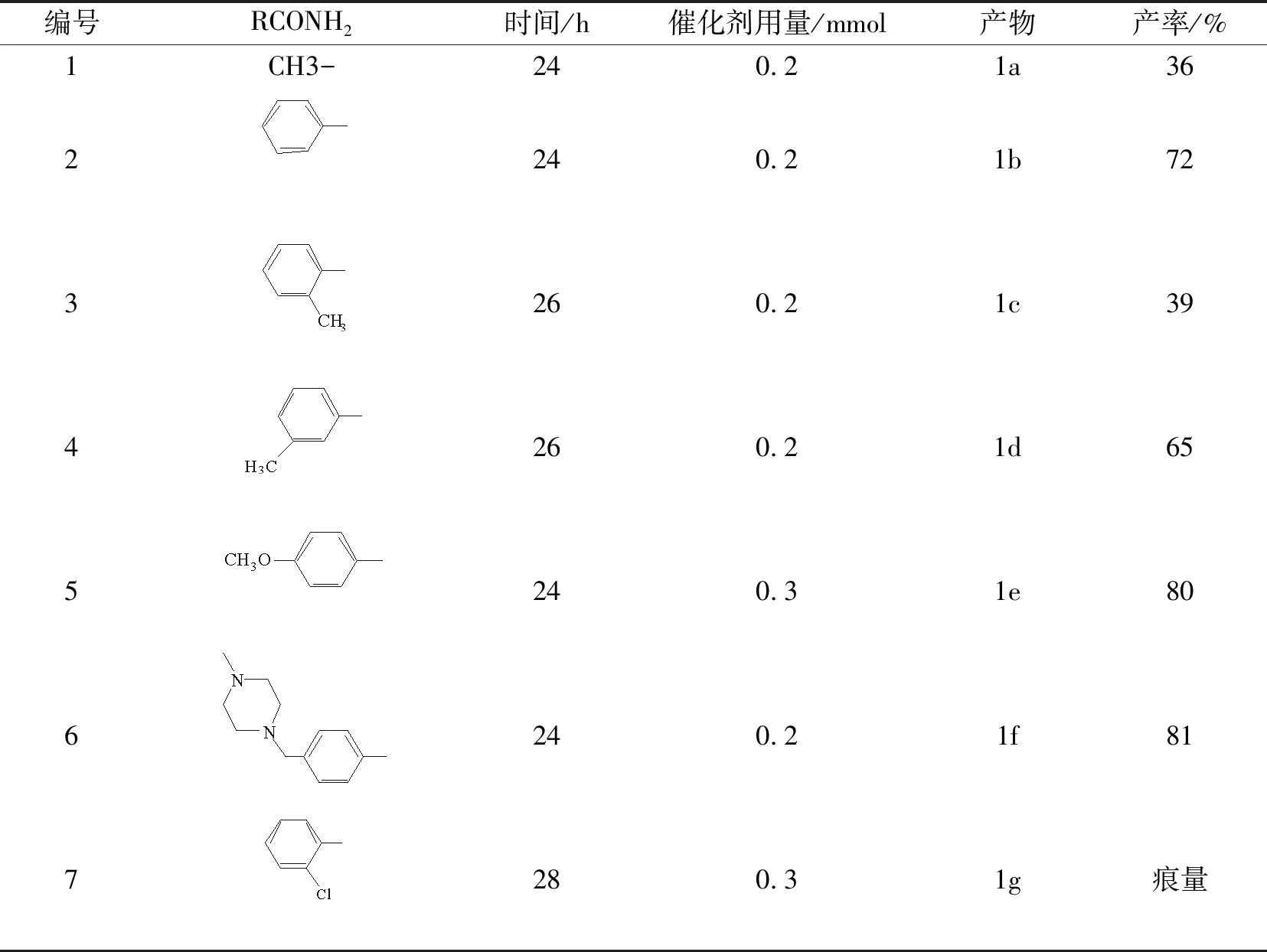
表4 N-嘧啶胺基苯基取代酰胺类物质的合成结果Tab.4 The synthesis of N-pyrimidine aminophenyl substituted benzamides
通过对实验数据的观察,我们看到酰胺芳环取代基的位阻效应,对C—N偶联反应的影响非常大。从苯甲酰胺、邻甲基苯甲酰胺和间甲基苯甲酰胺和N-(5-溴-2-甲苯基)-4-(3-吡啶基)-2-嘧啶胺进行C—N偶联反应可以看出,邻甲基的位阻最大,反应产率也小的很多。苯甲酰胺芳环骨架没有其他取代基,产率也最高。另外,从邻甲基苯甲酰胺和邻氯苯甲酰胺的反应结果看,具有吸电子效应的氯导致几乎得不到目标产物,说明芳环上的吸电子基团对反应的影响很大。但是,对比对甲氧基苯甲酰胺和苯甲酰胺的反应结果,使人感到迷惑,具有弱吸电子效应的甲氧基反而使反应产率提高了,这个现象需要后续实验的进一步考察。在实验中还尝试了以脂肪族的乙酰胺与溴苯基嘧啶胺的反应,产率不是太理想,这个可能与反应机理相关,游离的氢氧根夺去乙酰胺中羰基上的氢更加不易。
2.5 反应机理探讨
如图2所示。该反应的机理可能为:在CuI催化体系中加入二齿配体DMEDA后,配体和CuI首先形成了二配位的铜胺配合物A,也可能一价铜与配体会形成四配位的配合物B,但可能性不是很大。其原因在于一价铜离子形成的配合物属于外轨配合物,价层电子构型为3d10,4s,4p两条空轨道能量较低可以使用,其余两条4p轨道能量较高,孤对电子填充困难。同时,K2CO3水解出OH,受此影响酰胺类物质在碱的作用下失去胺上的氢离子形成C。此后,带有空轨道的A与失去氢离子的C结合生成活性中间体D(外轨型配合物稳定性不高)。溴苯基嘧啶胺与活性中间体D相互作用,溴离子离去,酰胺中的N与苯环上的C连接成键后形成嘧啶胺基苯基酰胺的铜的配合物F,为了趋于稳定,配合物F离解重组,最终形成目标产物G。
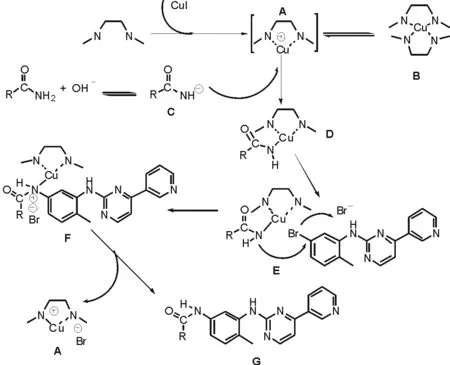
图2 酰胺和卤代芳烃的C—N偶联反应机理Fig.2 The mechanism of C—N coupling reaction of amide and aryl halide
3 结 论
总而言之,对于芳香酰胺和溴苯基嘧啶胺的C—N偶联反应,采用CuI作为催化剂,DMEDA为配体,甲苯为溶剂,在抗氧化剂D-NaAsc的存在下,无需采用惰性气体隔离空气,操作简单,反应产物提纯方便,原料廉价易得,方法绿色环保。而且,目标产物中伊马替尼具有卓越的抗癌作用,是目前治疗白血病的一线药物,其他一些相似结构的N-嘧啶胺基苯基取代苯甲酰胺类化合物也具有潜在的应用价值。因此,本文开发的合成方法为替尼类抗癌药物的合成提供了新的途径。
