氯化两面针碱对小鼠溃疡性结肠炎的干预作用及其机制*
2019-04-15吴亚俐刘凯丽崔香丽王春芳
吴亚俐,刘 鑫,刘凯丽,崔香丽△,王春芳
(1. 山西医科大学生理学系,2.山西医科大学实验动物中心,山西 太原 030001)
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病和溃疡性结肠炎两种疾病类型,在西方国家发病率很高,在我国发病率也呈上升趋势[1]。目前治疗UC的药物主要包括抗炎药和免疫抑制剂[2],但是这些疗法具有严重的副作用,如易复发、长期药物副作用、难治性特点限制了其临床应用。因此,研究者希望能找到既无毒无副作用、又能预防或治疗结肠炎的药物。据估计,40%的IBD患者使用某种形式的中药提取物[3,4]。两面针碱是提取自芸香科花椒属植物两面针根部的一种天然植物活性生物碱。研究表明,氯化两面针碱(nitidine chloride,NC)有多种生物活性,包括抗炎,抗疟,抗菌,止痛及抗癌活性。作为一种传统草药,NC在治疗风湿性关节炎、牙周炎和脓疱病等方面有着广泛的应用[5]。然而,NC对于溃疡性结肠炎的作用机制鲜有报导。MicroRNAs(MiRNAs)是一类小的、内源性的、非编码的RNA分子,是动物和植物中的一种进化保守的分子。它通过靶向mRNA来抑制或降解蛋白质,从而在转录后控制蛋白质的产生[6]。研究表明,miRNAs在IBD的发生发展中起着关键作用[6],且miRNAs在溃疡性结肠炎的结肠组织中有差异性表达。本研究使用DSS诱发小鼠肠炎模型探讨氯化两面针碱治疗肠炎的可能性,并将结肠炎组织中异常表达的miR-31作为研究靶点,观察NC通过miR-31作用的可能机制,为溃疡性结肠炎的治疗提供新的策略。
1 材料与方法
1.1 动物与试剂
SPF级雄性C57BL/6小鼠30只,6~8 周龄,体质量为22~25 g,购自山西医科大学实验动物中心。DSS购自美国 MP公司。氯化两面针碱(nitidine chloride,NC,纯度≥98%) 购自上海同田生物科技有限公司。羧甲基纤维素钠(CMC-Na)购自天津恒兴试剂公司。高铁饲料购自北京华阜康生物公司。RNA提取,反转录及扩增相关的试剂盒购自德国Qiagen公司。NF-κB p65兔单克隆一抗购自于美国Cell Signaling公司,COX-2兔单克隆一抗购自于美国Cell Signaling公司,β-actin鼠单克隆一抗购自武汉Proteintech公司,HRP标记羊抗兔IgG 二抗购自北京全式金公司,兔抗小鼠IgG二抗购自美国Cell Signaling公司。
1.2 小鼠DSS诱导结肠炎模型的建立
30只雄性C57BL/6小鼠随机分为Control组(n=7),DSS组(n=8),DSS+NC组(n=8),NC组(n=7)。6~8周龄的小鼠进行无菌水或1%DSS 3周的喂养,且Control组和NC组小鼠均进食对照饲料,同时DSS组和DSS+NC组进食高铁饲料。膳食补充铁剂可增强DSS诱导的结肠炎和相关的大肠癌的发展,这是因为铁剂是通过增加氧化应激和亚硝化应激来增强UC的发展。造模开始前进行称重并标记所有小鼠。其中Control组和NC组小鼠每天饮用正常无菌水,饮用3周;DSS组和DSS+NC组小鼠第1日饮用DSS水,且每隔2 d换一次新鲜的DSS水,在第8日换为正常无菌水,一周后继续重复上述的DSS水喂养一周。在造模最后一周给予各组小鼠灌胃,其中正常对照组和DSS组给予 0.2 ml的0.5% CMC-Na灌胃,DSS+NC组和NC组给予 0.2 ml的0.8 mg/ml浓度的NC灌胃(图1)。造模完成后,小鼠称重,安乐死。移除脾脏测量重量并计算脾指数,摘取小鼠结肠,用1磷酸盐缓冲液(PBS)冲洗,纵切,测量长度后放入4%多聚甲醛中浸泡24 h,卷成瑞士卷,之后进行石蜡包埋,切片,进行HE染色。其余结肠组织立即置-80℃超低温冰箱中保存待用。脾指数=脾脏质量/小鼠体重。
Fig. 1 Establishment of ulcerative colitis model in DSS mice
1.3 疾病活动度评分
造模期间每天记录每组小鼠的体质量、大便性状及便血情况,计算疾病活动指数 (disease activity index,DAI) 评分,将3项结果的总分除以3即得到DAI值。即DAI =(体质量下降+大便粘稠度+隐血情况)/3(表1)。

Tab. 1 Disease activity index
1.4 结肠组织HE染色
结肠组织石蜡包埋后切 5 μm 片,依次将切片置于苏木素和伊红染液中染色,脱水透明,中性树胶封片。显微镜下观察各组小鼠结肠组织形态学改变。
1.5 结肠组织病理学评分
将结肠组织切片进行HE染色后,在显微镜下观察炎症损伤程度并进行组织损伤程度评级。此评级总共涉及四部分:炎症程度,炎症深度,隐窝损伤程度,还有炎症范围。组织学评分是通过以下3项组织学特征中的每一项的受累百分比乘以炎症范围来确定的。炎症程度(0,无;1,轻度;2,中度;3,重度),炎症深度(0,无;1,黏膜;2,黏膜和黏膜下层;3,浆膜层)以及隐窝损伤程度(0,无;1,基底三分之一的隐窝受损;2,基底三分之二的隐窝受损;3,隐窝消失,仅有完整的表面上皮;4,全部隐窝及上皮破坏)。炎症范围百分比定义为:0,0%;1,1%~25%;2,26%~50%;3,51%~75%;4,76%~100%。因此,最小得分为0,最大得分为40分。
1.6 qPCR检测小鼠结肠组织miR-31的表达
按miRNeasy Mini Kit说明书提取小鼠结肠组织总RNA。用NanoDrop 2000c分光光度计(Thermo,美国)测定RNA浓度和稳定性。应用miScript II RT Kit反转录试剂盒(Qiagen,德国),以200 ng总RNA反转录为cDNA。然后使用miScript SYBR Green PCR Kit扩增以mmu-miRNA-31为引物的miR-31的表达以及内参RNU6B(U6)的表达,反应体系在CFX96(Bio-Rad,美国)上机对miR-31和U6进行实时定量PCR检测。根据miR-31和U6的阈值(CT)测定miR-31表达与U6表达的相对倍数变化。所有样品一式三份。
1.7 Western blot 检测NF-κB p65、COX-2蛋白的表达
取结肠组织约50 mg,用RIPA裂解缓冲液裂解蛋白,BCA法测定蛋白质总浓度。取含总蛋白20 μg的结肠组织匀浆液10 μl,SDS-PAGE电泳后,用半干法将蛋白分子转移至PVDF膜上;5%脱脂奶粉( 0.25 g脱脂奶粉+5 ml TBST)封闭2 h,洗膜后分别注入羊抗兔NF-κB p65一抗(1∶1 000)、羊抗兔 COX-2一抗(1∶1 000)、羊抗小鼠β-actin一抗(1∶1 000),2 h后回收一抗,洗膜后注入HRP标记羊抗兔IgG(1∶2 000)或兔抗小鼠IgG(1∶2 000)二抗,室温孵育1 h;ECL显影,Bio-Rad Image Lab凝胶成像系统显影,并对Western blot条带进行定量分析,确定目的条带的灰度值。
1.8 统计学处理
2 结果
2.1 DAI评分
造模过程中,Control组和NC组小鼠体质量均无降低,无潜血阳性,DSS组小鼠体质量下降明显,在第2日开始出现潜血试验阳性,在第3周出现血便并逐渐加重,与Control组相比,DAI评分显著增加(P<0.01);DSS+NC组体质量、便血情况较DSS组程度显著减轻(P<0.01,表2)。
2.2 小鼠的结肠长度
所有小鼠取结肠后,将结肠纵行剖开,用大头针固定结肠前端和后端使用直尺测量长度。测量结果进行统计学分析,表2结果显示与Control组比较,DSS组小鼠结肠长度明显缩短(P<0.01);与DSS组比较,NC治疗组结肠长度均显著增加(P<0.01);NC组结肠长度与Control组相比没有差异。


GroupnDAI scoreLength (cm)Control70.476±0.1237.357±0.244DSS82.250±0.137∗∗6.213±0.244∗∗DSS+NC81.000±0.154##7.100±0.134##NC70.333±0.1467.443±0.107
**P<0.01vscontrol;##P<0.01vsDSS
2.3 小鼠脾脏质量和脾指数的变化
除切除小鼠结肠外,我们还切除了小鼠的脾脏,初步观察其免疫功能的变化。结果发现DSS组小鼠脾脏质量和脾指数相比于正常对照组都明显增大(P<0.01);给予NC治疗后,脾脏质量和脾指数都有所降低(P<0.05,表3)。
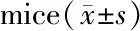
GroupnSpleen(g)Spleen index(g/g)Control70.079±0.0100.0033±0.0004DSS80.238±0.038∗∗0.0111±0.0020∗∗DSS+NC80.131±0.008#0.0063±0.0004#NC70.110±0.0140.0046±0.0010
**P<0.01vscontrol;#P<0.05vsDSS
2.4 小鼠结肠HE染色结果
四组小鼠的结肠HE染色结果显示DSS组小鼠肠炎严重,镜下可见黏膜及黏膜下层明显的炎性细胞的浸润,肠壁增厚,隐窝排列紊乱,上皮及隐窝破坏明显(图2B);NC治疗组小鼠结肠黏膜较DSS组破坏轻,结肠黏膜结构大致完整(图2C)。通过计算各组的结肠组织病理学评分可知:与Control组 (3.571±1.395)比较(图2A),DSS组(23.250± 1.868)评分显著升高(P<0.01);与DSS组比较,NC治疗组(6.375±1.224)评分显著降低(P< 0.01);单独给予NC组(3.714±1.229)和Control组小鼠组织损伤评分总分无显著差异(图2D,图2见彩图页Ⅱ)。
2.5 小鼠结肠组织miR-31的表达
QPCR结果显示,与Control组相比,DSS组结肠组织miR-31的表达明显升高(P<0.01);给予NC治疗后,与DSS组相比,DSS+NC组小鼠结肠组织miR-31的表达降低(P<0.05);与Control组相比,NC组小鼠结肠组织miR-31表达减少(P<0.01)。说明溃疡性结肠炎小鼠结肠miR-31表达上调,而氯化两面针碱可以下调小鼠结肠组织中miR-31的表达(表4)。
2.6 Western blot检测小鼠结肠组织内炎症相关蛋白的表达
与Control组比较,DSS组的小鼠结肠组织NF-κB p65 (P<0.01,图3A,表4)以及COX-2(P< 0.01,图3B,表4)蛋白的表达水平升高;给予NC治疗后,DSS+NC组的NF-κB p65(P<0.05,图3A,表4),COX-2(P<0.05,图3B,表4)蛋白表达水平有所降低。NC组NF-B p65(图3A,表4)蛋白表达与Control组相比无显著差异;NC组COX-2蛋白表达与Control组相比显著降低(P<0.01,图3B,表4)。
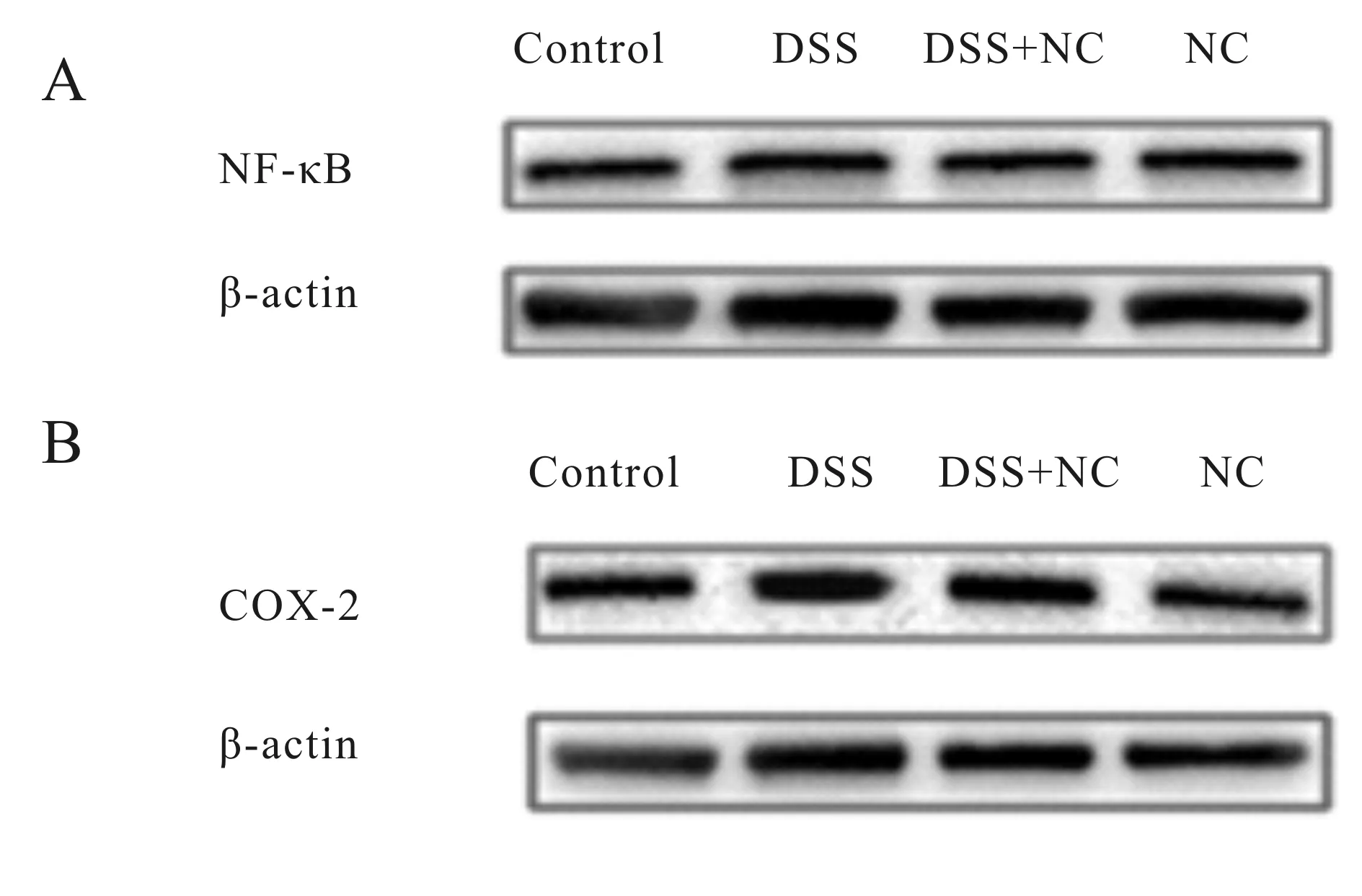
Fig. 3 Expressions of NF-κB and COX-2 protein in colonic tissue of mice
A: Detection of NF-κB protein expression by Western blot; B: Detection of COX-2 protein expression by Western blot

**P<0.01vscontrol;#P<0.05vsDSS
3 讨论
氯化两面针碱(NC)是一种生物碱,具有抗炎,抗菌,止痛及抗癌等活性。 Wang等人证明NC通过NF-κB和MAPK信号通路调节LPS刺激的RAW 264.7细胞中炎症因子TNF-α、IL-1b和IL-6的释放[7],发挥抗炎作用。本研究表明NC对C57BL/6小鼠DSS诱导的UC具有抗炎作用,改善了小鼠的炎症症状及组织损伤,为NC治疗溃疡性结肠炎的新药研发提供基础。
口服DSS溶液在小鼠体内建立UC模型,其病理变化与人UC相似[8]。因此本文在此方面建立小鼠溃疡性结肠炎模型,评估了DSS诱导的C57BL/6小鼠的DAI评分、结肠长度、脾脏质量和脾指数的改变以及组织学变化。DAI评分反映了DSS所致结肠炎的严重程度。包括体重减轻、大便出血和腹泻[9]等小鼠的不适状况。结果发现,与对照组相比,DSS处理的结肠炎小鼠DAI明显增加,结肠长度缩短。与DSS组相比,经NC处理的小鼠在诱导结肠炎后,DAI明显减少。结肠长度是反映炎症严重程度一个间接指标,与DSS引起的UC的严重程度成反比。本实验观察到与DSS组相比,NC治疗组小鼠结肠长度明显恢复。DSS诱导结肠炎发生后,引起了小鼠脾脏质量和脾指数的增加。组织学观察进一步证实NC的保护作用。DSS诱导引起小鼠结肠组织病理学改变,表现为大量炎细胞浸润和隐窝结构紊乱,肠壁增厚。但NC治疗后可明显减轻DSS引起的肠道组织破坏及其相关炎症变化,从而改善炎症状态。以上结果提示,NC可阻断小鼠结肠炎症反应,对DSS诱导的小鼠结肠炎有明显的治疗作用。
尽管近年来对IBD进行了大量的研究,但缺乏发现IBD的生物标记物。MicroRNAs(MiRNAs)被认为是多种疾病的预测因子,包括癌症、心血管病以及炎症性疾病[10-13]。近来研究表明miR-31的调控异常参与多种疾病的发病机制。例如类风湿关节炎的慢性滑膜炎症依赖于T细胞的迁移和保留,miR-31在风湿性关节炎患者滑膜液中的T细胞中表达是上调的,miR-31基因敲除可导致细胞骨架重排和运动相关基因的上调[14]。据报道,在一组伴有微血管并发症的2型糖尿病患者中,血清中miR-31的表达是上调的[15]。Wang等人发现在冠心病(CAD)患者中,血清miR-31水平降低,这种下调可导致冠心病的发病[16]。对IBD病人进行结肠黏膜活检发现炎症组织与正常组织有差异表达的miRNAs谱[17-21]。并且我们实验室前期对于溃疡性结肠炎病人的溃疡组织与临近正常组织测序发现,miR-31-5p是上调最明显的miRNAs之一。因此,本实验将miR-31作为深入了解结肠上皮炎症病理生理机制的分子靶标。在本研究中,通过对结肠组织miR-31 qPCR检测发现,DSS组的miR-31的表达量比正常对照组增高1.13倍,这与本实验室之前的测序结果一致。给予NC治疗后,miR-31的表达水平降低了0.4倍,提示NC可能是通过下调miR-31的表达发挥抗炎作用。
研究表明在结肠炎组织中NF-κB是组成性激活的[22],而目前对于与IBD相关的miR-31与转录因子NF-κB之间关系的研究较少。本研究表明,与正常对照组相比,DSS组的NF-κB的蛋白表达是升高的;这与DSS组中miR-31的高表达趋势一致。而给予NC治疗之后,NF-κB蛋白的表达下调,改善小鼠的肠道炎症;同样地,该组的miR-31的表达水平也降低。有研究发现,在银屑病中,miR-31可以通过靶向抑制其靶蛋白丝氨酸/苏氨酸蛋白激酶40(STK40)提高NF-κB蛋白的表达[23]。结合我们的结果,NC发挥抗结肠炎的作用可能是通过靶向调节miR-31从而调节NF-κB信号通路实现的。NF-B 是一种转录调节因子,能与许多基因的启动子和增强子中B转录序列发生特异性结合,启动转录[24]。活化的NF-κB通过转录调控炎症相关基因,如COX-2[25],从而影响炎症性疾病的特征。本研究证实给予NC治疗之后,COX-2蛋白的表达水平降低。据报道COX-2是结肠炎的关键介导因子[26]。因此NC治疗DSS诱发结肠炎的作用与抑制COX-2有关,其详细的作用机制有待进一步深入研究。
氯化两面针碱对DSS诱导的小鼠溃疡性结肠炎有明显的治疗作用,其抗炎机制与下调miR-31的表达有关。这为溃疡性结肠炎的治疗提供新的研究方向,但是其临床应用问题尚待进一步研究。目前治疗结肠炎的药物多种多样,但其各自发挥抗炎作用的机制不同,作用效果也各不相同。本研究着眼于分子靶点的探究,将miR-31作为氯化两面针碱发挥抗炎作用的分子靶点,从而下调炎症信号通路,从基因水平为结肠炎的治疗提供精准用药,降低药物的副作用,更大程度地发挥抗炎作用。
