烟草纤维素合成酶1(CESA1)蛋白结构比较
2019-04-15刘晓柱李银凤张学文
刘晓柱,李银凤,赵 燕,张学文*
(1 贵州理工学院,贵阳 550000; 2 湖南农业大学,长沙 410128)
纤维素是一种重要的、与人类生活密切相关的生物大分子,由葡萄糖以β-1,4-糖苷键的形式连接而成[1]。自然界中细菌、真菌、植物以及一些低等动物均可合成纤维素[2]。在植物细胞中,纤维素构成了植物初生壁和次生壁[3,4]。通过探讨植物纤维素的合成机制,可利用分子生物学技术方式改良植物,提高纤维素的产量[5]。
目前水稻[6]、拟南芥[7]、马尾松[8]、苎麻[9]、棉花[10]、杨树[11]等多种植物的纤维素合成酶基因已被克隆。烟草纤维素是烟草灰分的主要组分,分析烟草纤维素合成酶并与烟草的灰分特性相结合,有利于了解其品质形成的机制。烟草SR1 (NicotianatabacumSR1)以及花烟草(Nicotianaalata)的烟草纤维素合成酶1(Cellulose synthase 1,CESA1)基因已被克隆,而烟草WS38 (NicotianatabacumWS38)品种的CESA1基因的克隆尚未见报道。此外,不同的烟草品种间CESA1蛋白结构差异性的报道少见。因此,本研究通过RT-PCR方法克隆了烟草WS38CESA1基因,并利用生物信息学方法比较了3个烟草品种间CESA1蛋白的结构特征,以期为烟草分子遗传育种提供一定的理论参考。
1 材料与方法
1.1 植物材料
烟草品种WS38,由湖南农业大学细胞生物学实验室提供,用恒温植物温室培育而成,培养条件为:22℃、15 h/9 h(光照/黑暗)。
1.2 烟草WS38 CESA1基因的克隆
以培养4周的烟草WS38叶片为材料,使用总RNA试剂盒 (B618583,Sangon Biotech) 提取总RNA,其步骤和方法按照试剂盒说明书进行。提取的烟草总RNA质量和浓度分别利用甲醛变形胶凝胶电泳和核酸蛋白仪进行检测分析。
采用RT-PCR方法克隆了烟草WS38CESA1基因。首先使用M-MuLV第一链cDNA合成试剂盒 (B532435,Sangon Biotech)和烟草WS38总RNA,反转录生成cDNA,其步骤和方法按照试剂盒说明书进行。参考花烟草 (Nicotianaalata)CESA1基因的核苷酸序列(AF304374.1) 设计烟草WS38CESA1基因克隆引物NtCESA1-F和NtCESA1-R (表1),以烟草WS38的cDNA为模板进行PCR扩增;扩增条件为:95℃、4 min,94℃、30 s,55℃、1 min,72℃、4 min(共循环40回)。
使用柱式纯化试剂盒 (B518141,Sangon Biotech) 纯化PCR产物,其步骤和方法按照试剂盒说明书进行。PCR纯化产物16℃过夜连接至pMD18-T载体上,阳性转化子经菌落PCR和双酶切检测后,送上海生工生物科技有限公司进行测序检验。

表1 WS38 CESA1基因克隆引物
1.3 烟草CESA1基因序列分析
利用软件DNAStar进行烟草WS38CESA1基因开放阅读框的查找和翻译。利用在线网站BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 对烟草WS38CESA1基因序列进行比对分析。从NCBI网站上下载烟草SR1CESA1基因(JQ686940.1)编码区mRNA序列和蛋白质序列(AFY06685.1),花烟草CESA1基因核苷酸序列 (AF304374.1) 和蛋白质序列 (AAK49454.1)。采用DNAMAN对烟草CESA1蛋白序列进行多重线性比对。
1.4 烟草CESA1蛋白结构特征分析
利用在线分析工具SMART和TMHMM预测了烟草CESA1蛋白结构特征。使用MEAG X软件构建植物CESA1蛋白系统进化树。
2 结果与分析
2.1 烟草WS38 CESA1基因的克隆
提取烟草WS38叶片总RNA,检测其浓度为0.74 μg/μL,OD260nm/OD280nm为1.95。凝胶电泳显示,烟草WS38总RNA的28S、18S以及5S条带较为整齐明显(图1)。提取的烟草总RNA质量较好,并经反转录合成cDNA。

图1 烟草WS38总RNA凝胶电泳Fig.1 Gel electrophoresis analysis of total RNA from Nicotiana tabacum WS38
以烟草WS38叶片cDNA为模板,以NtCESA1-F和NtCESA1-R为引物,扩增到1条约3 kb特异性目标条带(图2)。回收PCR产物,连接至pMD18-T载体上,经菌落PCR和双酶切验证后,测序检验。
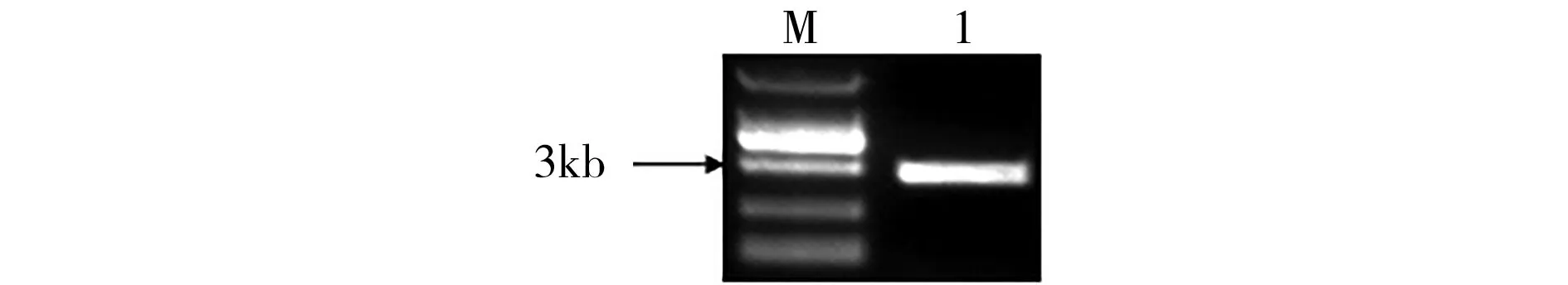
注:M:1kb DNA marker;1:烟草WS38 PCR扩增条带。图2 烟草WS38 CESA1基因的PCR扩增凝胶电泳Fig.2 Gel electrophoresis analysis of CESA1 gene from Nicotiana tabacum WS38
测序分析表明,克隆的PCR产物全长3276 bp,编码1091个氨基酸。BLAST序列比对发现,克隆获得的序列与烟草SR1以及花烟草CESA1序列的同源性超过98%。因此,烟草WS38CESA1基因编码区序列被成功克隆,命名为NtCESA1,并提交至Gen Bank (登录号:JN009108.1)。
2.2 烟草CESA1蛋白序列分析
比较烟草WS38、SR1以及花烟草的CESA1蛋白序列发现,三者CESA1蛋白氨基酸个数均为1090个,三者有差异的氨基酸个数为15 (图3)。其中在WS38和SR1之间有9个氨基酸相同、但与花烟草的不同,其中7个不同的氨基酸分布在CESA1的N端。烟草SR1与花烟草有6个氨基酸相同、但与WS38不同,其中4个不同的氨基酸分布在CESA1的C端。

图3 烟草CESA1蛋白序列比对Fig.3 Protein sequence alignment of Nicotiana CESA1
烟草CESA1氨基酸组成分析显示,烟草SR1和花烟草碱性氨基酸个数相同,为129个,比烟草WS38多1个;烟草WS38和烟草SR1酸性氨基酸(D,E)个数相同,为127个,比花烟草少1个。
蛋白分子量与等电点分析显示,烟草WS38 CESA1蛋白理论分子量大小为122.54 kDa,理论等电点为7.46;烟草SR1 CESA1蛋白理论分子量大小为122.76 kDa,理论等电点为7.65;花烟草CESA理论分子量大小为122.68 kDa,理论等电点为7.45。分析结果表明,3个烟草品种CESA1蛋白的分子量与等电点均比较接近,烟草SR1 CESA1的分子量与等电点最大。
蛋白亲疏水特性分析结果表明(图4),烟草WS38、SR1以及花烟草的CESA1蛋白最大亲水位点均为第1057位,氨基酸为色氨酸(W),分值为3.089;最小疏水位点均为第230位,氨基酸为赖氨酸(K),分值为-3.389。三者CESA1蛋白的亲疏水特性相同。
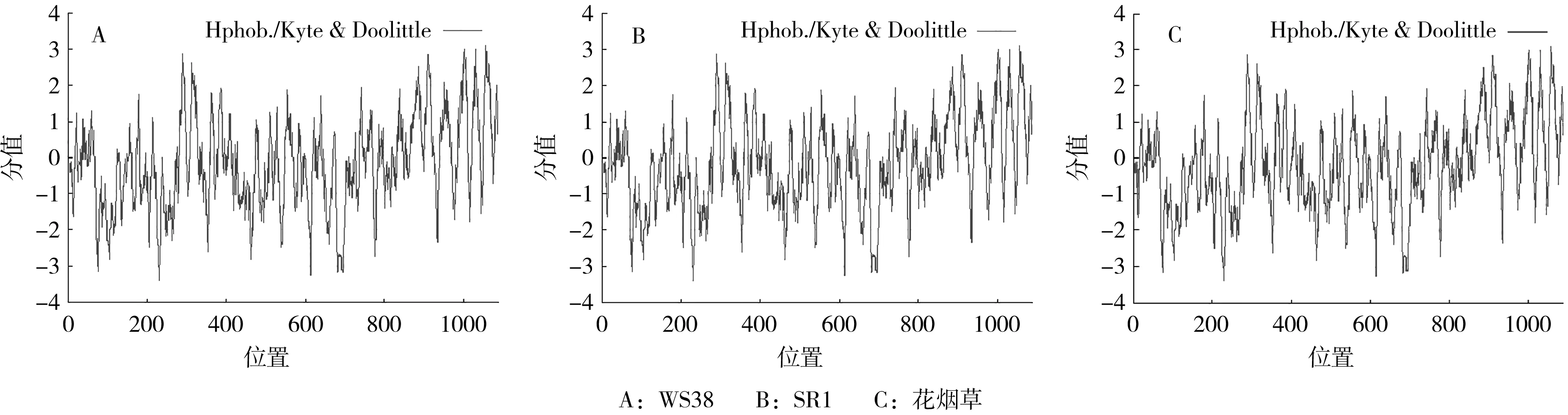
图4 烟草CESA1蛋白亲水性预测结果Fig.4 Prediction of Nicotiana CESA1 hydrophilcity
2.3 烟草CESA1蛋白结构分析
CESA1蛋白结构特征在线分析结果显示,烟草WS38、SR1以及花烟草CESA1的39至84位点预测到1个锌指结构 (ZF Ring),同时CESA1中还包含了8个跨膜结构域 (transmembrane region) 以及多个低灵活性位点 (low complexity) (图5)。但某些结构的起始位点在不同的烟草品种中具有差异 (表2)。如烟草WS38和SR1的241至250位点为低复杂度,而花烟草位点为241至257;在花烟草的665至675位点存在1个低复杂度,但烟草WS38和SR1中没有。烟草WS38和花烟草的680至697位点存在着1个低复杂度,在烟草SR1中位点则为680至698。此外,烟草SR1和花烟草的939至961位点存在一个跨膜结构域,该结构域在烟草WS38中的位点为939至968。

图5 烟草CESA1蛋白结构特征预测结果Fig.5 Prediction of Nicotiana CESA1 structure characteristics
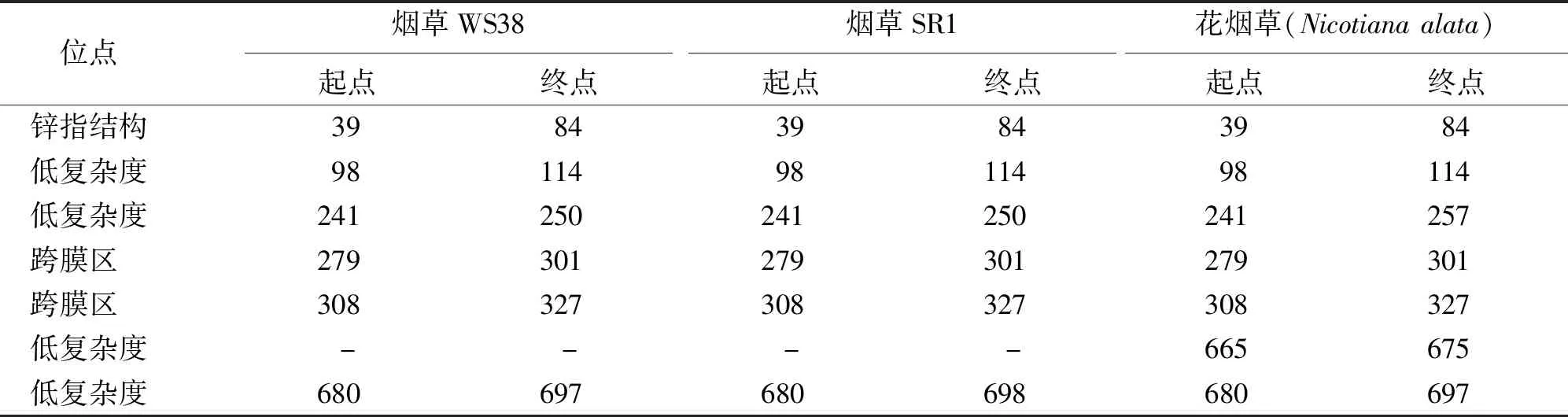
表2 烟草CESA1蛋白特征位点分析结果
续表2
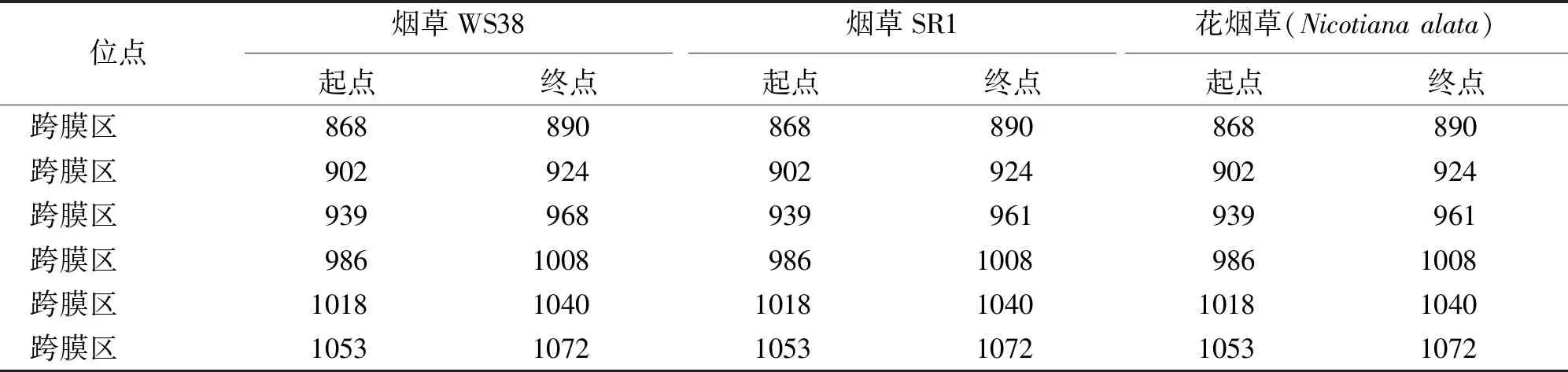
位点烟草WS38烟草SR1花烟草(Nicotianaalata)起点终点起点终点起点终点跨膜区868890868890868890跨膜区902924902924902924跨膜区939968939961939961跨膜区986100898610089861008跨膜区101810401018104010181040跨膜区105310721053107210531072
利用TMHMM在线工具进一步分析烟草CESA1跨膜结构特性,TMHMM预测结果与SMART分析结果一致,3个品种烟草CESA1中均包含8个跨膜结构域 (图6)。
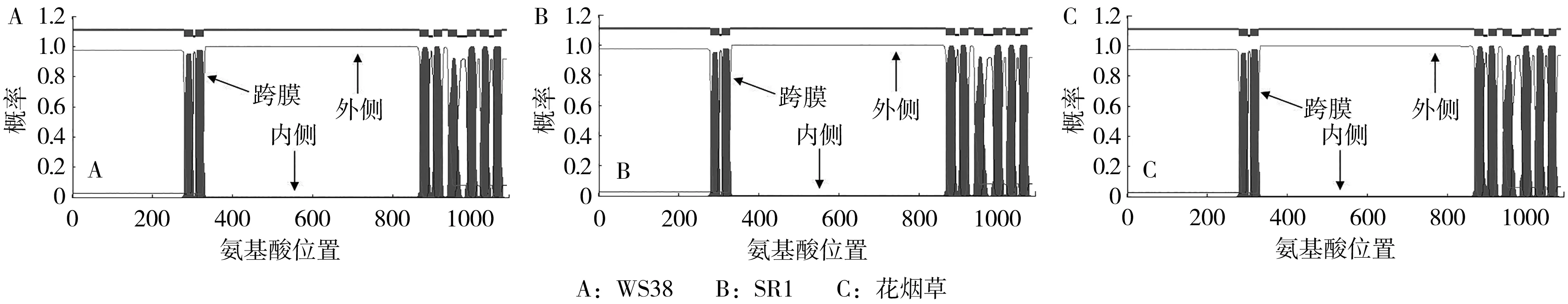
图6 烟草CESA1蛋白跨膜结构域预测Fig.6 Prediction of Nicotiana CESA1 transmembrane domains
蛋白功能的发挥与其结构紧密相关,利用在线工具对3个烟草品种CESA1蛋白的高级结构进行了预测分析。结果表明,3个烟草品种CESA1蛋白二级结构中均包含了无规则卷曲(Random coil)、α-螺旋(Alpha helix)和链延伸(Extended strand) (图7)。在烟草WS38 CESA1蛋白二级结构中,超过一半的二级结构是无规则卷曲(681个),比例和个数是3个品种中最多的。烟草SR1的CESA1蛋白二级结构中无规则卷曲个数和比例最少(668个,61.23%),而其α-螺旋和链延伸个数最多,分别为304个和为119个(表3)。

图7 烟草CESA1蛋白二级结构Fig.7 Prediction of Nicotiana CESA1 secondary structures

表3 烟草CESA1蛋白二级结构分析
烟草CEAS1蛋白三级结构的预测结果发现(图8),3个烟草品种的CEAS1蛋白均包含无规则卷曲、α-螺旋和链延伸,与其二级结构较为吻合。此外,烟草WS38 和SR1的三级结构比较接近,与花烟草的差别较大。
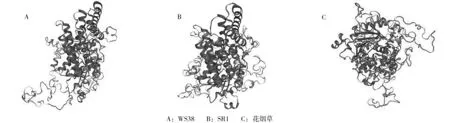
图8 烟草CESA1蛋白三级结构Fig.8 Prediction of Nicotiana CESA1 tertiary structures
此外,蛋白质功能的发挥还依赖于特定位点的磷酸化修饰。因此,对3个烟草品种CESA1蛋白的磷酸化修饰进行了预测。结果表明,3个烟草品种的CESA1蛋白中都包括有丝氨酸(Serine)位点、苏氨酸(Threonine)位点以及酪氨酸(Tyrosine)位点的磷酸化修饰,具有磷酸激酶的活性 (图9)。另外,3个烟草品种CESA1磷酸化修饰位点个数和位置均相同,没有差异。

图9 烟草CESA1蛋白磷酸化位点预测Fig.9 Prediction of Nicotiana CESA1 phosphorylation sites
蛋白质功能的发挥,还与其在细胞中的定位有关,因此预测了烟草CEAS1在细胞中的定位。亚细胞定位预测结果显示,3个烟草CESA1均定位在细胞质膜上(图10)。
2.4 烟草CESA1蛋白进化关系分析
使用MEAG X软件构建了部分植物CESA1蛋白的系统进化树(图11)。结果发现,3个烟草CESA1亲缘关系最近,构建到进化树的1枝上,这一结果与CESA1蛋白结构分析预测结果比较一致。此外,烟草CESA1与团花树(Neolamarckiacadamba)CESA1(AFP93559.1) 亲缘关系最近,而与马占相思(Acaciamangium)CESA1 (AAT66940.1) 亲缘关系最远。
图10 烟草CESA1蛋白亚细胞定位预测Fig.10 Prediction of Nicotiana CESA1 subcellular location
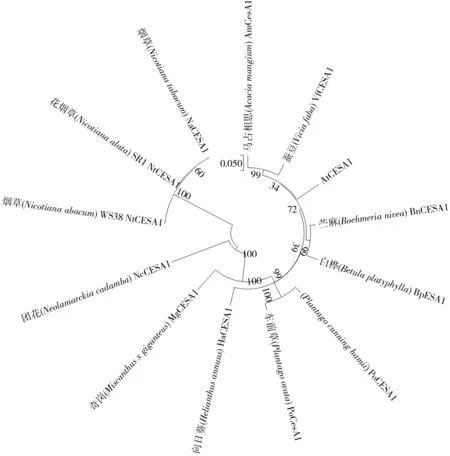
图11 烟草CESA1蛋白系统进化分析Fig.11 Evolution analysis of Nicotiana CESA1
3 讨论
植物细胞壁主要由纤维素、半纤维素、果胶等成分组成,植物纤维素的合成是一个复杂的生理过程,由纤维素合成酶家族参与合成[12,13]。植物纤维素合成酶家族由多个成员构成,如双子叶植物拟南芥中有12个,单子叶植物水稻和玉米中也超过10个[14]。烟草CESA1参与调控烟草纤维的发育、细胞的伸长等多种生长发育过程。鉴于此,本研究克隆了烟草品种WS38CESA1基因,进而通过生物信息学方法比较了烟草品种间CESA1的结构差异。结果发现,3个烟草品种间,CESA1在一级结构、二级结构以及三级结构比较相似,但也具有一定的差异,烟草WS38和SR1之间的差异性较小,与花烟草(Nicotianaalata)之间的差异较大,蛋白系统进化分析显示烟草WS38与SR1亲缘关系较近;3个烟草品种CESA1典型的结构特征均相同,如N端都具有1个锌指结构,均具有8个跨膜结构域,磷酸化位点修饰均相同,具有蛋白激酶活性。此外,3个烟草品种CESA1均定位在细胞膜上,因此3个CESA1功能应较为一致,均可发挥纤维素催化合成的功能。
相比较于传统植物育种手段而言,分子生物学技术以及植物基因工程的发展,为植物的遗传改良提供了新的、快速的方法。对于一些纤维经济植物,如棉花、苎麻、亚麻等,通过明确其纤维素合成酶1的功能以及纤维素合成机理,借助基因工程手段进行育种,提高纤维素的产量和含量。烟草是植物研究中的一种模式物种,本研究通过对3个烟草品种CESA1蛋白结构的分析,进一步明确了品种间CESA1蛋白结构特征,为其它物种的研究提供一定的参考。同时,烟草纤维素是烟草灰分的主要组分,分析烟草纤维素合成酶并与烟草的灰分特性相结合,有利于了解其品质形成的机制。
