异位胰腺38例诊治分析
2019-04-13黄湘辉武鸿彪丁小云严志龙袁旦平
黄湘辉 武鸿彪 丁小云 严志龙 袁旦平
异位胰腺又称迷走胰腺或副胰,是一种在解剖上与正常胰腺无关联的孤立胰腺组织。异位胰腺的发病机制仍不清楚,目前得到认可的有错位理论和化生理论。错位理论认为异位胰腺的形成是胚胎时期内胚层肠管在旋转过程中发生的变异,化生理论认为异位胰腺是在胚胎发育过程中迁移到黏膜下层的内胚层所化生的胰腺组织[1]。异位胰腺是一种少见的先天畸形,其临床表现不典型或缺乏特异性,故术前诊断困难,易被漏诊、误诊。在尸体检查中异位胰腺的检出率为0.5%~13%,多见于30~50岁人群,男性发病率高于女性[2]。随着内镜检查的普及,异位胰腺的检出率有所升高。本研究回顾性分析宁波市第一医院2011—2016年经病理检查证实的38例异位胰腺患者的临床资料,结合近年相关进展探讨其诊断和治疗方法,旨在进一步提高对异位胰腺的认识。
1 对象与方法
1.1 研究对象 回顾性分析2011-2016年在宁波市第一医院诊断并接受治疗的异位胰腺患者38例,男、女各19例,年龄20~64岁,平均年龄为(42.0±3.6)岁。所有患者均经病理检查确诊,即具备正常胰腺组织学上的胰腺泡、胰管、胰岛结构,但缺乏主胰腺的解剖、血管结构。
1.2 研究方法 统计38例患者的临床表现、诊断过程、病灶特征、治疗方法和预后情况,分析异位胰腺的临床病理特征。
2 结 果
2.1 临床表现 38例患者中,34例患者有消化系统症状,其中腹痛12例,腹胀4例,腹痛、腹胀4例,腹胀、嗳气伴反酸5例,腹胀、嗳气伴饥饿痛3例,腹痛伴黑便3例,腹胀、腹痛伴恶心呕吐1例,腹胀伴腹泻1例,腹胀、纳差1例(出现症状后8个月体重减轻5 kg);3例患者表现为消化道出血,粪便潜血阳性,血红蛋白水平轻度降低,呈慢性贫血表现。余4例患者无特殊不适,因其他疾病在术中或术后经病理检查发现。
2.2 病灶位置和大小 36例异位胰腺位于胃,其中胃窦24例(63.2%)、胃体11例(28.9%)、胃底1例(2.6%);有2例(5.3%)位于十二指肠球部。37例病灶为单发,直径为0.4~4.0 cm,平均直径为(1.49±0.16)cm;1例有2处病灶,直径分别为1.2和0.8 cm,均位于胃体大弯下段前壁。
2.3 辅助检查 38例患者行常规腹部多普勒超声检查,肝、胆、胰、脾均未见异常。12例患者行消化道钡剂造影检查,其中3例发现胃占位。10例患者行腹部增强CT检查,其中6例提示胃壁局部隆起或增厚,增强后强化;4例未发现异常。34例患者行普通胃镜检查,均未提示异位胰腺,其中6例胃镜诊断为胃间质瘤;28例诊断为黏膜下隆起性病变,无法定性。34例患者行超声内镜(EUS)检查,表现为均匀或不均匀低回声27例(79.4%)、高回声5例(14.7%)、不均质回声2例(5.9%),中位直径为1.5 cm(0.7~4.0 cm);其中10例EUS检查诊断为异位胰腺(诊断准确率29.4%),11例误诊为间质瘤,2例误诊为脂肪瘤,2例误诊为胃息肉,1例误诊为神经内分泌瘤,1例误诊为胃囊肿,1例误诊为胃囊肿伴溃疡(黏膜下均匀低回声,黏膜表面表现为炎性反应、溃烂),其余6例无法定性(均为黏膜下层低回声病变)。
2.4 治疗方法 34例患者接受内镜黏膜下剥离术(ESD)治疗,应用奥林巴斯GIF-XQ240电子胃镜、Olympus GIF UM-2000内镜超声系统、UM-25R超声探头、高频电凝装置、氩气刀等,手术过程见图1~6。全部获得完全切除,无患者术中出现活动性出血,5例患者术后出现明显腹痛,4例粪便隐血阳性,经对症处理后均好转,无其他ESD相关并发症。
4例患者接受外科手术治疗。1例患者病灶位于胃窦后壁,大小为4.0 cm×1.5 cm,术前诊断为胃囊肿伴溃疡(图7A、7B),行远端胃切除术+毕Ⅰ式吻合,病理检查确诊为异位胰腺,周围伴胃黏膜慢性炎性反应,区域急性活动、肠化生(图7C),同时胃大弯侧淋巴结反应性增生。1例病灶位于十二指肠球部后壁(图8A、8B),行腹腔镜胃部分切除术+毕Ⅰ式吻合术,病理检查证实异位胰腺组织位于肌层(图8C)。1例因术前增强CT检查发现胃大弯处增厚,范围约3 cm,行胃镜腹腔镜联合胃部分切除术。1例肿物位于胃底,行胃楔形切除术。4例经外科手术治疗的患者术中出血量为50~400 m L,术后并发症主要是腹腔感染、上呼吸道感染和肺部感染,经抗感染治疗后均好转。
2.5 病理检查结果 38例标本经组织病理学检查发现,异位胰腺组织2例位于黏膜层,30例发生于黏膜下层,1例发生于黏膜和黏膜下层,3例位于肌层,1例位于浆膜层,1例贯穿胃壁全层。
2.6 预后 38例患者术后经胃肠减压、抑酸、抗感染和对症支持治疗后,均恢复顺利,随访至2018年1月,无1例死亡,患者均无明显消化道症状,复查胃镜均未见明显异常,无1例复发。
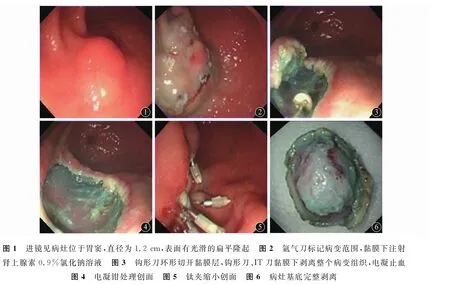
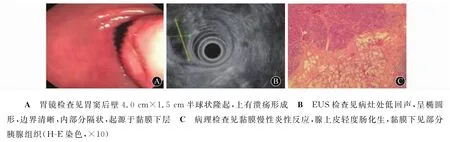
图7 男性,48岁,以腹痛、黑便为首发症状
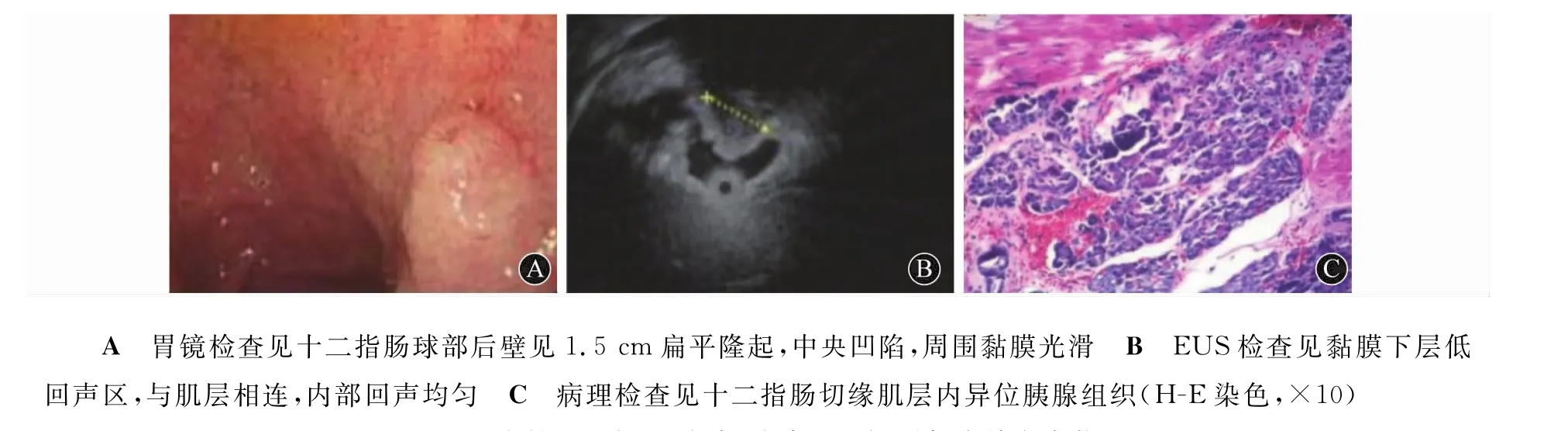
图8 女性,36岁,以腹胀、腹痛、反酸、嗳气为首发症状
3 讨 论
异位胰腺可发生于消化道的任何部位,最常见于胃(25%~38%),其次是十二指肠(17%~36%)和空肠(15%~21.7%),食管、胆总管、脾、肠系膜、纵隔和输卵管等部位少见[3],不发生于结肠[4]。本研究中38例中仅2例发生于十二指肠,其余均发生于胃。异位胰腺大多为直径<30 mm的圆形或椭圆形隆起灶[5],一般位于黏膜下层、肌层或浆膜层,临床表现与异位胰腺的发生部位、大小等因素有关,也可无临床表现,出现并发症可引起相应症状[6],最常见症状是腹痛,其次为腹胀、恶心呕吐、反酸嗳气、消化道出血等。Pessaux等[7]认为具有分泌功能的异位胰腺可形成囊性病变,本组有1例异位胰腺主要表现为腹胀、腹痛伴恶心呕吐,胃镜检查见胃窦后壁4.0 cm×1.5 cm半球状隆起,EUS检查表现为黏膜下层低回声区,提示伴囊性变,由于异位胰腺的导管与胃腔连接不通畅,胰腺外分泌液滞留导致急性梗阻性胰腺炎反复发作,从而引起腹痛,形成的假性囊肿引起胃排空障碍,出现腹胀、恶心呕吐症状。
异位胰腺的术前定性诊断较为困难,需与胃肠间质瘤、平滑肌瘤、脂肪瘤、血管瘤等相鉴别。气钡双重对比造影检查可见局灶黏膜充盈缺损,消化道造影检查对诊断此病的意义不大。异位胰腺在CT检查中表现为圆形或类圆形肿块,平扫密度均匀,与正常胰腺密度相等或稍低,增强扫描多数强化,同时可提示异位胰腺有无胰腺炎、囊性变、癌变等[8-9]。有研究[10]发现,CT检查病变位于胃窦前区或十二指肠,突向腔内,边界模糊,黏膜增强扫描后强化,病变长径与短径比值>1.4,这5项CT表现同时存在2项以上时诊断特异度为82.5%,存在4项以上时诊断特异度为100%。本组中6例异位胰腺在CT检查表现为病变位于黏膜下,局部隆起增厚,增强后强化。
诊断异位胰腺的首选方式是EUS检查,可观察到异位胰腺的典型表现,即黏膜隆起性病变上见开口和脐样凹陷,这是与其他类型病变的重要区别,有助于鉴别诊断。脐样凹陷系异位胰腺导管引流外分泌液到黏膜表面的开口,但仅<50%的病灶有此开口[11-13]。EUS检查可观察到异位胰腺位于消化道的黏膜下层、肌层和(或)浆膜层中,特征为回声不均或无回声区,边界不清[14],异位胰腺的组织成分有胰腺腺泡、导管和胰岛,构成比例不全相同,因此在EUS检查中的物理学特征也可存在差异,可有不典型表现[5]。EUS检查与术后病理检查诊断的符合率可达73.0%~83.0%[15-16],因此术前完善EUS检查具有重要意义。本组中EUS检查的诊断准确率仅为29.4%,远低于文献报道,可能与内镜医师对异位胰腺认识不足有关,也可能与样本量较小有关。EUS引导细针穿刺术(EUS-FNA)能够将诊断准确率提高至80%以上[17-19]。
本病发病率较低,临床症状差异较大,部分患者长期无明显不适,故是否所有异位胰腺均需要治疗,目前存在争议,但部分异位胰腺可发生急、慢性胰腺炎,以及假性囊肿、坏死、出血,甚至恶变(恶变率为0.7%~1.8%)[20-21]。目前,积极的观点认为无论有无症状或病理改变均应手术切除[8];保守的观点认为有临床症状的异位胰腺予以手术切除,没有症状的可定期随访[22]。本组4例异位胰腺患者无临床症状且病灶较小(直径<1.5 cm),考虑到本病行ESD治疗的风险较小,而且患者大多不能坚持长期定期复查,故同样予以手术切除。治疗首选微创手术[23],如ESD治疗。对于病灶较小、临床症状轻微或无明显临床症状且耐受性差的患者,可暂予随访观察;对于病灶直径>10 cm或累及肌层、浆膜层者,不适合行ESD治疗[24];对于病灶位于十二指肠、空肠的患者行ESD切除的风险较高,且不易完整切除,若切除过深可能导致出血、穿孔等并发症发生,穿孔率可达20.0%,总体并发症发生率达40%[25],此时应行腹腔镜或开腹手术;对于病灶位于浆膜层或体积较大且贯穿胃壁全层者,可行胃镜腹腔镜联合下胃部分切除术。本组有1例患者行胃镜腹腔镜联合下胃部分切除术,术后病理检查证实黏膜、黏膜下、肌层和浆膜层广泛发现异位胰腺组织。
综上所述,异位胰腺的临床表现缺乏特异性,且常规检验、检查手段均不易鉴别,术后病理检查仍是唯一的确诊方法。进一步提高对异位胰腺的认识,遇到黏膜下隆起型病变时,应结合EUS和CT检查,考虑是否存在异位胰腺的可能性[8],一经发现,无论有无症状或病理损害,均应根据病变部位、大小、深度、生物学特性,以及手术难度和患者耐受性等综合选择治疗方式。对于有内镜下治疗条件者,首选内镜下微创手术。
