黄瓜与西芹间作对黄瓜土壤真菌ITS多样性分析*
2019-04-13秦立金于田田王佳明高寅彪王守政云兴福
秦立金, 于田田, 王佳明,高寅彪, 王守政, 李 铮,云兴福
黄瓜与西芹间作对黄瓜土壤真菌ITS多样性分析*
秦立金1,2, 于田田1, 王佳明1,高寅彪1, 王守政1, 李 铮1,云兴福2**
(1. 赤峰学院生命科学学院 赤峰 024000; 2. 内蒙古农业大学农学院 呼和浩特 010018)
为探索黄瓜与西芹间作后对黄瓜土壤真菌多样性变化规律的影响, 本试验以黄瓜与西芹间作种植模式为处理, 黄瓜单作和西芹单作种植模式为对照, 进行不同处理土壤ITS真菌群落多样性高通量测序分析。结果表明: 黄瓜与西芹间作土壤真菌Alpha多样性指数降低, Observed species指数、Shannon指数、Chao1指数和Simpson指数与对照相比均达到最低值, 但差异均不显著(>0.05)。在门分类水平上, 共检测到5个菌门, 其中, 子囊菌门(Ascomycota)、接合菌门(Zygomycota)和担子菌门(Basidiomycota)为3个主要菌门; 黄瓜与西芹间作处理前3个菌门所占比例最高, 达95.50%。在属分类水上, 共检测到329属, 相对丰度比例为前12的菌属占所有检测出菌属的49.4%; 黄瓜与西芹间作处理检测的菌属所占比例最高, 达50.72%, 其次为黄瓜单作和西芹单作, 分别为50.47%和47.17%。因此, 黄瓜与西芹间作处理改变了黄瓜土壤真菌群落的结构和组成, 丰富了黄瓜土壤真菌的群落多样性, 为以后设施黄瓜连作土壤微生态环境改善和修复提供科学依据。
黄瓜与西芹间作; ITS测序; 土壤真菌; 真菌群落; 多样性指数
近几年, 随着设施农业规模化、产业化发展, 全国大部分设施棚区土壤连作障碍问题严重频发, 导致土壤微生物结构及多样性发生了变化, 作物根际土壤微生物平衡遭到了严重破坏, 土传病害发生日益严重。有研究证实, 土传病害是由于土壤微生物区系多样性失调导致土壤病原菌激增引发的[1]。间套作是我国传统农业精髓, 目前已成为缓解作物土壤连作障碍安全有效的措施之一[2]。吴凤芝等[3]研究表明, 黄瓜(L.)与小麦(L.)、毛苕子(Roth.)间作提高了黄瓜根际土壤微生物群落多样性; 番茄(L)与生菜(var.Gars.)和芹菜(L.)间作, 能够显著增加间作土壤中微生物总量、细菌数量和细菌/真菌的比例, 显著降低真菌数量[4]。目前, 对设施黄瓜土壤土传病害防控的研究大多集中在使用有机肥和化肥配施[5]、轮作[6-7]、伴生[8]、填闲[9]等方式, 利用间套混作等种植模式改善和修复土壤微生态环境等问题, 已成为目前防控黄瓜土传病害发生的有效途径。
植物间通过化感作用向周围环境释放可以影响其他植物、微生物的化学物质, 这些物质也可能直接或间接影响土壤微生物的菌落结构、数量、组成和微生物多样性, 间套混作复合群体内不同作物间通过次生物质产生的化感作用普遍存在[10-11]。但国内外有关间套混作化感作用的研究, 特别是对化感作用下间套混作土壤微生物多样性的研究十分薄弱, 使生产实践中缺乏通过化感作用途径提高间套混作复合群体效益的理论和技术支撑。秦立金等[12-13]已对黄瓜与西芹间作后土壤细菌多样性的变化规律和黄瓜枯萎病田间化感防控效果等进行了研究。本试验是在前人和前期研究工作的基础上, 以黄瓜与西芹间作土壤为研究对象, 采用高通量ITS测序技术从DNA分子水平上揭示二者间作处理后土壤真菌群落结构多样性的变化规律, 为以后通过间套混作等农业措施防控土传病害、改善设施土壤微生态环境提供理论支撑。
1 材料与方法
1.1 试验地概况及材料
试验地位于内蒙古呼和浩特市赛罕区(110°40′~ 112°10′E, 40°36′~40°57′N)的内蒙古农业大学科研教学基地。该区土壤为黏壤土, 年平均气温为13.6 ℃, 年日照时数1 600 h, 无霜期113~134 d,年平均降水量为335.2~534.6 mm, 中温带大陆性季风气候。2017年6月经采样分析测定, 0~20 cm土壤基本化学性质: pH 6.61, 电导率93.65 μS∙cm-1, 有机质43.73 g∙kg-1, 硝态氮7.42 mg∙kg-1, 铵态氮1.77 mg∙kg-1, 速效磷77.63 mg∙kg-1,速效钾259.62 g∙kg-1。因黄瓜连作, 造成土壤连作障碍, 土传病害发生严重, 尤其是枯萎病发生严重, 发病率达30%~40%。供试黄瓜品种为‘津春四号’, 由天津科润黄瓜研究所提供。供试西芹品种为‘美国西芹’, 由寿光惠农种业有限公司提供。供试菌种黄瓜枯萎病菌(f. sp.Owen)由内蒙古农业大学农学院蔬菜栽培实验室提供。
1.2 试验方法
田间种植试验于2017年2—9月在内蒙古农业大学科研教学基地大棚内进行。以黄瓜与西芹间作种植为处理, 西芹单作和黄瓜单作种植为对照。黄瓜单作于3月24日播种育苗, 4月24日定植, 株行距35 cm×55 cm。西芹单作于2月14日播种育苗, 4月24日定植, 株行距30 cm×20 cm。黄瓜与西芹间作采用二者隔行种植, 一行黄瓜, 两行西芹, 4月24日定植, 种植密度同上。每一处理3次重复, 完全随机排列, 小区面积18 m2, 常规管理。7月27日(黄瓜拉秧后), 使用土钻采用“X”型5点取样法, 采集植株根际0~20 cm耕层土壤, 将土样充分混匀后, 一部分土壤装塑封袋,送实验室于室内阴凉处, 摊开晾干, 剔除植物残体、石块和其他杂物。将风干的土样磨碎, 过2 mm筛孔放于-80 ℃冰箱保存, 用于土壤真菌ITS多样性分析。其中, 黄瓜与西芹间作、黄瓜单作和西芹单作土壤分别用JZ、HD和XD表示。
将保存的土壤样品送往上海联川生物工程有限公司, 利用OMEGA的试剂盒提取土壤DNA。对提取到的基因组DNA进行琼脂糖电泳检测, 查看基因组DNA的完整度与浓度。利用Qubit2.0DNA检测试剂盒对基因组DNA精确定量, 以确定PCR反应加入的DNA量。
1.3 ITS测序流程
ITS测序使用的文库构建步骤遵循Illumina测序仪文库构建方法。从基因组DNA样品开始, ITS测序具体步骤如下: 以ITS2为目标区域进行引物设计, 引物序列为fITS7和ITS4, 分别为GTGARTCATCGAATCTTTG和TCCTCCGCTTATTGATATGC。使用DNA模板50 ng, 25mL的PCR体系, 使用Phusion酶扩增25~35个循环。一轮PCR扩增反应之后, 在正反向引物两端分别加上不同的barcodes, 再进行下一轮扩增。扩增完成的PCR产物使用beads纯化之后进行上机测序。PCR产物用AxyPrepTMMag PCR Normalizer做归一化处理。构建好的文库上样到cBot或簇生成系统, 利用Illumina MiSeq测序仪进行2x300 bp paired-end测序。对于MiSeq测序获得的双端数据, 首先根据barcode信息进行样品区分, 然后根据overlap关系进行merge拼接成tag, 接着对拼接完成的数据进行数据过滤, 随后进行20、30(碱基质量值反映数据的质量,20和30分别表示测序结果中由于测序仪器造成的某个位置的碱基错误概率小于1.0%和0.1%)等质控分析。对最终获得clean数据进行OTU聚类分析和物种分类学分析。
1.4 数据处理
Alpha多样性指数及数据分析采用SPSS 17.0方差分析Duncan多重比较和Microsoft Excel软件处理。
2 结果与分析
ITS测序得到的原始图像文件数据为经过base calling以FASTQ格式存储后称之为raw data或raw reads。对原始数据去除reads的barcode和接头序列, 将每一对paired-end reads拼接合并成一条更长的tag, 去除含有无法确定的碱基信息比例大于5%的tags和低质量的tags(碱基质量值<10的碱基数占整个tag的20%以上)得到Clean数据。对Clean数据进行长度分布统计和质量评估。本试验中各样品经优化处理的测序数据统计结果如表1所示, 达到测序要求, 可进行下一步测序分析。

表1 黄瓜与西芹间作土壤真菌的测序数据质量结果
2.1 黄瓜与西芹间作土壤真菌的OUT分布Venn图
OTU(operational taxonomy unit)即可操作分类单元, 用于物种分类及物种相对丰度分析的基本元。本试验采用CD-HIT将序列相似性大于97%的clean tags定为一个OTU, 选择其中序列最长的reads作为该OTU的代表序列, 用于物种分类注释。黄瓜与西芹间作土壤的OUT分布Venn图(图1)表明, 黄瓜与西芹间作处理土壤真菌OUT总数最少, 为1 628种, 分别比黄瓜单作和西芹单作降低3.84%和8.64%。说明黄瓜与西芹间作降低了土壤真菌的种类和数量, 导致土壤物种相对丰度降低。黄瓜与西芹间作不但土壤真菌总数减少, 独有种类数也与黄瓜单作和西芹单作不同, 仅为37种, 低于黄瓜单作(74种)和西芹单作(80种)。此结果进一步说明, 黄瓜与西芹间作处理后降低和减少了土壤中真菌的种类和数量。
2.2 黄瓜与西芹间作土壤真菌Alpha多样性分析
表2表明, 黄瓜与西芹间作处理土壤真菌的Alpha多样性指标均低于两个单作处理, 黄瓜单作次之, 西芹单作最高。Shannon指数比西芹单作和黄瓜单作分别降低6.57%和3.03%, Chao1指数降低12.31%和11.51%, Simpson指数降低61.03%。4种Alpha多样性指数的降低说明黄瓜与西芹间作土壤真菌物种数比单作减少, 真菌菌群多样性水平除低。但各指数的变化均未达显著性(>0.05)。此结果与黄瓜与西芹间作土壤OUT分布Venn图结果一致。
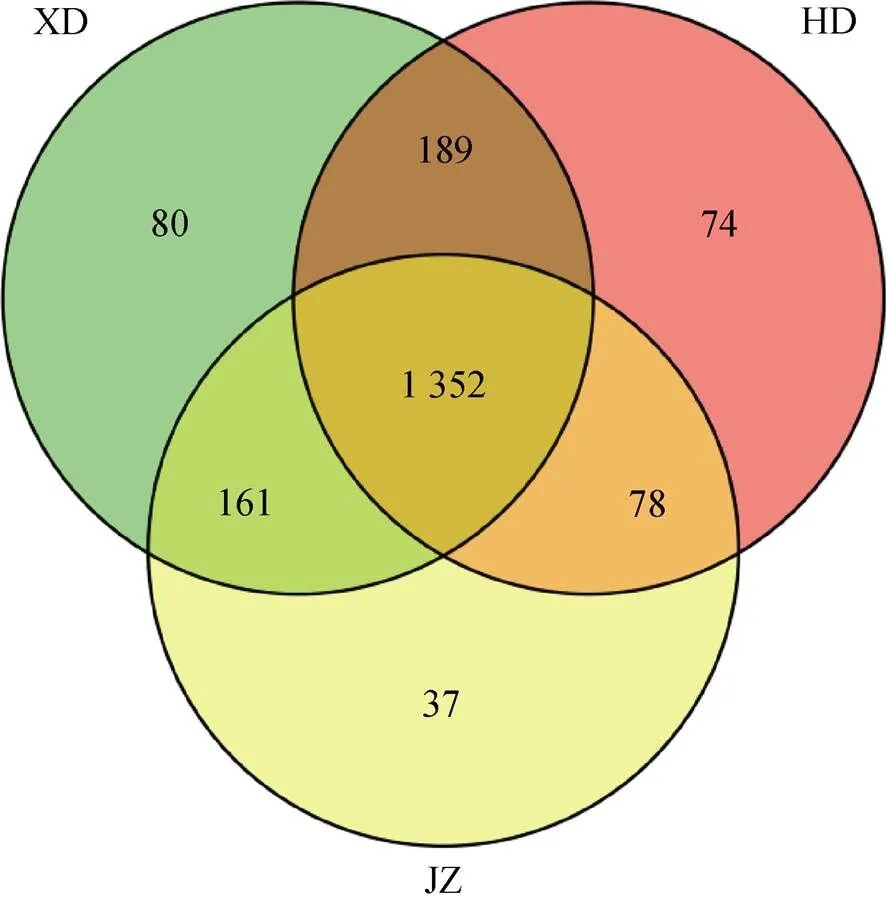
图1 黄瓜与西芹间作土壤的真菌OUT分布Venn图
JZ: 黄瓜与西芹间作; HD: 黄瓜单作; XD: 西芹单作。JZ: cucumber and celery intercropping; HD: cucumber monoculture; XD: celery monoculture.
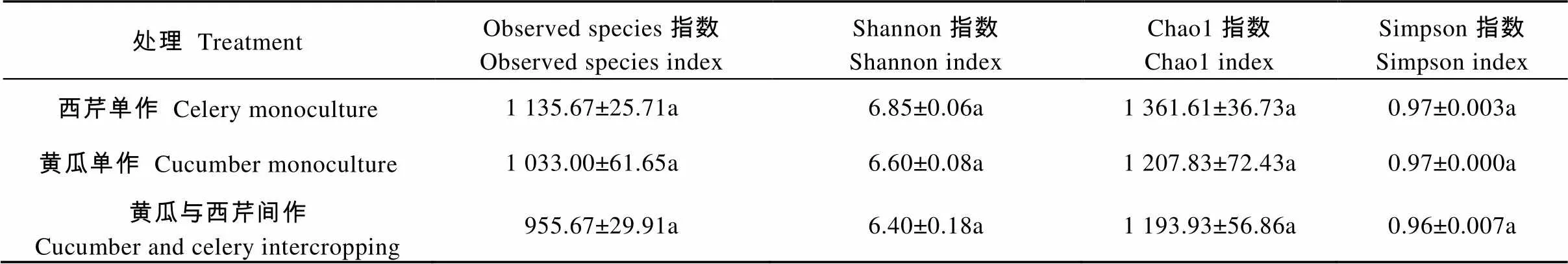
表2 黄瓜与西芹间作土壤的真菌Alpha多样性指数
小写字母相同表示不同处理间差异不显著(>0.05)。Data with same lowercase letters are not significantly different at 0.05 level.
2.3 黄瓜与西芹间作土壤真菌在门水平上的分布
2.3.1 门水平的群落组成
在门分类水平上, 黄瓜与西芹间作土壤真菌群落组成见图2。宏基因组ITS共检测出5个菌门, 子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)为3个主要菌门。黄瓜与西芹间作处理土壤的这3个菌门相对丰度最高, 达95.50%; 黄瓜单作和西芹单作分别为94.23%和93.17%。说明黄瓜与西芹间作土壤真菌菌群结构发生了变化。所有菌门中, 子囊菌门为优势菌门, 黄瓜与西芹间作土壤所占比例最高, 为89.1%, 黄瓜单作和西芹单作土壤中比例分别为85.9%和83.27%; 接合菌门为第二优势菌群, 西芹单作所占比例最高, 为6.07%, 黄瓜单作和黄瓜与西芹间作比例分别为4.3%和3.2%; 担子菌门为第三优势菌群, 黄瓜单作所占比例最高, 为4.17%, 西芹单作和黄瓜与西芹间作比例分别为3.83%和3.2%。其他菌门中, 壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota)所占比例较低, 均小于1%。
2.3.2 门水平上群落分布
黄瓜与西芹间作土壤的真菌门水平物种分类热图如图3所示, 不同处理土壤的真菌群落组成表现出了一定差异性。在门分类水平上, 西芹单作的比对期望值(expectation value)最大, 颜色最深, 物种丰富度高, 黄瓜单作和黄瓜与西芹间作次之。聚类分析表明, 黄瓜与西芹间作和黄瓜单作的真菌种类丰度一致, 群落结构相似, 西芹单作与之不同。子囊菌门和担子菌门聚为一类, 在不同处理土壤中表达量为西芹单作>黄瓜单作>黄瓜与西芹间作。
2.4 黄瓜与西芹间作土壤真菌在属水平上分布
2.4.1 属水平的群落组成
共检测出329个真菌属, 表3列出了黄瓜与西芹间作相对丰度比例大于1%的属。其中、光黑壳属()、丝孢菌属()、被孢霉属()、枝孢属()、毛壳属()、、柄孢壳菌属()、链格孢属()、为主要属, 相对丰度比例前12种的菌属占全部菌属的49.4%, 其中, 黄瓜与西芹间作所占比例最高, 为50.72%, 黄瓜单作和西芹单作分别为50.47%和47.17%。未分类或未鉴别菌种平均占9.3%, 说明黄瓜与西芹间作土壤中真菌菌属发生了变化。相对丰度大于1%的菌属中, 黄瓜与西芹间作土壤的、光黑壳属、枝孢属、漆斑菌属()、、柄孢壳菌属、链格孢属所占比例均高于黄瓜单作和西芹单作。
2.4.2 属水平的群落分布
黄瓜与西芹间作土壤真菌属水平的物种分类热图如图4所示。不同处理土壤真菌群落组成既有一定相似性, 又表现出了一定差异。从图4可知, 西芹单作的比对期望值(expectation value)最大, 颜色最深, 物种丰富度高, 黄瓜单作和黄瓜与西芹间作次之。聚类分析表明, 黄瓜与西芹间作和黄瓜单作的真菌种类丰度一致, 群落结构相似, 聚为一类, 西芹单作与之不同。和丝孢菌属聚为一类, 在各土样中表达量为西芹单作>黄瓜单作>黄瓜与西芹间作; 链格孢属和聚为一类, 在各处理土壤中的表达量为西芹单作>黄瓜与西芹间作>黄瓜单作。值得一提的是和枝孢属,在各处理土壤中表达量为黄瓜与西芹间作>西芹单作>黄瓜单作, 而枝孢属为黄瓜与西芹间作>黄瓜单作>西芹单作。
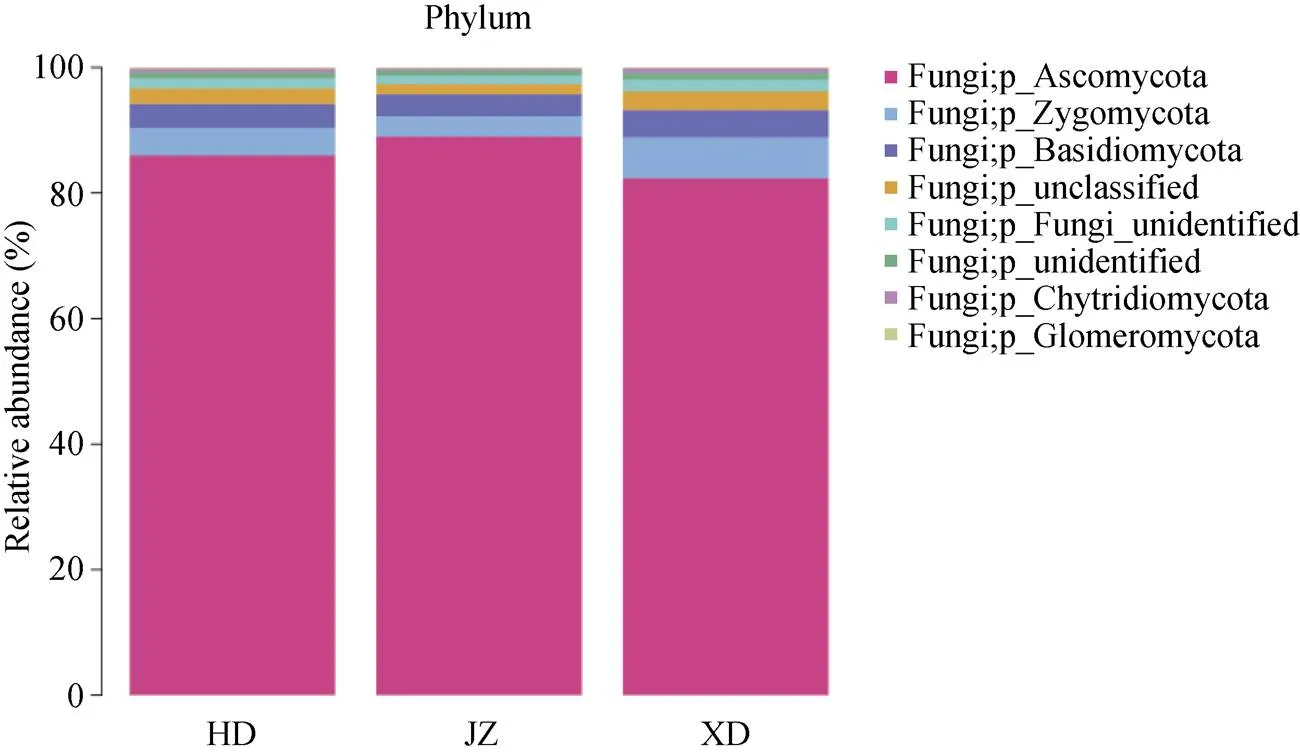
图2 黄瓜与西芹间作土壤真菌门水平的群落组成
JZ: 黄瓜与西芹间作; HD: 黄瓜单作; XD: 西芹单作。JZ: cucumber and celery intercropping; HD: cucumber monoculture; XD: celery monoculture.
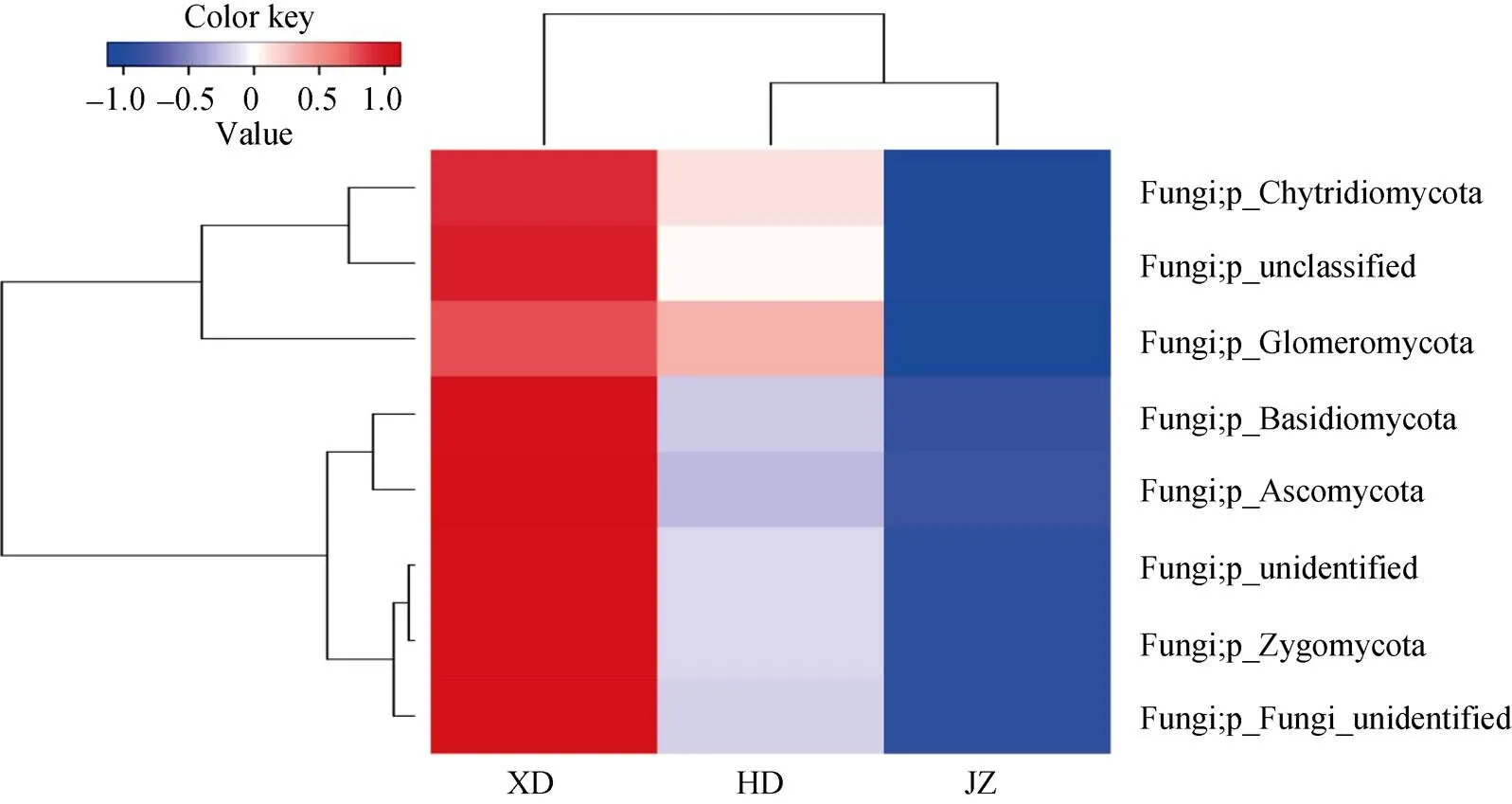
图3 黄瓜与西芹间作土壤门水平上真菌物种分类热图
JZ: 黄瓜与西芹间作; HD: 黄瓜单作; XD: 西芹单作。JZ: cucumber and celery intercropping; HD: cucumber monoculture; XD: celery monoculture.
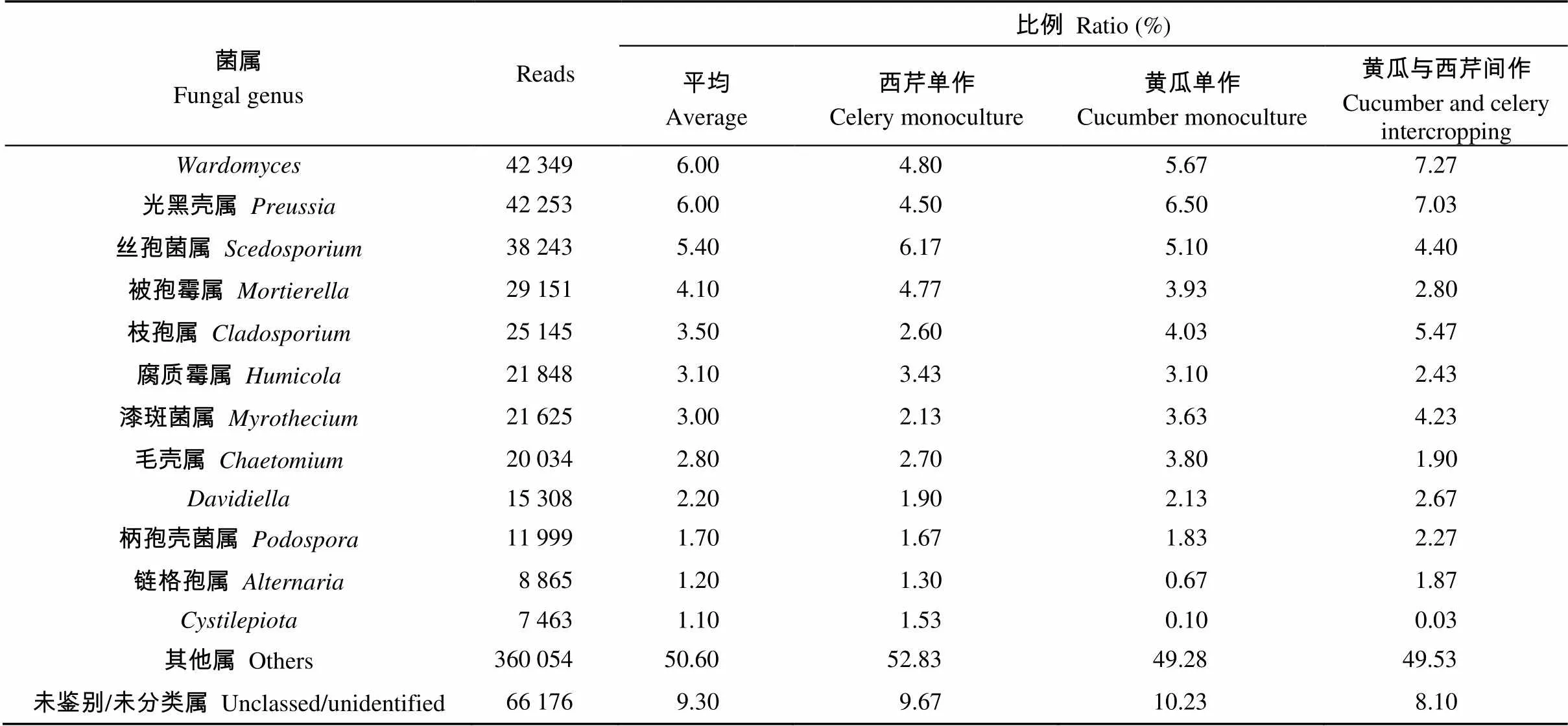
表3 黄瓜与西芹间作土壤属水平真菌的群落组成
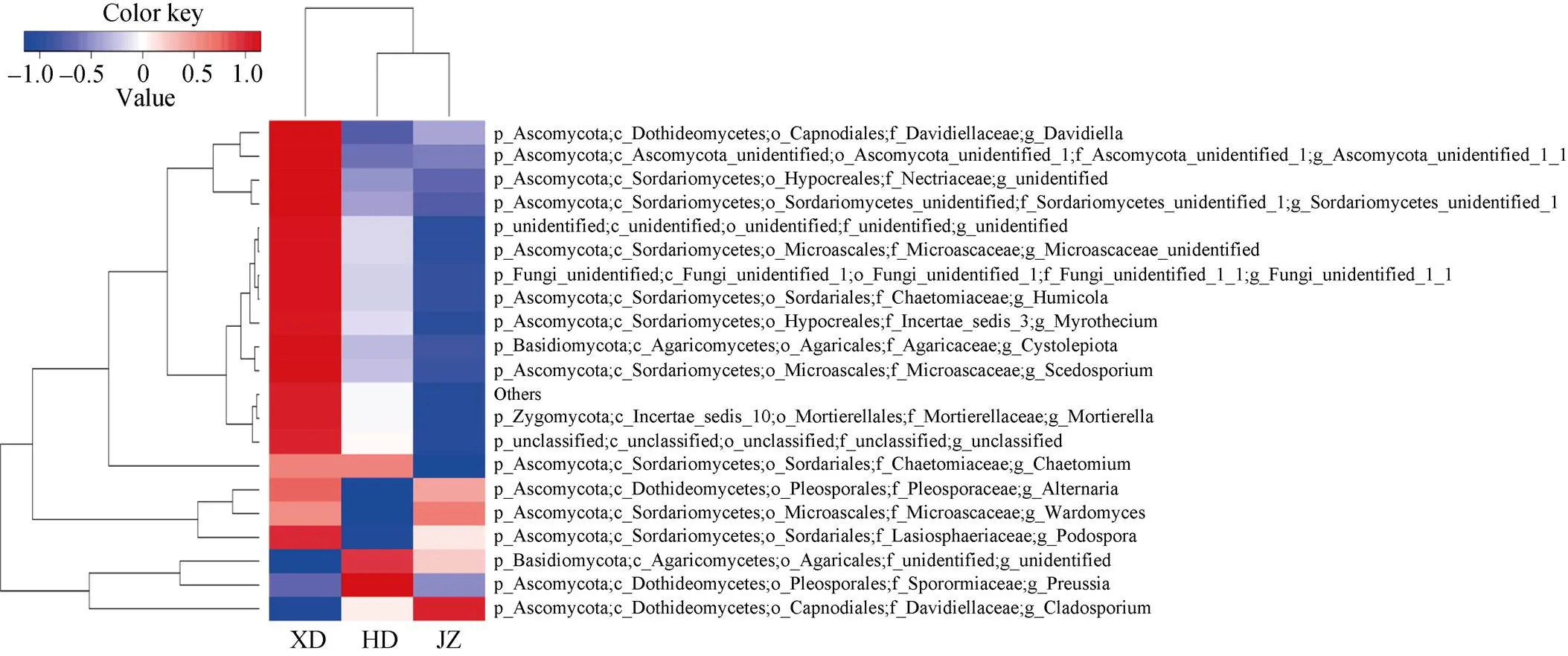
图4 黄瓜与西芹间作处理土壤属水平上真菌物种分类热图
JZ: 黄瓜与西芹间作; HD: 黄瓜单作; XD: 西芹单作。JZ: cucumber and celery intercropping; HD: cucumber monoculture; XD: celery monoculture.
3 讨论与结论
植物长期连作容易引起土传病害的发生, 是由于长期连作导致有益微生物数量减少, 病原微生物富集, 最终导致土壤微生物群落结构与组成失衡, 使病原菌更容易侵染植物而土传病害频发。大量研究表明, 植物土传病害的病原菌多为真菌, 譬如尖孢镰刀菌()、黄萎轮枝孢菌()、腐霉菌(spp.)等[14-15]。利用ITS进行土壤真菌多样性的测序分析是环境微生物多样性测序的首选方法[16]。已有大量研究表明, ITS高通量测序技术已在辣椒(L.)[17]、人参(C. A. Me)[18]、烟草(L.)[19]、小麦[20]等多种作物上应用, 而在黄瓜上的应用研究相对还较少。本试验采用ITS测序技术分析不同处理土壤真菌的多样性变化规律, 发现黄瓜与西芹间作土壤的OTU数、真菌数量和种类减少, 真菌多样性水平降低, 这与陈泽斌等[19]研究结果一致, 与康林玉等[17]研究结果不一致。本研究与前人结果不一致的原因是由于病原菌的数量和种类减少, 还是有益菌的数量和种类减少, 有待于进一步鉴定和分析。
真菌种类不同, 在土壤中发挥的作用也不同。有研究表明, 真菌是土壤微生物中推动土壤生态系统能量流动和物质循环的重要成员, 在土壤中发挥着重要的分解作用[21]。如接合菌门中的毛霉属()、根霉属()、被孢霉属等真菌能分解土壤中纤维素、果胶、木质素、淀粉等物质, 而毛壳属、镰刀菌属()、木霉属()等真菌是土壤中常见的纤维素分解者[22]。子囊菌门和接合菌门的真菌能够通过根被组织聚集, 促进根系对营养元素的吸收和有机物质分解, 提高土壤中有机质和养分含量, 从而有利于根系生长。本试验宏基因组ITS共检测出5个菌门, 子囊菌门、接合菌门和担子菌门为优势菌门, 这与很多学者用MiSeq平台ITS测序结果一致[23]。这3类菌门中, 黄瓜与西芹间作土壤增加了子囊菌门相对丰度, 但降低了接合菌门和担子菌门相对丰度。本试验中, 对于接合菌门的鉴定结果与李发虎等[21]的研究不一致, 可能是由于对黄瓜栽培方式不同造成的, 本试验黄瓜与西芹间作, 而李发虎等为黄瓜单作且土壤中施有生物炭。对于担子菌门研究结果与冀锦华等[24]不一致, 可能是由于作物种类不同。
本试验中, 未分类或未鉴别菌门占5.1%, 所占比例较大, 说明还有很多种类的真菌有待进一步鉴定和分类。其他菌门中壶菌门和球囊菌门所占比例较低, 均小于1%。黄瓜与西芹间作土壤的门水平分类热图表明, 黄瓜与西芹间作处理与黄瓜单作土壤真菌群落组成有一定相似性, 与西芹单作表现出了一定的差异性。土壤真菌OTU分布Venn图和Alpha多样性分析结果呈现的规律性一致。
在属分类水平上共检测出329类真菌属, 黄瓜与西芹间作增加了土壤光黑壳属、枝孢属、漆斑菌属、、柄孢壳菌属和链格孢属相对丰度。其中,被证实是中国一个新记录种, 其功能研究还未见报道[25]。枝孢属真菌可寄生于植物地上各部位引起病害, 常造成一定的经济损失, 是具有重要经济意义和研究价值的真菌类群[26]。而本试验中和枝孢属与其他属真菌相对丰度不同, 在黄瓜与西芹间作土壤相对丰度高于黄瓜单作和西芹单作, 对于这两种真菌菌属相对丰度的增加及其对作物病害的影响还有待于进一步试验验证和证实。光黑壳属[27]、漆斑菌属[28]被证实是植物一种内生菌, 本课题组前期研究发现西芹根能够分泌一些酸类、酯类、酚类、醇类及含氮化合物等物质[29], 这些根系分泌物可为根际微生物提供糖、氨基酸等营养的多种初级代谢产物和一些更复杂的次级代谢产物, 同时, 根际促生菌往往通过次生代谢产物的产生发挥促生和防病效应。而本试验中, 黄瓜与西芹间作增加了光黑壳属和漆斑菌属的相对丰度, 这可能也正是二者间作后降低黄瓜田间枯萎病发生的主要原因之一[12]。有研究表明, 链格孢属是引起药用植物病害的重要病原之一[30]。本试验中, 有关黄瓜与西芹间作土壤中哪些菌为有益菌, 哪些为有害菌, 这些菌与黄瓜生长发育和土传病害之间的关系还需进一步深入研究。未分类或未鉴别菌种平均占9.3%, 说明不同处理土壤中, 还有很大一部分菌属未鉴别出来, 还有待于进一步鉴定和分析。属水平分类热图表明, 黄瓜与西芹间作和黄瓜单作真菌种类丰度一致, 群落结构相似, 聚为一类, 西芹单作与之不同, 此结果与门检测水平结果一致。
综上所述, 黄瓜与西芹间作改变了土壤真菌的群落结构和组成, 增加了一些有益菌的相对丰度和组成, 提高了土壤真菌的生物多样性水平, 为以后黄瓜土壤有益微生物良好环境的创造和减少病原菌发生打下了良好的基础, 并提供了科学理论依据。
[1] 董艳, 董坤, 杨智仙, 等. 间作减轻蚕豆枯萎病的微生物和生理机制[J]. 应用生态学报, 2016, 27(6): 1984–1992 DONG Y, DONG K, YANG Z X, et al. Microbial and physiological mechanisms for alleviating fusarium wilt of faba bean in intercropping system[J]. Journal of Applied Ecology, 2016, 27(6): 1984–1992
[2] REN L X, SU S M, YANG X M, et al. Intercropping with aerobic rice suppressedwilt in watermelon[J]. Soil Biology and Biochemistry, 2008, 40(3): 834–844
[3] 吴凤芝, 周新刚. 不同作物间作对黄瓜病害及土壤微生物群落多样性的影响[J]. 土壤学报, 2009, 46(5): 899–906 WU F Z, ZHOU X G. Effect of intercropping of cucumber with different crops on cucumber diseases and soil microbial community diversity[J]. Acta Pedologica Sinica, 2009, 46(5): 899–906
[4] 张海春, 张浩, 胡晓辉. 不同间作模式对温室连作番茄产量、土壤微生物和酶的影响[J]. 西北农业学报, 2016, 25(8): 1218–1223 ZHANG H C, ZHANG H, HU X H. Effects of different intercropping patterns on tomato yield and soil microflora and enzymes activities in continuous cropping[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2016, 25(8): 1218–1223
[5] 罗佳, 刘丽珠, 王同等. 有机肥与化肥配施对黄瓜产量及土壤微生物多样性的影响[J]. 生态与农村环境学报, 2016, 32(5): 774–779 LUO J, LIU L Z, WANG T, et al. Effect of combined application of chemical fertilizer with organic manure on cucumber yield and soil microbial diversity[J]. Journal of Ecology and Rural Environment, 2016, 32(5): 774–779
[6] 于高波, 吴凤芝, 周新刚. 小麦、毛苕子与黄瓜轮作对土壤微生态环境及产量的影响[J]. 土壤学报, 2011, 48(1): 175–184 YU G B, WU F Z, ZHOU X G. Effects of rotations of cucumber with wheat and hairy vetch on soil micro-ecological environment and its yield[J]. Acta Pedologica Sinica, 2011, 48(1): 175–184
[7] 于高波. 不同轮套作方式对黄瓜产量及其根际土壤微生态环境的影响[D]. 哈尔滨: 东北农业大学, 2009 YU G B. Effects of different rotation and intercroping modes on cucumber yield and rhizosphere soil microbial environment[D]. Harbin: Northeast Agricultural University, 2009
[8] 常春玲. 伴生对土壤微生物菌群的影响及其对黄瓜生长的反馈作用[D]. 哈尔滨: 东北农业大学, 2016 CHANG C L. The effects of accompanying on soil microbial flora and their feedback on cucumber growth[D]. Harbin: Northeast Agricultural University, 2016
[9] 刘娟, 田永强, 高丽红. 夏季填闲作物对温室黄瓜连作土壤微生物群落的影响[C]//中国园艺学会2011年学术年会论文集. 合肥: 中国园艺学会, 2011: 2584 LIU J, TIAN Y Q, GAO L H. The effect of summer crops on the soil microbial community of greenhouse cucumber[C]// Proceedings of the China Horticultural Society 2011 Symposium. Hefei: Chinese Society for Horticultural Science, 2011: 2584
[10] 吕春霞, 杨文权, 慕小倩. 植物化感作用及其在杂草防治中的应用[J]. 陕西农业科学, 2002, (12): 18–20 LYU C X, YANG W Q, MU X Q. Allelopathy and its application in weed control[J]. Shaanxi Journal of Agricultural Sciences, 2002, (12): 18–20
[11] 刘小香. 巨尾桉的化感作用研究[D]. 儋州: 华南热带农业大学, 2005 LIU X X. Studies on the allelopathic potential of.×.[D]. Danzhou: South China University of Tropical Agriculture, 2005
[12] 秦立金, 徐峰, 刘永胜, 等. 黄瓜与西芹间作土壤细菌多样性及其对黄瓜枯萎病发生的影响[J]. 中国生态农业学报, 2018, 26(8): 1180–1189 QIN L J, XU F, LIU Y S, et al. Analysis of soil bacterial diversity under cucumber-celery intercropping and its influence on cucumberwilt[J]. Chinese Journal of Eco-Agriculture, 2018, 26(8): 1180–1189
[13] 秦立金, 曹巨峰, 韩伟秋, 等. 黄瓜和西芹间作对黄瓜生长及枯萎病发生的影响[J]. 中国生态农业学报, 2018, 26(5): 684–692QIN L J, CAO J F, HAN W Q, et al. Influence of cucumber-celery intercropping on growth and fusarium wilt of cucumber[J]. Chinese Journal of Eco-Agriculture, 2018, 26(5): 684–692
[14] AHONSI M O, AGINDOTAN B O, GRAY M E, et al. First report of basal stem rot and foliar blight caused byonin Illinois[J]. Plant Disease, 2011, 95(5): 616
[15] LANG J J, HU J, RAN W, et al. Control of cottonwilt and fungal diversity of rhizosphere soils by bio-organic fertilizer[J]. Biology and Fertility of Soils, 2012, 48(2): 191–203
[16] 王蓓蓓. 轮作及生物有机肥防控香蕉土传枯萎病的土壤微生物机制研究[D]. 南京: 南京农业大学, 2015 WANG B B. Combined control on fusarium wilt of banana by rotation together with application of bio-organic fertilizer and its action mechanism[D]. Nanjing: Nanjing Agricultural University, 2015
[17] 康林玉, 刘周斌, 欧立军, 等. 辣椒种植对根际土壤微生物多样性的影响[J]. 湖南农业大学学报: 自然科学版, 2018, 44(2): 151–156 KANG L Y, LIU Z B, OU L J, et al. Effects of pepper cultivation on the microbial diversity of rhizosphere soil[J]. Journal of Hunan Agricultural University: Natural Sciences, 2018, 44(2): 151–156
[18] 孙海, 王秋霞, 张春阁, 等. 不同树叶凋落物对人参土壤理化性质及微生物群落结构的影响[J]. 生态学报, 2018, 38(10): 3603–3615 SUN H, WANG Q X, ZHANG C G, et al. Effects of different leaf litters on the physicochemical properties and soil microbial communities in-growing soil[J]. Acta Ecologica Sinica, 2018, 38(10): 3603–3615
[19] 陈泽斌, 高熹, 王定斌, 等. 生物炭不同施用量对烟草根际土壤微生物多样性的影响[J]. 华北农学报, 2018, 33(1): 224–232 CHEN Z B, GAO X, WANG D B, et al. Effects of different biochar application rates on rhizosphere soil microbial diversity of tobacco[J]. Acta Agriculturae Boreali-Sinica, 2018, 33(1): 224–232
[20] 马乐乐, 翟妮平, 马庆周, 等. 平板培养结合宏测序法调查小麦田土壤真菌多样性[J]. 山东农业科学, 2018, 50(9): 119–122 MA L L, ZHAI N P, MA Q Z, et al. Investigation on fungal diversity in wheat farmland soil in Henan province by plate culture and macro sequencing methods[J]. Shandong Agricultural Science, 2018, 50(9): 119–122
[21] 李发虎, 李明, 刘金泉, 等. 生物炭对温室黄瓜根际土壤真菌丰度和根系生长的影响[J]. 农业机械学报, 2017, 48(4): 265–270 LI F H, LI M, LIU J Q, et al. Effect of biochar on fungal abundance of rhizosphere soil and cucumber root growth in greenhouse[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(4): 265–270
[22] PUGET P, ANGERS D A, CHENU C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1998, 31(1): 55–63
[23] 邢来君, 李明春. 普通真菌学[M]. 北京: 高等教育出版社, 1999 XING L J, LI M C. General Mycology[M]. Beijing: Higher Education Press, 1999
[24] 冀锦华, 王小兵, 孟建宇, 等. 大兴安岭森林表层土壤真菌多样性的分析[J]. 北方农业学报, 2016, 44(3): 5–10 JI J H, WANG X B, MENG J Y, et al. Analysis of fungal diversity in the surface soil of Great Khingan forest[J]. Journal of Northern Agriculture, 2016, 44(3): 5–10
[25] 潘好芹, 夏海波, 张天宇. 维罗纳霉属和沃德霉属三个新记录种[J]. 菌物学报, 2012, 31(1): 133–135PAN H Q, XIA H B, ZHANG T Y. Three newly recorded species ofandfrom China[J]. Mycosystema, 2012, 31(1): 133–135
[26] 李旭. 枝孢属的形态分类概述[J]. 安徽农业科学, 2013, 41(14): 6254–6255 LI X.Review of morphology classification of[J]. Journal of Anhui Agricultural Sciences, 2013, 41(14): 6254–6255
[27] 马瑜, 柯杨, 强毅, 等. 光黑壳属植物内生菌的一个新纪录种[J]. 微生物学杂志, 2013, 33(5): 46–49 MA Y, KE Y, QIANG Y, et al. A newly recorded endophyticspecies in China[J]. Journal of Microbiology, 2013, 33(5): 46–49
[28] 刘威振, 谭国慧, 潘清灵, 等. 广藿香内生真菌露湿漆斑菌菌丝体化学成分研究[J]. 广东药学院学报, 2014, 30(4): 427–429 LIU W Z, TAN G H, PAN Q L, et al. Chemical constituents of the mycelia of an endophyticfrom(Blanco) Benth[J]. Journal of Guangdong Pharmaceutical University, 2014, 30(4): 427–429
[29] 高晓敏, 王琚钢, 李杰, 等. 西芹鲜根丙酮浸提物层析流分对黄瓜枯萎病菌的化感作用以及化感物质鉴定[J]. 中国生态农业学报, 2014, 22(11): 1364–1371 GAO X M, WANG J G, LI J, et al. Allelopathic effects of fresh parsley root acetone extracts onf. sp.and allelochemicals identification[J]. Chinese Journal of Eco-Agriculture, 2014, 22(11): 1364–1371
[30] 王艳, 陈秀蓉, 王引权, 等. 甘肃省药用植物上链格孢属()病原的种类及分布Ⅰ[J]. 植物保护, 2012, 38(2): 156–159 WANG Y, CHEN X R, WANG Y Q, et al.species on medicinal plants in Gansu Province[J]. Plant Protection, 2012, 38(2): 156–159
Soil fungal ITS diversity in cucumber-celery intercropping*
QIN Lijin1,2, YU Tiantian1, WANG Jiaming1, GAO Yinbiao1, WANG Shouzheng1, LI Zheng1,YUN Xingfu2**
(1. College of Life Science, Chifeng University, Chifeng 024000, China; 2. Agricultural College of Inner Mongolia Agricultural University, Hohhot 010018, China)
Cucumber wilt is a soil-borne disease that retards cucumber production. Intercropping can be used to reduce the prevalence of plant soil-borne diseases, and celery is widely used in intercropping because of its allelopathic property. This study was carried out to explore the effect of cucumber and celery intercropping on cucumber fusarium wilt and soil fungal diversity. Soils from celery monoculture, cucumber monoculture, and cucumber and celery intercropping were analyzed for fungal ITS diversity. The amount of OUT and the Alpha diversity of soil fungi were reduced with the intercropping. Observed species index, Shannon index, Chao1 index, and Simpson index showed reducing for the intercropping though change was not significant. Five fungal phyla were identified, among which Ascomycota, Zygomycota, and Basidiomycota were the primary ones, accounting for up to 95.50% of the total phyla with the intercropping. Cucumber and celery intercropping and cucumber monoculture appeared to be in the same cluster of phyla, clearly distinct from celery monoculture. There were 329 fungal genera that were identified, and half of their abundance was accounted for by 12 genera, specifically 50.72%, 50.47%, and 47.17% for cucumber and celery intercropping, cucumber monoculture, and celery monoculture, respectively. The genus cluster distribution was consistent with the phylum distribution. Cucumber and celery intercropping altered the structure and composition of the soil fungal community, specifically enriching fungal diversity. The information provided an insight into the use of biological means to control soil-borne diseases encountered in cucumber production.
Cucumber and celery intercropping; ITS fungal sequencingtechnique; Soil fungi; Fungal community; Diversity indexes
, E-mail: yxf5807@163.com
May 19, 2018;
Dec. 14, 2018
10.13930/j.cnki.cjea.180484
S476
A
2096-6237(2019)04-0529-08
云兴福, 研究方向为高寒地区蔬菜栽培与生理。E-mail: yxf5807@163.com
秦立金, 研究方向为设施蔬菜土传病害生物防治与土壤修复。E-mail: 1597355169@qq.com
2018-05-19
2018-12-14
* This study was founded by the National Natural Science Foundation of China (31160100), Major Science and Technology Project of Inner Mongolia Autonomous Region in 2018, Application Technology Research and Development Project of Inner Mongolia Autonomous Region (201602050).
* 国家自然科学基金项目(31160100)、2018年内蒙古自治区科技重大专项和内蒙古自治区应用技术研究与开发项目(201602050)资助
秦立金, 于田田, 王佳明, 高寅彪, 王守政, 李铮, 云兴福. 黄瓜与西芹间作对黄瓜土壤真菌ITS多样性分析[J]. 中国生态农业学报(中英文), 2019, 27(4): 529-536
QIN L J, YU T T, WANG J M, GAO Y B, WANG S Z, LI Z, YUN X F. Soil fungal ITS diversity in cucumber-celery intercropping[J]. Chinese Journal of Eco-Agriculture, 2019, 27(4): 529-536
