铅胁迫下接种AM真菌对龙葵根际土壤微生物群落代谢特征的影响*
2019-04-13张向前赵金莉
韩 娟, 张向前, 赵金莉
铅胁迫下接种AM真菌对龙葵根际土壤微生物群落代谢特征的影响*
韩 娟, 张向前, 赵金莉**
(河北大学生命科学学院 保定 071002)
为从微生态角度探索接种AM真菌对铅污染根际土壤微生物群落代谢特征的影响, 以摩西管柄囊霉()和幼套近明囊霉()为接种菌剂, 在温室盆栽条件下以Pb4+含量为0 mg∙kg-1、200 mg∙kg-1、400 mg∙kg-1和800 mg∙kg-1土壤种植龙葵()10周后采集根际土壤, 采用Biolog微平板法测定龙葵根际土壤微生物群落的代谢变化。结果表明: 1)微生物平均代谢活性(AWCD)随铅浓度增加呈降—升—降趋势; 接种AM真菌显著提高了铅胁迫下根际土壤微生物的AWCD值, 仅中浓度(400 mg∙kg-1)下未达显著差异。2)中浓度铅处理能显著提高根际土壤微生物对糖类及其衍生物、氨基酸类、脂肪酸和脂类及代谢产物类四大类碳源底物利用能力; 接种AM真菌, 高浓度(800 mg∙kg-1)铅处理显著提高了根际土壤微生物对氨基酸类底物的利用能力。3)铅胁迫下接种AM真菌提高了根际土壤微生物多样性指数, 在中浓度下丰富度指数、Shannon-Wiener多样性指数、Simpson优势度指数均达显著水平。4)主成分分析显示, 代谢产物类在PC1和PC2中种类最多, 分别为6种和4种; 糖类及其衍生物在PC3中种类最多(5种)。5)在铅胁迫和接种AM真菌共同作用下, 微生物碳源利用主要受铅浓度调节, 并且二者对微生物碳源利用具有显著交互效应。综上可知, 接种AM真菌能够提高铅胁迫下龙葵根际土壤微生物多样性指数, 增强根际土壤微生物对碳源底物的利用能力。该研究为进一步探究AM真菌强化植物联合修复技术提供了依据。
AM真菌; 龙葵; 铅胁迫; 根际土壤; 微生物代谢特征; Biolog-ECO微平板
全国土壤污染调查结果显示, 我国土壤重金属污染突出, 污染类型主要以镉、铅、铜、锌等为主。目前, 全世界平均每年排放铅约5×106t, 我国约有1.3×104hm2耕地受到铅等重金属严重污染, 致使粮食减产达1.0×107t[1]。土壤中铅过量会使植物生长受到抑制[2], 影响植物光合作用和呼吸作用, 不利于植物对养分的吸收, 最终影响植物产量和质量。传统修复铅污染土壤的方法不仅消耗成本高, 而且可能造成环境二次污染, 近年来兴起的植物提取修复技术显示出良好的应用前景。但由于富集植物通常存在植株矮小、生长缓慢、生物量低等问题, 导致修复效率低、修复时间长[3]。土壤微生物不仅能促进植物生长, 同时能利用其分泌的活性物质改变重金属形态, 促进植物对重金属的吸收, 提高植物修复效率[4]。
AM(arbuscular mycorrhiza)真菌是自然界分布最广的一类真菌, 能与陆地上80%以上植物根系建立共生关系[5]。重金属污染条件下, AM真菌与植物根系形成的共生体能促进植物对营养元素的吸收, 增强植物抗逆性[6]; 提高植物在重金属污染土壤中的耐受能力, 减轻重金属对植物体的毒害[7]; 调节植株对重金属的吸收和转运, 使重金属从土壤中高效移出, 实现生物修复[8-9]。研究证实, 接种AM真菌显著提高了万寿菊()对镉的吸收, 增加镉向地上部转运[10]。接种AM真菌促进了翅荚木()对重金属的吸收, 提高了翅荚木植株重金属累积量[11]。近年来AM真菌强化植物修复的作用和机理研究成为生物修复的一个热点领域[12]。但是, 目前围绕AM真菌在重金属污染土壤生物修复作用中的研究主要集中在对植物生理代谢的调控、物理性防御体系的形成、生化拮抗物质的产生及基因表达的调控等方面, 而从根际土壤微生态角度的研究尚不多见。因此, 研究重金属污染下AM真菌对超富集植物根际土壤微生物群落代谢特征的影响, 对于进一步理解AM真菌强化植物联合修复机理具有重要意义。
本试验以重金属超富集植物龙葵()为研究对象, 在不同Pb4+浓度处理下接种AM真菌, 应用Biolog-ECO方法对比分析根际土壤微生物代谢功能多样性, 旨在深入理解AM真菌影响宿主植物吸收、转运和累积重金属的作用机制, 为充分利用菌根生物技术强化植物修复重金属污染土壤提供依据。
1 材料与方法
1.1 供试土壤
供试土壤采自河北省保定市郊区农田, 其基本理化性质: 全氮0.89 g·kg-1, 全磷1.07 g·kg-1, 全钾15.12 g·kg-1, 速效氮115.60 mg·kg-1, 速效磷24.48 mg·kg-1, 速效钾348 mg·kg-1, 有机质35.17 g·kg-1, 重金属铅含量为1.12 mg·kg-1(试验中忽略不计), pH 6.82。土壤采回后, 风干, 过2 mm筛, 除去石块、植物根系等杂物。各处理均以一定量Pb(CH3COO)2·3H2O溶液喷洒到土壤里, 充分混匀。放置四周后装入花盆, 每盆3 kg土壤。
1.2 AM真菌
供试AM真菌为摩西管柄囊霉()和幼套近明囊霉()(北京市农林科学院提供), 接种菌剂为经玉米扩繁后获得含有孢子、菌丝和侵染根段的混合物[摩西管柄囊霉的孢子密度为40.8 个∙(10g)-1(土), 幼套近明囊霉的孢子密度为34.8 个∙(10g)-1(土)], 装入柱状尼龙袋, 放入花盆内土壤的中间部位, 接种剂量为基质重量的7%, 接种方法见图1。
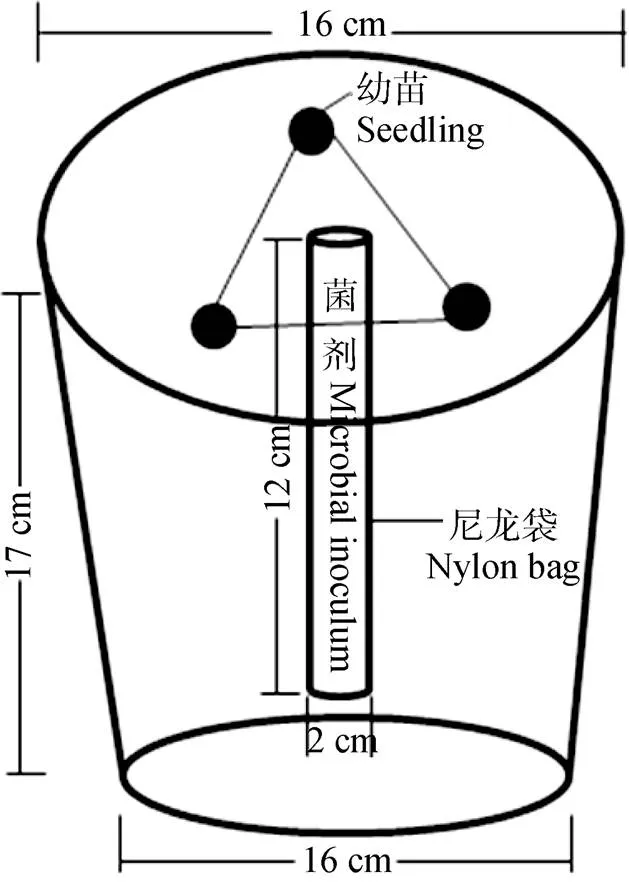
图1 菌剂接种及播种方式
1.3 试验设计
试验为双因素试验: 因素一为接菌处理, 包括接种AM真菌和未接种AM真菌; 因素二为Pb4+处理, 包括0 mg∙kg-1(CK)、200 mg∙kg-1(Pb1, 低浓度)、400 mg∙kg-1(Pb2, 中浓度)、800 mg∙kg-1(Pb3, 高浓度)4个Pb4+浓度[根据《土壤环境质量标准》(GB 15618-1995)设定Pb4+浓度]。共计8个处理, 即不接种AM真菌CK、Pb1、Pb2、Pb3和接种AM真菌AM+CK、AM+Pb1、AM+Pb2、AM+Pb3。每处理4个重复。
1.4 龙葵的培育及样品采集
龙葵种子由北京市医学科学院药用植物研究所提供。挑选大小一致饱满的龙葵种子经18 g∙L-1稀HCl溶液室温浸泡24 h[13], 用去离子水冲洗3次, 经0.5% NaClO消毒20 min, 去离子水冲洗干净, 取出摆放于湿滤纸上, 在25 ℃培养箱中暗培养48 h。挑选萌发一致的龙葵种子, 分别播种于不同处理的花盆内, 待幼苗出土后, 保留呈三角形分布的3株长势一致的幼苗(图1)。在光照16 h(28 ℃)、黑暗8 h(20 ℃)、光照强度为12 000 Lux的温室中培养。10周后, 将龙葵根系从土壤中挖出, 慢慢抖掉与根系结合比较松散的土壤, 然后用灭菌镊子刮取附着在根系上的薄层土壤作为根际土壤[14], 装入自封袋, 4 ℃保存。
1.5 测试及计算方法
1.5.1 土壤微生物群落功能多样性
采用(Biolog-ECO)生态板分析微生物群落代谢特征。称取相当于10 g干重的鲜土, 加入90 mL无菌生理盐水, 振摇30 min, 静置沉淀3~5 min, 100倍稀释, 以每孔150 μL稀释液加入微孔板中。接种好的微平板放到铺有6层湿纱布的塑料饭盒中, 塑料饭盒用保鲜膜包裹, 保鲜膜扎若干个小孔, 以保证微生物培养所需氧气, Biolog-ECO生态板在30 ℃恒温箱避光培养。于培养1~10 d后同一时间在酶标仪上读取微孔溶液在590 nm和750 nm的吸光值。
1.5.2 土壤微生物代谢活性
描述土壤微生物代谢活性常用微孔中溶液平均颜色变化率(average well color development, AWCD)[14], 计算公式:
AWCD=∑(C-)(1)
式中:C为碳源微孔吸光值,为对照孔吸光值,为Biolog微平板上供试碳源种类(=31)。
1.5.3 土壤微生物多样性指标
丰富度指数(): 被利用碳源总数目, 即(C−R)>0.25的孔数。
Simpson优势度指数(): 表征微生物群落中最常见物种的优势度。
=1-∑P2(2)
式中:P为第孔相对吸光值与整个平板相对吸光值总和的比率。
Shannon-Wiener多样性指数(): 反映微生物群落物种及其个体数。
=∑P×lnP (3)
Mclntosh均匀度指数(): 反映微生物群落中个体分布的均匀程度。
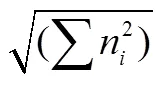
式中:n为第孔的相对吸光值(C-)。
1.5.4 数据统计分析
采用SPSS 19.0对数据进行统计分析, 独立样本检验用于检验单个培养时间条件下AWCD值和微生物多样性指数在铅处理之间的差异显著性(<0.05)。重复测量数据方差分析用于评价AM真菌对铅胁迫下根际微生物碳源利用和多样性的影响。主成分分析和多变量方差分析用于比较碳源利用在不同处理之间的总体差异显著性。
2 结果与分析
2.1 AM真菌对铅胁迫下龙葵根际土壤微生物利用碳源动力学特征的影响
AWCD反映土壤微生物群落对碳源利用的整体情况及利用活性。结果表明, 随着培养时间延长, 微生物利用碳源的量逐渐增加, 24 h至96 h增长快速, 144 h后增长缓慢(图2a-d)。与对照相比, 低浓度和高浓度铅处理均降低了根际土壤微生物的AWCD, 中浓度铅处理提高了AWCD(图2b、2d、2c); 接种AM真菌明显提高了根际土壤微生物代谢强度, 仅Pb4+浓度为400 mg·kg-1时未达显著差异(<0.05)。方差分析结果表明, 铅胁迫和接种AM真菌对龙葵根际微生物AWCD值均有显著影响, 二者具有显著交互效应(表1,<0.05)。
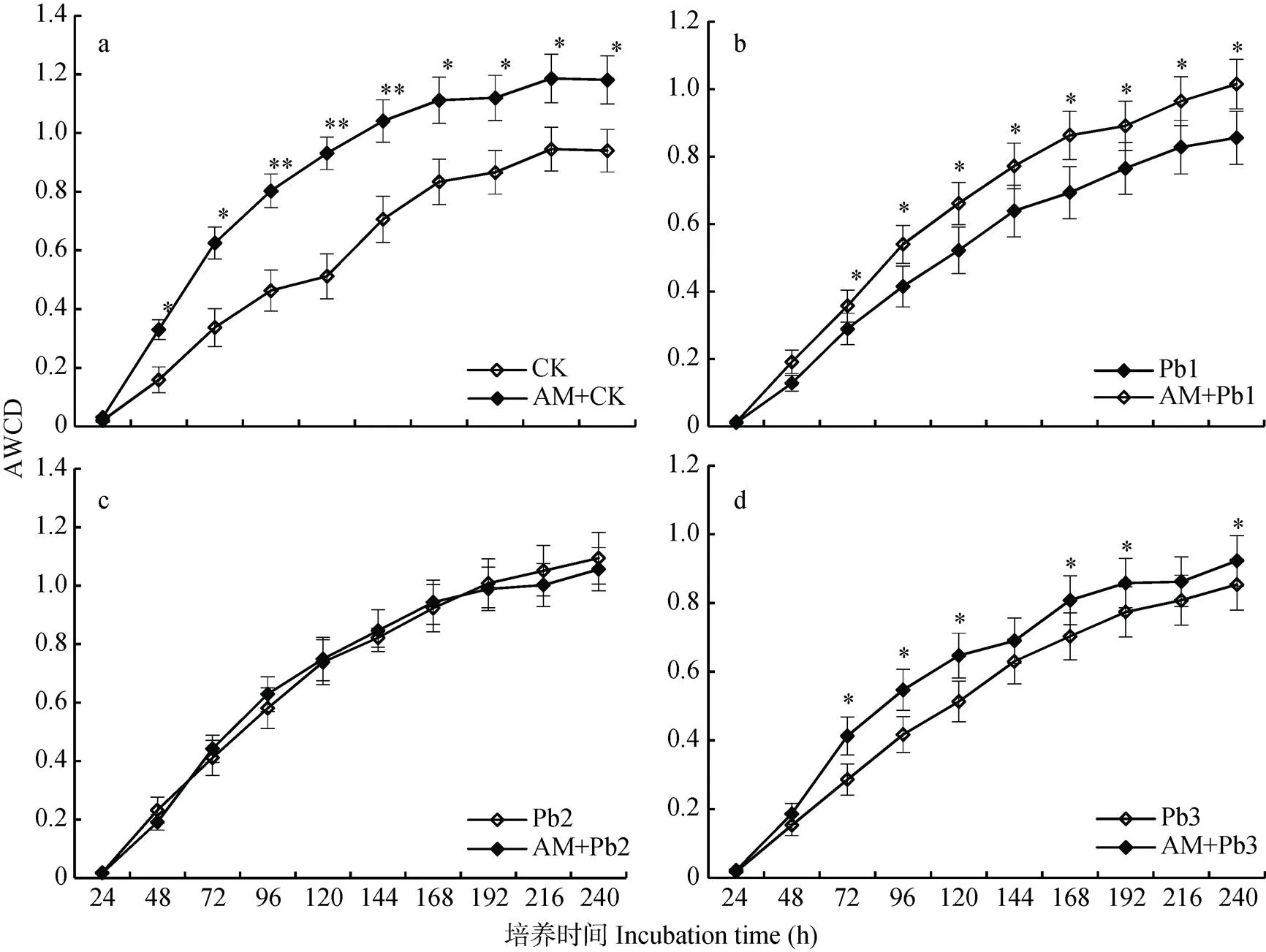
图2 接种AM真菌对铅胁迫下龙葵根际土壤微生物平均颜色变化率(AWCD)的影响
CK: 未接种AM真菌, Pb4+为0 mg∙kg-1; AM: 接种AM真菌; Pb1: Pb4+浓度为200 mg∙kg-1(低浓度); Pb2: Pb4+浓度为400 mg∙kg-1(中浓度); Pb3: Pb4+浓度为800 mg∙kg-1(高浓度)。*和**分别表示在<0.05和<0.01水平差异显著。CK: no AM with 0 mg∙kg-1Pb4+; AM: inoculation of AM; Pb1: low Pb4+concentration(200 mg∙kg-1); Pb2: medium Pb4+concentration (400 mg∙kg-1); Pb3: high Pb4+concentration (800 mg∙kg-1). * and ** mean significant difference at< 0.05 and< 0.01 levels, respectively.
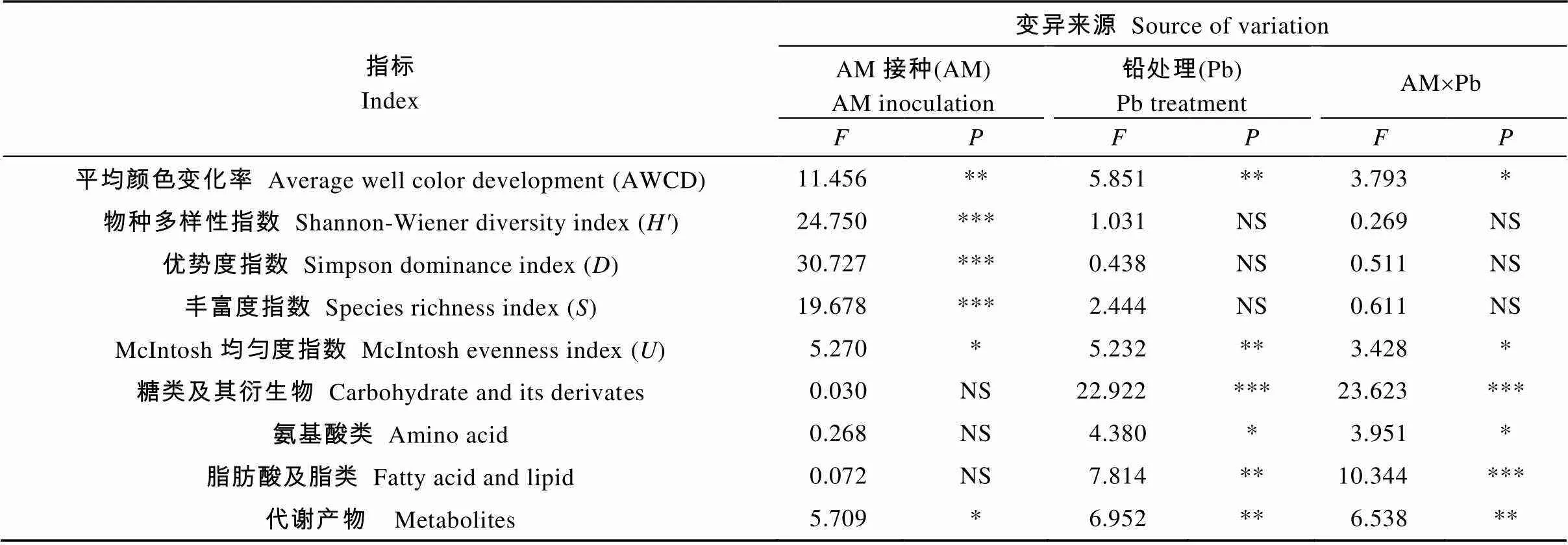
表1 接种AM真菌和铅胁迫对各测定指标影响的方差分析
NS: 不显著; *: 显著水平为<0.05; **: 显著水平为<0.01; ***: 显著水平为<0.001。NS: no significant difference; *: significant difference at< 0.05; **: significant difference at< 0.01; ***: significant difference at< 0.001.
2.2 AM真菌对铅胁迫下龙葵根际土壤微生物多样性指数的影响
土壤微生物培养120 h时, 各处理间平均颜色变化率开始出现明显差异, 本研究选取120 h的AWCD值分析根际土壤微生物群落多样性。由表2可见, 铅胁迫降低了根际土壤微生物群落的McIntosh均匀度指数, 而对丰富度指数、Shannon-Wiener 指数和Simpson指数无显著影响(<0.05); 同一Pb4+浓度处理下, 接种AM真菌提高了根际土壤微生物多样性指数, 并且在中浓度下丰富度指数、Shannon-Wiener指数和Simpson指数均达到显著水平(<0.05)。方差分析结果表明, AM真菌对多样性指数均有显著影响, 铅处理只对McIntosh指数有显著影响, 二者对McIntosh指数有显著交互效应(表1)。

表2 接种AM真菌对铅胁迫下龙葵根际土壤微生物功能多样性指数的影响
CK: 未接种AM真菌, Pb4+为0 mg∙kg-1; AM: 接种AM真菌; Pb1: Pb4+浓度为200 mg∙kg-1(低浓度); Pb2: Pb4+浓度为400 mg∙kg-1(中浓度); Pb3: Pb4+浓度为800 mg∙kg-1(高浓度)。同列不同小写字母分别表示接种AM真菌或未接种AM真菌处理下不同Pb4+浓度间差异显著(<0.05); 同列不同大写字母表示同一Pb4+浓度下接种AM和不接种AM处理间差异显著(<0.05)。CK: no AM with 0 mg∙kg-1Pb4+; AM: inoculation of AM; Pb1: low Pb4+concentration (200 mg∙kg-1); Pb2: medium Pb4+concentration (400 mg∙kg-1); Pb3: high Pb4+concentration (800 mg∙kg-1). Different lowercase letters in the same column indicate significant differences among different concentrations of Pb4+at< 0.05. Different capital letters in the same column indicate significant differences between AM inoculation and no inoculation under the same Pb4+concentration at< 0.05.
2.3 AM真菌对铅胁迫下龙葵根际土壤微生物碳源利用强度的影响
本试验以微生物对三大营养物质代谢途径为基本划分原则, 将Biolog-Eco的31种碳源底物分为4大类: 糖类及其衍生物、氨基酸类、脂肪酸和脂类、代谢产物类。利用各处理培养120 h的AWCD值分析土壤微生物利用碳源能力(表3)。不接种AM真菌处理, 中浓度Pb4+(Pb2)增强了土壤微生物对碳源的利用能力, 且对糖类及其衍生物、代谢产物类代谢能力的变化达显著水平(<0.05); 接种AM真菌条件下, 铅处理降低了土壤微生物对碳源的代谢能力, 且对脂肪酸和脂类、代谢产物类代谢能力的变化达显著水平, 但4大类碳源底物代谢能力在不同铅浓度间无显著差异(<0.05)。

表3 接种AM真菌对铅胁迫下龙葵根际土壤微生物碳源利用强度的影响
CK: 未接种AM真菌, Pb4+为0 mg∙kg-1; AM: 接种AM真菌; Pb1: Pb4+浓度为200 mg∙kg-1(低浓度); Pb2: Pb4+浓度为400 mg∙kg-1(中浓度); Pb3: Pb4+浓度为800 mg∙kg-1(高浓度)。同列不同小写字母分别表示接种AM真菌或未接种AM真菌处理下不同Pb4+浓度间差异显著(<0.05); 同列不同大写字母表示同一Pb4+浓度下接种AM和不接种AM处理间差异显著(<0.05)。CK: no AM with 0 mg∙kg-1Pb4+; AM: inoculation of AM; Pb1: low Pb4+concentration (200 mg∙kg-1); Pb2: medium Pb4+concentration (400 mg∙kg-1); Pb3: high Pb4+concentration (800 mg∙kg-1). Different lowercase letters in the same column indicate significant differences among concentrations of Pb4+at< 0.05. Different capital letters in the same column indicate significant differences between AM inoculation and no inoculation under the same Pb4+concentration at< 0.05.
同一Pb4+浓度胁迫下, 接种AM真菌能增强土壤微生物对4大类碳源的代谢能力, 仅对氨基酸类影响显著(<0.05)。方差分析结果表明, 接种AM真菌只对代谢产物类有显著影响, 铅处理对4类碳源都有显著影响, 且二者对4类碳源的利用有显著交互效应(表1)。
2.4 龙葵根际土壤微生物群落代谢特征主成分分析
利用各处理培养120 h微生物群落对31种碳源代谢情况做主成分分析, 共提取6个主成分, 累积方差贡献率达98.38%。其中第1主成分(PC1)、第2主成分(PC2)和第3主成分(PC3)方差贡献率分别为27.25%、24.15%和21.64%, 其余主成分贡献率较小, 因此选取前3个主成分得分值绘图(PC1为轴, PC2为轴, PC3为轴)。从图3可见, 不同处理根际土壤微生物群落代谢特征存在明显差异。无论接种AM真菌与否, 中浓度Pb4+(Pb2)处理均集中分布在平面上, 高(Pb3)、低(Pb1)浓度Pb4+处理集中分布在平面上; 无铅处理接种AM真菌分布在平面上。说明微生物碳源利用主要受铅浓度调节, 无铅胁迫下AM真菌起主导作用。
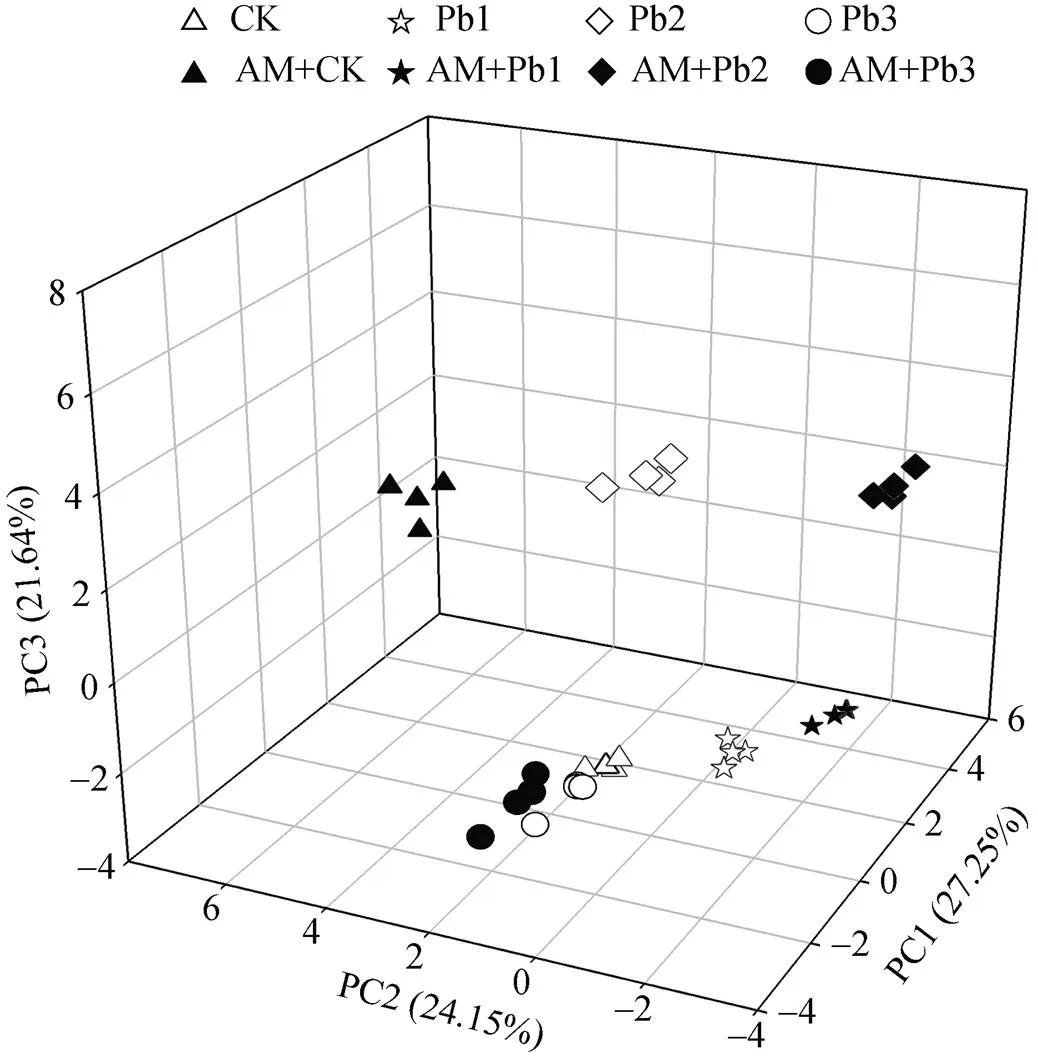
图3 接种AM真菌和铅胁迫下龙葵根际土壤微生物群落碳源代谢特征的主成分分析
CK: 未接种AM真菌, Pb4+为0 mg∙kg-1; AM: 接种AM真菌; Pb1: Pb4+浓度为200 mg∙kg-1(低浓度); Pb2: Pb4+浓度为400 mg∙kg-1(中浓度); Pb3: Pb4+浓度为800 mg∙kg-1(高浓度)。CK: no AM with 0 mg∙kg-1Pb4+; AM: inoculation AM; Pb1: low Pb4+concentration (200 mg∙kg-1); Pb2: medium Pb4+concentration (400 mg∙kg-1); Pb3: high Pb4+concentration(800 mg∙kg-1).
31种碳源主成分分析中的因子载荷可反映碳源利用的差异, 绝对值越大, 表明该基质的影响越大, 在众多碳源中起主要分异作用[15]。由表4可知, PC1中贡献大的碳源(|载荷值|≥0.5)有14种(糖类及其衍生物5种, 氨基酸类1种, 脂肪酸和脂类2种, 代谢产物类6种); 对PC2贡献大的碳源(|载荷值|≥0.5)有11种(糖类及其衍生物1种, 氨基酸类3种, 脂肪酸和脂类3种, 代谢产物类4种); PC3中贡献大的碳源(|载荷值|≥0.5)有9种(糖类及其衍生物5种, 氨基酸类3种, 代谢产物类1种)。综合分析, 糖类及其衍生物和代谢产物类碳源为各处理下微生物功能多样性表现出差异的敏感碳源, 代谢产物类中的葡萄糖-1-磷酸盐、4-羟基苯甲酸和D-苹果酸, 在PC1和PC2载荷均达到0.5以上。
3 讨论
平均颜色变化率(AWCD)是土壤微生物群落利用单一碳源能力的重要指标, 反映了土壤微生物利用碳源的能力和代谢活性的大小, 其值越高, 说明土壤微生物群落的代谢活性越强[16-17]。本研究结果表明, 不接种AM真菌时, 中浓度铅处理的AWCD值明显高于无铅处理和低、高浓度铅处理; 接种AM真菌后, 各铅浓度处理的AWCD值均升高, 仅中浓度铅处理未达显著。说明根际土壤微生物群落对铅胁迫有一个逐渐适应的过程, 土壤环境受到铅胁迫时, 土壤微生物为了维持生存可能需要更多能量, 从而使代谢活性增强[18], 当铅浓度超过某一阈值(400 mg·kg-1)时, 就会对土壤微生物造成不可逆转的损伤, 因而代谢活性逐渐降低; 接种AM真菌缓解了铅胁迫对根际土壤微生物生存环境的影响, 有利于土壤微生物发挥其代谢功能, 表现出较高的碳源利用率和代谢多样性。AM真菌根外菌丝、泡囊以及丛枝结构具有较大的比表面积, 对重金属具有更强的生物吸附能力, 能够固定更多重金属, 同时AM真菌通过分泌球囊霉素相关土壤蛋白、低分子量有机酸等化合物与土壤中重金属离子结合, 改变根际土壤重金属形态, 导致土壤中有效态重金属含量下降, 提高了土壤对铅的缓冲能力, 缓解了铅的抑制作用, 使得土壤微生物活性以及碳源代谢能力有所恢复。Gadkar等[19]发现, 高浓度重金属胁迫下球囊霉素超表达; 陈卫莉等[20]的研究也表明, 铅胁迫下接种AM真菌提高了土壤球囊霉素含量, 并且在含铅、锌的重污染土壤中, 球囊霉素相关蛋白优先固定土壤中的铅[21]。
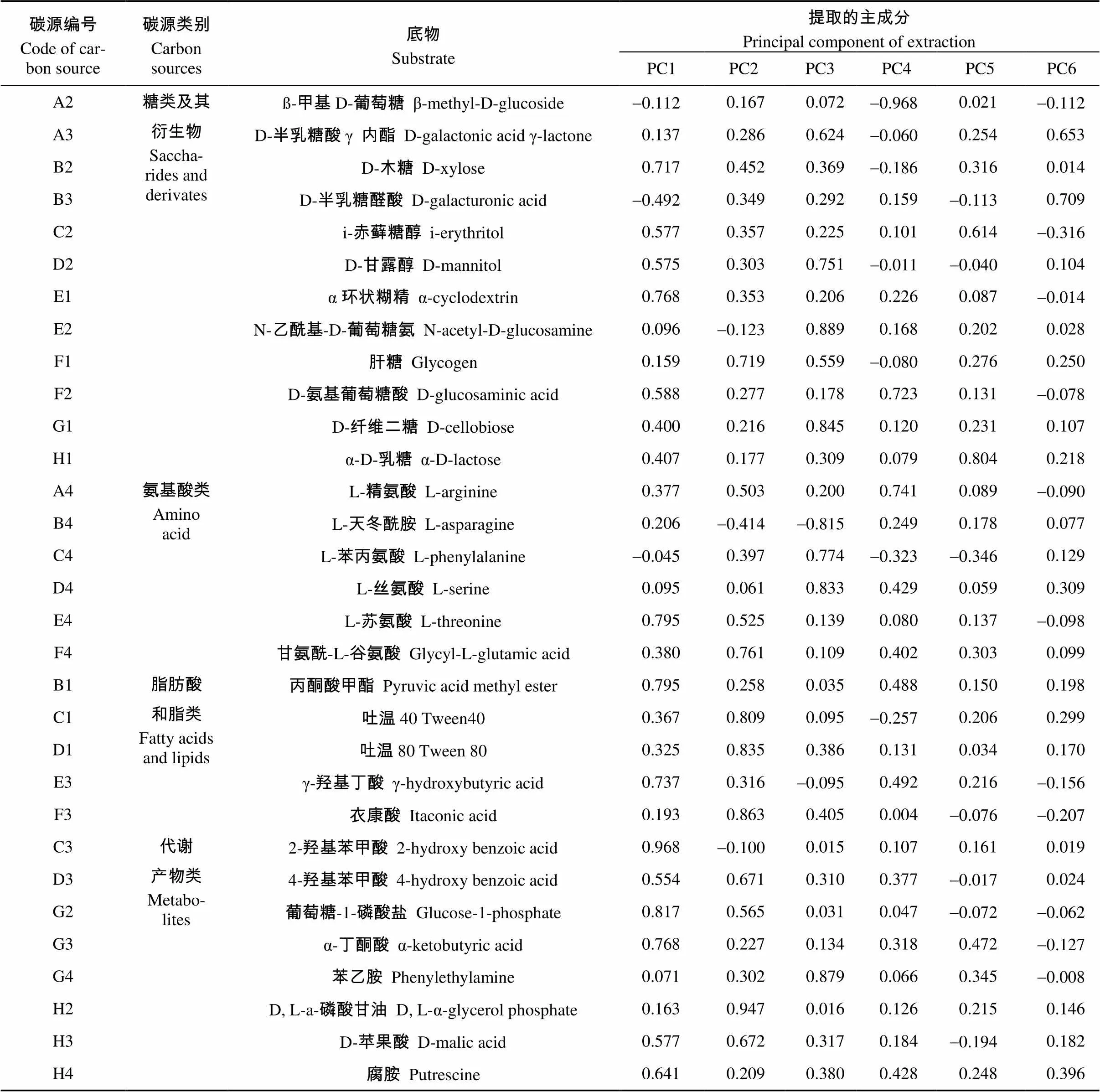
表4 接种AM真菌和铅胁迫下龙葵根际土壤微生物Biolog-ECO板上碳源利用的主成分载荷矩阵
土壤微生物Shannon-Wiener多样性指数、Simpson优势度指数和McIntosh均匀度指数分别表征土壤微生物的丰富度、优势度和均匀度, 将3个指数结合可以反映土壤微生物群落的功能多样性[22]。本研究中, 铅处理显著降低了根际土壤微生物群落的均匀度。房君佳等[23]也发现, 水稻()田土壤中的铅锌尾矿砂通过抑制微生物生长, 造成水稻田土壤微生物群落结构简单。接种AM真菌显著增加了低浓度(200 mg·kg-1)和中浓度(400 mg·kg-1)铅处理下土壤微生物多样性的Shannon-Wiener多样性指数和Simpson优势度指数值。分析认为可能是由于接种AM真菌后, AM真菌使宿主植物根际土壤pH、根系分泌物等发生变化, 土壤pH的变化影响重金属铅的移动性和生物有效性, 而根系分泌物为根际微生物提供能源和光合产物。利用变性梯度凝胶电泳技术对生长在重金属污染土壤上的牧豆树()根际土壤细菌和菌根的小亚基RNA分析发现, 接种AM真菌可以改变牧豆树根际土壤微生物的群落结构, 增加细菌、AM真菌等的生物多样性[24]。Nogueira等[25]研究表明, 接种AM真菌能显著提高宿主植物根际土壤锰-氧化细菌数量, 抑制锰-还原细菌的生成, 导致对锰的还原能力降低, 减少植物对锰的吸收。
氮素是植物生长发育过程中必须的大量元素之一。周艳丽等[26]研究表明, 在重金属镉胁迫下, 水稻土壤溶液无机态氮含量显著下降。本研究结果表明, 接种AM真菌显著提高了高浓度铅处理下土壤微生物对氨基酸类底物的利用能力。刘涛等[27]研究表明, 硝化抑制剂氯甲基吡啶随尿素少量多次滴灌棉田后, 增加了土壤微生物的碳代谢强度、多样性指数及丰富度指数, 提高了土壤微生物对氨基酸及胺类的利用。可见, 接种AM真菌显著改变了根际土壤微生物群落结构, 影响土壤微生物对氮素的转化, 改善了土壤的微生态环境。
4 结论
铅胁迫下接种AM真菌对超富集植物龙葵根际土壤微生物的影响随Pb4+浓度的不同而发生变化。在中浓度(400 mg·kg-1)Pb4+处理下, 接种AM真菌能提高土壤微生物的AWCD值和对四大类碳源底物利用能力, 显著增加了土壤微生物多样性指数——丰富度指数、Shannon-Wiener多样性指数和Simpson优势度指数。糖类及其衍生物和代谢产物类碳源为不同处理下微生物功能多样性表现差异的敏感碳源。
[1] 张敏, 郜春花, 李建华, 等. 重金属污染土壤生物修复技术研究现状及发展方向[J]. 山西农业科学, 2017, 45(4): 674–676 ZHANG M, GAO C H, LI J H, et al. Research status and development direction of bioremediation technique on heavy metal contaminated soil[J]. Journal of Shanxi Agricultural Sciences, 2017, 45(4): 674–676
[2] 朱剑飞, 李铭红, 谢佩君, 等. 紫花苜蓿、黑麦草和狼尾草对Cu、Pb复合污染土壤修复能力的研究[J]. 中国生态农业学报, 2018, 26(2): 303–313 ZHU J F, LI M H, XIE P J, et al. Phytoremediation of single and combined pollution of Cu and Pb by,, and[J]. Chinese Journal of Eco-Agriculture, 2018, 26(2): 303–313
[3] ALI H, KHAN E, SAJAD M A. Phytoremediation of heavy metals — Concepts and applications[J]. Chemosphere, 2013, 91(7): 869–881
[4] RAJKUMAR M, SANDHYA S, PRASAD M N V, et al. Perspectives of plant-associated microbes in heavy metal phytoremediation[J]. Biotechnology Advances, 2012, 30(6): 1562–1574
[5] SCHWARZOTT D, WALKER C, SCHÜßLER A., the largest genus of the arbuscular mycorrhizal fungi (Glomales), is nonmonophyletic[J]. Molecular Phylogenetics and Evolution, 2001, 21(2): 190–197
[6] 孙吉庆, 刘润进, 李敏. 丛枝菌根真菌提高植物抗逆性的效应及其机制研究进展[J]. 植物生理学报, 2012, 48(9): 845–852 SUN J Q, LIU R J, LI M. Advances in the study of increasing plant stress resistance and mechanisms by arbuscular mycorrhizal fungi[J]. Plant Physiology Journal, 2012, 48(9): 845–852
[7] DE ANDRADE S A L, DA SILVEIRA A P D. Mycorrhiza influence on maize development under Cd stress and P supply[J]. Brazilian Journal of Plant Physiology, 2008, 20(1): 39–50
[8] 申鸿, 刘于, 李晓林, 等. 丛枝菌根真菌()对铜污染土壤生物修复机理初探[J]. 植物营养与肥料学报, 2005, 11(2): 199–204 SHEN H, LIU Y, LI X L, et al. Influence of arbuscular mycorrhizal fungus () on maize seedlings grown in copper contaminated soil[J]. Plant Nutrition and Fertilizer Science, 2005, 11(2): 199–204
[9] MEIER S, BORIE F, BOLAN N, et al. Phytoremediation of metal-polluted soils by arbuscular mycorrhizal fungi[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(7): 741–775
[10] 刘灵芝, 张玉龙, 李培军, 等. 铅锌矿区分离丛枝菌根真菌对万寿菊生长与吸镉的影响[J]. 土壤学报, 2012, 49(1): 43–49 LIU L Z, ZHANG Y L, LI P J, et al. Effect of arbuscular mycorrhizal fungi isolated from mining area on growth and Cd uptake ofL.[J]. Acta Pedologica Sinica, 2012, 49(1): 43–49
[11] 李霞, 彭霞薇, 伍松林, 等. 丛枝菌根对翅荚木生长及吸收累积重金属的影响[J]. 环境科学, 2014, 35(8): 3142–3148 LI X, PENG X W, WU S L, et al. Effect of arbuscular mycorrhizae on growth, heavy metal uptake and accumulation ofChun seedlings[J]. Environmental Science, 2014, 35(8): 3142–3148
[12] 祖艳群, 卢鑫, 湛方栋, 等. 丛枝菌根真菌在土壤重金属污染植物修复中的作用及机理研究进展[J]. 植物生理学报, 2015, 51(10): 1538–1548 ZU Y Q, LU X, ZHAN F D, et al. A review on roles and mechanisms of arbuscular mycorrhizal fungi in phytoremediation of heavy metals-polluted soils[J]. Plant Physiology Journal, 2015, 51(10): 1538–1548
[13] 谢桂英, 游秀峰, 孙淑君, 等. 龙葵种子休眠解除方法研究[J]. 杂草科学, 2013, 31(1): 37–39 XIE G Y, YOU X F, SUN S J, et al. A dormancy breaking technique forLseeds[J]. Weed Science, 2013, 31(1): 37–39
[14] O'DONNELL A G, SEASMAN M, MACRAE A, et al. Plants and fertilisers as drivers of change in microbial community structure and function in soils[J]. Plant and Soil, 2001, 232(1/2): 135–145
[15] ABAYE D A, LAWLOR K, HIRSCH P R, et al. Changes in the microbial community of an arable soil caused by long-term metal contamination[J]. European Journal of Soil Science, 2005, 56(1): 93–102
[16] GARLAND J L. Analysis and interpretation of community-level physiological profiles in microbial ecology[J]. FEMS Microbiology Ecology, 1997, 24(4): 289–300
[17] KONOPKA A, OLIVER L, TURCO JR R F. The use of carbon substrate utilization patterns in environmental and ecological microbiology[J]. Microbial Ecology, 1998, 35(2): 103–115
[18] 廖敏, 陈雪花, 陈承利, 等. 土壤-青菜系统中铅污染对土壤微生物活性及多样性的影响[J]. 环境科学学报, 2007, 27(2): 220–227 LIAO M, CHEN X H, CHEN C L, et alThe influence of lead contamination on soil-microbial activity and community structure diversity in a soil-greengrocery system[J]. Acta Scientiae Circumstantiae, 2007, 27(2): 220–227
[19] GADKAR V, RILLIG M C. The arbuscular mycorrhizal fungal protein glomalin is a putative homolog of heat shock protein 60[J]. FEMS Microbiology Letters, 2006, 263(1): 93–101
[20] 陈卫莉, 赵晓改, 王浩, 等. Pb胁迫下接种丛枝菌根真菌对茶树解毒能力的影响[J]. 河南科学, 2014, 32(4): 511–515 CHEN W L, ZHAO X G, WANG H, et al. Effects of arbuscular mycorrhizal fungi (AMF) inoculation on detoxification capacity of tea tree under Pb stress[J]. Henan Science, 2014, 32(4): 511–515
[21] VODNIK D, GRČMAN H, MACĚK I, et al. The contribution of glomalin-related soil protein to Pb and Zn sequestration in polluted soil[J]. Science of the Total Environment, 2008, 392(1): 130–136
[22] STARK S, STRÖMMER R, TUOMI J. Reindeer grazing and soil microbial processes in two suboceanic and two subcontinental tundra heaths[J]. Oikos, 2002, 97(1): 69–78
[23] 房君佳, 李强, 刘畅, 等. 铅锌尾矿砂污染下的岩溶土壤微生物群落碳源代谢特征[J]. 环境科学, 2018, 39(5): 2420–2430 FANG J J, LI Q, LIU C, et al. Carbon metabolism characteristics of the karst soil microbial community for Pb-Zn mine tailings[J]. Environmental Science, 2018, 39(5): 2420–2430
[24] SOLÍS-DOMÍNGUEZ F A, VALENTÍN-VARGAS A, CHOROVER J, et al. Effect of arbuscular mycorrhizal fungi on plant biomass and the rhizosphere microbial community structure of mesquite grown in acidic lead/zinc mine tailings[J]. Science of the Total Environment, 2011, 409(6): 1009–1016
[25] NOGUEIRA M A, MAGALHAES G C, CARDOSO E J B N. Manganese toxicity in mycorrhizal and phosphorus-fertilized soybean plants[J]. Journal of Plant Nutrition, 2004, 27(1): 141–156
[26] 周艳丽, 吴亮, 龙光强, 等. 镉污染下不同类型水稻土氮素供应特征及其影响因素[J]. 土壤, 2013, 45(5): 821–829ZHOU Y L, WU L, LONG G Q, et al. Characteristics and determinants for nitrogen supply of different types of paddy soils under spiked-cadmium conditions[J]. Soils, 2013, 45(5): 821–829
[27] 刘涛, 梁永超, 褚贵新. 氯甲基吡啶对滴灌棉田土壤微生物群落功能多样性的影响[J]. 中国生态农业学报, 2017, 25(7): 968–974 LIU T, LIANG Y C, CHU G X. Effect of nitrapyrin on functional diversity of soil microbial community in drip-fertigated cotton field[J]. Chinese Journal of Eco-Agriculture, 2017, 25(7): 968–974
Effect of arbuscular mycorrhizal fungi on metabolic characteristics of microbial community inrhizosphere soil with lead stress*
HAN Juan, ZHANG Xiangqian, ZHAO Jinli**
(College of Life Sciences, Hebei University, Baoding 071002, China)
Pot experiments were conducted to explore the effect of arbuscular mycorrhiza (AM) fungi on the characteristics and differences in rhizosphere soils ofunder different levels of lead stress [0 mg∙kg-1(CK), 200 mg∙kg-1, 400 mg∙kg-1, 800 mg∙kg-1). To this end,was inoculated withand, and the resulting rhizosphere soils collected after 10 weeks of growth under 16 h/8 h, 28 ℃/20 ℃with 12 000 Lux light intensity in a greenhouse. The characteristics and differences in carbon metabolic profiles of microbes were evaluated using the Biolog-ECO micro-plate method. The results showed that: 1) the average metabolic activity of microorganisms, described by average well color development (AWCD), decreased-increased-decreased with increasing lead stress. Inoculation with AM fungi improved AWCD significantly under lead stresses, except for 400 mg·kg-1Pb4+. 2) The ability of soil microbes to utilize the four types of carbon substrates (carbohydrate and derivatives, fatty acid and lipids, amino acids, and metabolites) was higher under 400 mg·kg-1Pb4+than under low (200 mg·kg-1) and high (800 mg·kg-1) stresses of Pb4+. Inoculation with AM fungi significantly improved the ability of soil microbes to utilize amino acid substrates under high lead concentration. 3) Lead stress reduced McIntosh evenness index of rhizosphere soil microbial community, but had no significant impact on richness index, Shannon-Wiener diversity index and Simpson index. Inoculation with AM fungi increased microbial diversity index under lead treatment, and had significant effects on Species richness index, Shannon-Wiener diversity index and Simpson dominance index at medium stress. 4) Under the same Pb4+stress, inoculation of AM fungi enhanced metabolic capacity of soil microorganisms for the four major carbon sources, but only had significant effect on amino acids. Principal component analysis showed that metabolites were the most abundant in PC1 and PC2, with respective values of 6 and 4. Sugar was the most abundant in PC3. 5) Under combined effects of lead stress and AM fungi, microbial carbon source utilization was mainly regulated by lead concentration, both had significant interaction effects on microbial carbon source utilization. In conclusion, inoculation with AM fungi increased microbial diversity index of rhizosphere soils ofunder lead stress, and enhanced utilization of carbon source substrate by rhizosphere soil microbes. This study provided theoretical basis for the application of AM fungi which could strengthen the use of phytoremediation technology in soil remediation for heavy metal pollution.
AM fungi;; Lead stress; Rhizosphere soil; Microbial metabolism characteristic; Biolog-ECO
, E-mail: plant@hbu.edu.cn
Nov. 29, 2018;
Dec. 5, 2018
10.13930/j.cnki.cjea.181036
S154.3
A
2096-6237(2019)04-0545-09
赵金莉, 主要从事土壤生态学方面的研究。E-mail: plant@hbu.edu.cn
韩娟, 主要从事菌根生物技术方面的研究。E-mail: junhan_hbu@126.com
2018-11-29
2018-12-05
* The study was supported by the Natural Science Foundation of Hebei Province (C2017201044) and the Student Innovation Training Project of Hebei University (2017126).
* 河北省自然科学基金项目(C2017201044)和河北大学大学生创新训练项目(2017126)资助
韩娟, 张向前, 赵金莉. 铅胁迫下接种AM真菌对龙葵根际土壤微生物群落代谢特征的影响[J]. 中国生态农业学报(中英文), 2019, 27(4): 545-553
HAN J, ZHANG X Q, ZHAO J L. Effect of arbuscular mycorrhizal fungi on metabolic characteristics of microbial community inrhizosphere soil with lead stress[J]. Chinese Journal of Eco-Agriculture, 2019, 27(4): 545-553
