蜜桔果酒用非酿酒酵母的分离鉴定、 发酵特性及挥发性香气成分分析
2019-04-12,,,,,,*,,,
,,, ,,,*, ,,
(1.江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西南昌 330022; 2.江西科技师范大学生命科学学院,江西省生物加工过程重点实验室,江西南昌 330013; 3.江西博君生态农业开发有限公司,江西抚州 344700)
对于果酒酿造而言,菌种的选择决定着果酒的质量。果酒酵母通常分为酿酒酵母(Saccharomycescerevisiae)和非酿酒酵母(non-Saccharomycescerevisiae)[6]。通常,酿酒酵母有较好的产酒精能力,但产香能力相对较弱;非酿酒酵母产香能力相对较强,能够生成多种芳香类物质,对果酒风味有积极的影响[7]。因此,选择优良的果酒酵母已不只局限于酿酒酵母,还包括相关环境中的一些非酿酒酵母。陈清婵等[8]从柑橘果实上分离得到优良的产香酵母JZ-3,该菌株发酵得到的橘子酒酒体丰满、香气浓郁、典型性强,整体品质较高。剧柠等[9]从枸杞果园土壤、鲜果及自然发酵液中,筛选到适宜枸杞果酒发酵的葡萄汁有孢汉逊酵母GF-60,与商用酿酒酵母混合发酵得到的葡萄酒含有更多种类的香气成分。Lu Y等[10]研究发现,戴尔凯氏有孢圆酵母(Torulasporadelbrueckii)和耐热克鲁维酵母(Kluyveromycesthermotolerans)发酵的榴莲酒中高级醇和乙基酯含量更高,酒风味更浓厚,口感更丰富。
目前,蜜桔果酒使用的酵母多为葡萄酒酵母或果酒干酵母,专用酵母菌的研究很少,缺乏适用的酵母菌株,导致蜜桔果酒存在风味不突出、风味欠佳的缺陷,影响了蜜桔果酒的品质及销量。因此,寻找适合南丰蜜桔果酒的专用酵母菌种是很有必要的。本实验在南丰蜜桔自然发酵的过程中分离出非酿酒酵母菌,通过26S rDNA序列分析进行菌种鉴定,并对其发酵性能及挥发性香气成分进行研究,以期筛选出适用蜜桔果酒的非酿酒酵母菌,为进一步混合菌种发酵改善蜜桔果酒风味提供研究基础。
1 材料与方法
1.1 材料与仪器
南丰蜜桔 采摘自江西省南丰县;高活性干酵母:安琪酵母(果酒专用) 江西博君生态农业开发有限公司;培养基:YPD固体(与液体)培养基 灭菌条件为115 ℃,30 min;苯酚、浓硫酸、重铬酸钾、硫酸铵 国药集团化学试剂有限公司。
PHX-280H生化培养箱 宁波莱福科技有限公司;HH-6数显恒温水浴锅 国华电器有限公司;PB-10 pH计 赛多利斯科学仪器有限公司;UV755B可见紫外分光光度计 上海分析仪器总厂;CP114电子天平 美国奥豪斯仪器;TG16-WS台式高速离心机 上海卢湘仪离心机仪器有限公司;PCR仪、凝胶成像仪 伯乐生命医学有限公司;XW-80A漩涡混合器 上海驰唐电子有限公司;7000C气相色谱串联质谱联用仪 安捷伦公司。
1.2 实验方法
1.2.1 酵母菌的分离、筛选 将新鲜的蜜桔带皮榨汁,放入灭菌的三角瓶中于 28 ℃自然发酵9 d,将发酵过程中发酵前期(0~1 d)、发酵中期(2~4 d)、发酵后期(5~9 d)的发酵醪分别稀释到10-2、10-3、10-4和10-54个稀释度。每个稀释度取0.2 mL涂布于YPD培养基上,每个稀释度设3个重复,在28 ℃条件下培养3 d。典型的酵母菌菌落表面光滑、湿润、黏稠,质地柔软,易挑起,多为乳白或奶油色,有酒香味[11]。根据此特征选取有典型酵母形态,挑选单菌落于YPD培养基上划线培养纯化,28 ℃培养2 d,4 ℃保藏。
将分离菌株划线接种于YPD平板上,28 ℃培养3 d,通过嗅闻法[12]初步判断是否有酯香或醇香,筛选具有较浓酯香气或特殊果香气的菌株,进行4 ℃斜面保藏。
大家好!我是光彩希望小学六年级一班的蔡新奥。因为我常年戴着一副黑框眼镜,加上一般的问题都难不住我,同学们都喜欢称我“小博士”。我爱好广泛,喜欢看书、写作文。
1.2.2 菌株鉴定 采用试剂盒提取的方法(E.Z.N.A. TM Yeast DNA Kit)提取纯培养目标菌株的基因组DNA。以引物NL1、NL4扩增其26S rDNA D1/D2基因区。NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′,NL4:5′-GGTCCGTGTTTCAAGACGG-3′。采用40 μL反应体系进行PCR扩增,反应体系为:Premix rTaq 20 μL、NL1 2 μL、NL4 2 μL、DNA 1 μL、dd H2O 15 μL。扩增条件:95 ℃预变性2 min,然后95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共29次循环,最后72 ℃充分延伸5 min,4 ℃保存。PCR产物检测:取5 μL的 PCR产物,在1.0%琼脂糖凝胶电泳中分离,电泳仪条件为100 V、30 min。用凝胶成像系统进行分析,将含有目标片段的产物送基因公司测序,测序结果在NCBI上进行BLAST比对。
1.2.3 酵母菌发酵性能的测定 挑选光滑、糖分含量高、香气浓、充分成熟、汁液丰富、无霉烂的蜜桔果,剥皮、榨汁、过滤。调整糖浓度为200 g/L,可滴定酸为1.05 g/L,pH为4.0,加入硫酸铵至终浓度为0.5 g/L。将蜜桔汁分装于250 mL的三角瓶中,每瓶装量200 mL,100 ℃灭菌20 min。
在无菌条件下,将产香酵母与商业酿酒酵母(S.cerevisiae)活化后,以5%的接种量分别接入蜜桔果汁中,装液量为200 mL(250 mL三角瓶),28 ℃,静置发酵10 d。取发酵的果酒上清液测定乙醇体积分数、残糖含量、总酸含量及pH。
采用分光光度计法[12]测定发酵液中乙醇体积分数;参考GB/T 15038-2006葡萄酒、果酒通用分析方法[13]测定果酒中总糖和滴定酸含量;pH采用pH计法测定。
1.2.4 感官评价 由10位品酒员组成品评小组(包括老师和学生),对蜜桔果酒的色泽、香气、滋味三个方面进行评价,结果取平均值[14],蜜桔果酒感官评定指标见表1。

表1 蜜桔果酒的感官评分标准Table 1 The scoring for sensory evaluation of tangerine wine
1.2.5 果酒中香气物质的测定
1.2.5.1 样品前处理 采用气相色谱串联质谱联用仪分析发酵后蜜桔果酒的香气成分。取5 mL蜜桔果酒样品于20 mL顶空瓶中,顶空瓶温度为80 ℃,保留20 min进行GC-MS分析。
1.2.5.2 GC/MS条件 GC条件:毛细管柱为DB-FFAP(30 m×320 μm×0.25 μm),载气为高纯氦气,流速1 mL/min,分流进样,分流比为10∶1。程序升温:初始温度40 ℃,保留2 min,以5 ℃/min的速率升至180 ℃,保留2 min,再以8 ℃/min的速率升至230 ℃,保留5 min;检测器温度250 ℃。MS条件:四级杆温度150 ℃;离子源温度230 ℃;接口温度180 ℃;电子电离源;电子能量70 eV;质量扫描范围30~500 amu。
1.2.5.3 定性与定量方法 GC-MS数据采集得到的总离子流中各质谱图运用NIST 14.L标准谱库检索,化合物用质谱库检索匹配度最高的结果定性,即为MS法;物质定量用峰面积归一化法。
1.3 数据处理
运用SPSS 20.0对不同酵母发酵的蜜桔果酒各个指标进行显著性差异分析,应用Origin2016进行作图,应用Matlab对不同酵母发酵的蜜桔果酒的挥发性物质进行主成分分析。
2 结果与分析
2.1 酵母菌的分离鉴定结果
从蜜桔果酒样品中共分离到24株酵母菌,其中发酵前期7株,发酵中期14株,发酵后期3株。通过嗅闻法筛选后得到7株酵母菌,对其进行26S rDNA基因序列测定,结果见表2。根据菌落形态、显微形态特征以及序列对比结果分析,一共鉴定为7种非酿酒酵母,分别为Pichiafermentans(MF979231)、Pichiaaff.fermentans(MF979211)、Pichiakluyveri(MF979216)、Hanseniasporaguilliermondii(MF979212)、Hanseniasporaopuntiae(MF979223)、Hanseniasporathailandica(MF979224)、Candidaethanolica(MF979225)。图1为7种酵母菌的PCR产物电泳图,扩增的产物在600~900 bp之间。

表2 酵母菌26S rDNA D1/D2 区序列比对结果Table 2 Blast results of 26S rDNA sequences of the yeast

图1 酵母菌26S rDNA PCR产物电泳图Fig.1 Electrophoretograms of 26S rDNA PCR amplificons of yeasts
2.2 酵母菌发酵能力测定结果
对分离到的酵母菌及商业酿酒酵母(S.cerevisiae)进行单菌发酵蜜桔果酒,对发酵10 d后果酒的残糖含量和乙醇体积分数进行测定,结果如图2。C.ethanolica和商业酿酒酵母(S.cerevisiae)能够将蜜桔汁中的糖几乎完全消耗,发酵的蜜桔酒中的残糖含量分别为1.2、1.3 g/L,H.thailandica和H.guilliermondii发酵后的蜜桔酒残糖含量分别为11.8、16.6 g/L,而P.fermentans、P. aff.fermentans、P.kluyveri和H.opuntiae发酵蜜桔果酒还有20 g/L以上的残糖。

图2 不同酵母菌对蜜桔果酒残糖含量 及乙醇体积分数的影响Fig.2 The effects of yeast species on residual sugar and ethanol in tangerine wine注:不同字母表示差异显著(p<0.05)。
果酒酿造过程中,糖主要为酵母生长提供其所需的能量及发酵生成酒精,不同酵母菌转化乙醇的能力不同。图1中,C.ethanolica和商业酿酒酵母(S.cerevisiae)能将蜜桔汁中的糖完全利用,部分糖被转化为酒精,发酵结束后果酒的乙醇体积分数分别为8.9%和9.4%。H.thailandica发酵后的蜜桔酒乙醇体积分数为6.7%,P. aff.fermentans和H.guilliermondii发酵后的果酒乙醇体积分数较低,分别为6.0%和6.3%。
2.3 蜜桔果酒总酸、pH及感官评价
不同酵母菌发酵蜜桔酒的总酸、pH及感官评价如表3。不同酵母菌发酵蜜桔酒总酸不同,商业酿酒酵母(S.cerevisiae)发酵的蜜桔酒总酸含量为0.88%;H.opuntiae发酵的果酒总酸含量较高,总酸含量为0.98%;P.aff.fermentans发酵果酒的总酸含量只有0.69%;其他菌株发酵的果酒总酸含量在0.75%~0.89%之间,发酵蜜桔酒的pH在3.55~3.75之间。由感官品评分析得出,H.thailandica的感官品评得分最高,具有较好的口感。

表3 不同酵母菌发酵蜜桔果酒的总酸、pH、及感官评价Table 3 Total acid,pH,and sensory evaluation of tangerine wine by different yeasts
2.4 蜜桔果酒挥发性香气成分分析
由表4可知,8种酵母菌酿得的蜜桔原酒中主要香气组分共测得41种,主要包括醇类、酯类、酸类、酮类和烃类。其中有酯类物质20种,醇类物质7种,酸类物质4种,酮类物质3种,烃类物质7种。
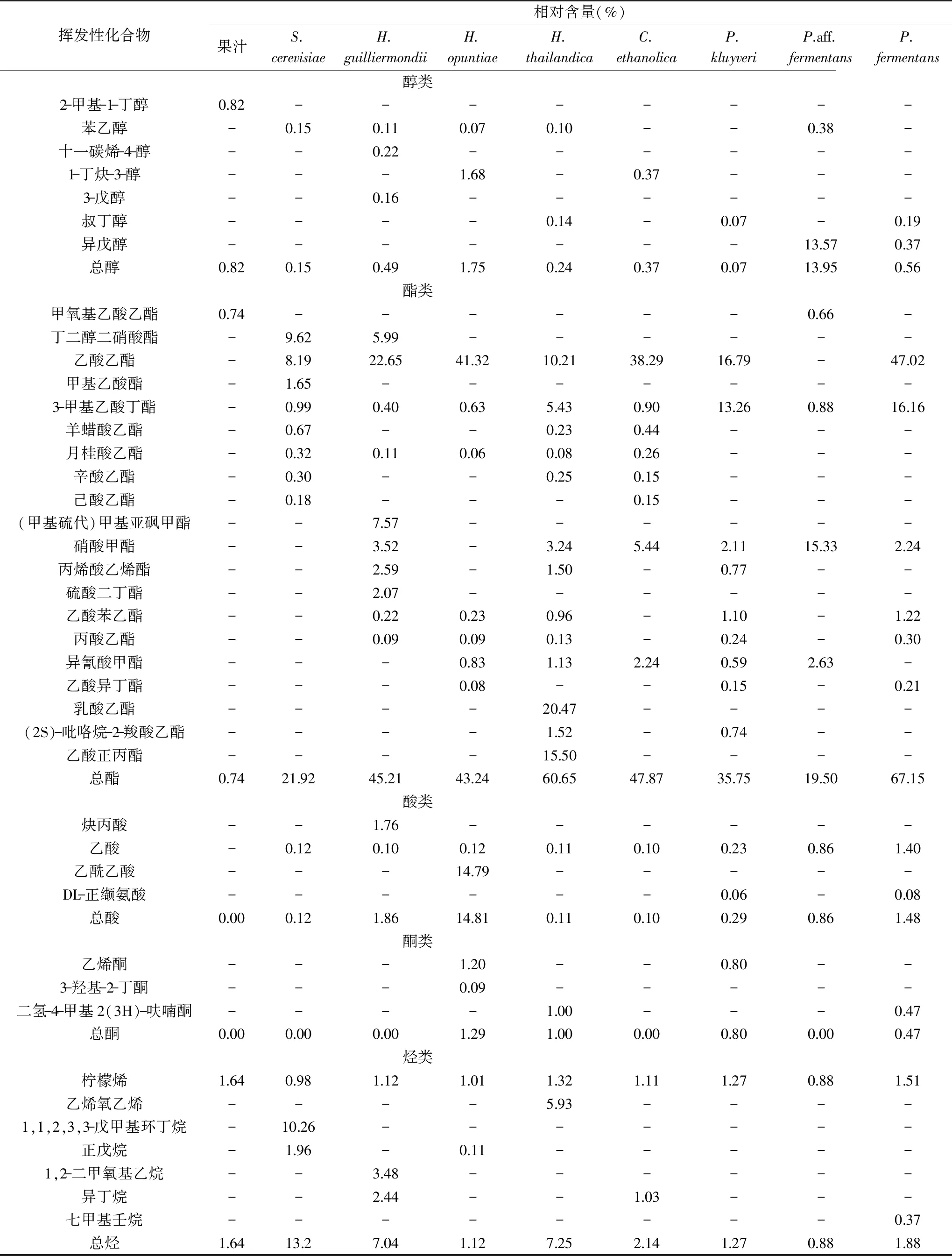
表4 不同酵母菌发酵蜜桔酒的挥发性香气成分分析Table 4 Analysis of volatile aroma components of fermented tangerine wine by different yeasts
发酵的蜜桔果酒中醇类物质有2-甲基-1-丁醇、苯乙醇、十一碳烯-4-醇、1-丁炔-3-醇、3-戊醇、叔丁醇、异戊醇。其中苯乙醇是柑橘中主要的醇类物质[2,16],是具有淡雅细腻玫瑰气味的芳香醇,在很低的浓度下就能产生很高的玫瑰香味,也是葡萄酒重要的呈香物质之一[17]。在发酵过程中,一些酵母菌能够通过莽草酸途径从头合成或通过氨基酸分解途径将L-苯丙氨酸转化为苯乙醇[18]。不同酵母发酵产生苯乙醇的含量也各不相同,P. aff.fermentans能够产生较多的苯乙醇。P. aff.fermentans发酵的蜜桔酒中含有大量的异戊醇,果酒中异戊醇含量过高时,会使果酒风味不正,并且对人体具有一定的毒害作用[19-20]。
酯类物质是果酒的主体香气成分,多数酯类物质都具有令人愉快的香气。在蜜桔酒中检测到的酯类物质有甲氧基乙酸乙酯、丁二醇二硝酸酯、乙酸乙酯、甲基乙酸酯、3-甲基乙酸丁酯、羊蜡酸乙酯、月桂酸乙酯、辛酸乙酯、己酸乙酯、(甲基硫代)甲基亚砜甲酯、硝酸甲酯、丙烯酸乙烯酯、硫酸二丁酯、乙酸苯乙酯、丙酸乙酯、异氰酸甲酯、乙酸异丁酯、乳酸乙酯、(2S)-吡咯烷-2-羧酸乙酯、乙酸正丙酯。商业酿酒酵母(S.cerevisiae)发酵的蜜桔酒酯类相对含量较少,总酯相对含量为21.92%,主要的酯类为丁二醇二硝酸酯和乙酸乙酯。P.fermentans和H.thailandica发酵的蜜桔酒产生较多的酯类物质,总酯相对含量分别为67.15%和60.65%。P.fermentans发酵的蜜桔酒中主要的酯类物质是乙酸乙酯和3-甲基乙酸丁酯;H.thailandica发酵的蜜桔酒中酯类物质较丰富,包括乙酸乙酯、3-甲基乙酸丁酯、羊蜡酸乙酯、月桂酸乙酯、辛酸乙酯、硝酸甲酯、丙烯酸乙烯酯、乙酸苯乙酯、丙酸乙酯、异氰酸甲酯、乳酸乙酯、(2S)-吡咯烷-2-羧酸乙酯和乙酸正丙酯。这些酯类对蜜桔果酒复杂香气做出了贡献,能够减弱尖酸味,协调苦涩味,令酒香醇厚。
酸类物质大多是发酵中的副产物,含量过多会使酒体口感偏酸,风味不足[21]。蜜桔酒中主要的挥发性酸类是乙酸,P.fermentans和H.guilliermondii发酵的蜜桔酒中有较高的挥发性酸。烷烃类化合物相对含量较低且烷烃香味阈值较高,对香气的直接贡献不大,但其可能是形成杂环化合物的重要中间体,有助于提高酒体的整体风味[9]。其中D-柠檬烯是大多数柑橘和蜜桔果酒中主要的挥发性成分[2,6],具有令人愉快的柠檬香气,并且它的药理活性较强,有显著的抗菌、镇咳、祛痰、平喘的作用。
综合考虑,H.thailandica是一株发酵蜜桔果酒产香能力较好的菌株,发酵的蜜桔酒能够产生丰富的酯类物质,产生较少的杂醇和挥发性酸,并且具有较好的感官评分。
2.5 不同酵母菌发酵的蜜桔果酒香气成分主成分分析
将不同酵母菌发酵的蜜桔酒通过HS-GC-MS测定的挥发性物质数据导入Matlab软件中进行PCA处理与分析,得到PCA得分图和载荷图(图3)。从结果可知,PC1、PC2和PC3的贡献率分别为23.1%、17.4%和14.6%。从图3A可以看出,不同酵母菌发酵的蜜桔酒之间区分度较好,没有重叠区域,说明不同酵母菌发酵蜜桔酒的香气成分具有显著差异性。通过PCA分析不仅能发现样品之间的异同,更为重要的是能够发现造成组间差异的具体变量,这些变量可以为深入研究组间差异,寻找特征指标等提供重要信息。挥发性香气成分的主成分分析载荷图,从图3B中可以看出,对PCA贡献较大的质谱信号(m/z),这些特征质谱峰可以有效区分不同蜜桔酒,这些特征物质包括羊蜡酸乙酯、月桂酸乙酯、辛酸乙酯、己酸乙酯、乙酸苯乙酯等。由此可见,通过对不同蜜桔果酒香气成分进行PCA分析,可以有效地了解不同酵母菌发酵蜜桔酒的差异性物质,为进一步研究提供了技术支持和理论基础。

图3 不同酵母菌发酵蜜桔酒的香气成分 主成分分析得分图(A)和载荷图(B)Fig.3 The score plots(A)and loading plots(B)of principal component analysis for aroma components of fermented tangerine wines by different yeasts注:B图为物质在PC1和PC2上的载荷图。
3 讨论与结论
目前,蜜桔果酒多为延用葡萄酒酵母或干酵母,缺少专用水果品种和专用果酒酿造酵母,导致蜜桔果酒品质不足。对于果酒酿造而言,菌种的选择决定着果酒的质量,对果酒的特色形成至关重要。
本实验从蜜桔果酒样品中共分离筛选出7株非酿酒酵母,分别为P.fermentans、P.aff.fermentans、P.kluyveri、H.guilliermondii、H.opuntiae、H.thailandica、C.ethanolica。这些非酿酒酵母菌属为汉逊酵母(Hanseniaspora)、毕赤酵母(Pichia)和假丝酵母(Candida)。Liu等[22]在椪柑酒的发酵过程中分离到了汉逊酵母、毕赤酵母、假丝酵母和孢圆酵母(Torulaspora)。同样,汉逊酵母和毕赤酵母也经常存在于葡萄及葡萄酒的发酵过程中[23-24]。
通常,商业酿酒酵母有较好的产酒精能力,但产香能力相对较弱[7],研究也发现,商业酿酒酵母(S.cerevisiae)有较好的发酵性能,但发酵的蜜桔酒酯类含量较少。本研究分离到的非酿酒酵母中,C.ethanolica有较好的发酵性能,能够将蜜桔汁中的糖几乎完全消耗,发酵后果酒残糖为1.2 g/L,乙醇体积分数为8.9%,并且较商业酿酒酵母发酵后的蜜桔酒有更丰富的香气成分和更好的感官评分。Hanseniaspora和Pichia对蜜桔汁中的糖不能完全利用,生成的乙醇量较少。Lee等[25]对发酵柑橘酒的12株酵母菌的发酵特性进行了研究,得到2株具有较高酒精含量(10.70%~11.86%),较低残糖量(0.64%~1.14%)的酵母菌。Clemente-Jimenez等[23]对葡萄自然发酵中的酵母菌进行分离鉴定并研究其发酵特性,其中Candidastellate和S.cerevisiae能将葡萄汁中糖完全利用,转化为较多的乙醇。
不同酵母菌发酵蜜桔果酒产生的香气成分具有显著差异。通过GC-MS对发酵的蜜桔果酒挥发性物质进行检测,发现酯类物质是构成蜜桔酒香气的主要成分。其中,H.thailandica是一株发酵蜜桔果酒产香能力较好的菌株,能够产生有较少的杂醇和挥发性酸和丰富的酯类物质,如乙酸乙酯、羊蜡酸乙酯、月桂酸乙酯、辛酸乙酯、乙酸苯乙酯、丙酸乙酯、乳酸乙酯等,能够减弱尖酸味,协调苦涩味,令酒香醇厚,并且具有较好的感官评价。一些研究者从葡萄以及葡萄酒中也分离出一些具有良好的产香性能的酵母菌,用其发酵的葡萄酒能产生丰富的酯类,更少的脂肪酸等[24,26]。其中乙酸乙酯有果味和甜味,是葡萄酒香气的重要构成成分[16]。乳酸乙酯和乙酸乙酯一样具有减弱尖酸味,协调苦涩味,令酒香醇厚等作用,它们都是反映果酒风味优劣的重要物质[21]。月桂酸乙酯有晚香玉香;乙酸苯乙酯有果香、栀子花香。辛酸乙酯具有玫瑰花香和橙子果香[26]。
本研究通过从蜜桔果酒发酵过程中分离筛选出的7株非酿酒酵母菌的发酵性能及产香气物质研究,得到1株发酵性能较好的酵母菌C.ethanolica和一株产香能力较好的菌株H.thailandica,为后期混合发酵蜜桔酒来完成具有更复杂香味的酒精发酵[25-27,30],进一步改善蜜桔果酒品质提供实验基础。
