可降胆固醇的优势乳杆菌筛选
2019-04-12,,,,,,,,*
,, , ,,, ,,*
(1.深圳市华大农业应用研究院,广东深圳 518083; 2.深圳华大生命科学研究院,广东深圳 518083)
近年来随着人们生活水平的不断提高以及饮食消费习惯的不断升级,中国的肥胖、高血糖、高血脂案例频繁发生。高含量的胆固醇摄入与心脑血管疾病密切相关,由于胆固醇摄入过多引起的心脑血管疾病逐渐受到专家学者的关注[1]。然而市面上常用的降胆固醇的药物具有一定的副作用,因此开发寻求一种降低血清胆固醇的天然物质具有十分重要的现实意义。
国内外研究表明,益生菌具有调节肠道菌群[2]、增强免疫力[3]、预防癌症[4]等作用。临床数据表明,益生菌具有降低人体血清胆固醇、预防心脑血管疾病等作用[5-7]。因此国内外研究降胆固醇益生菌成为热点,主要集中在降胆固醇益生菌的鉴定、降胆固醇机理、降胆固醇微生物制剂和降胆固醇保健食品的开发[6-8]。筛选并拥有高效降胆固醇的益生菌有着重大的意义。
为找到具有较好降胆固醇能力的优势菌株,本文研究了10株乳酸菌降胆固醇能力、胆盐水解酶(BSH)活力、α-葡萄糖苷酶抑制能力、细胞黏附性和抗生素敏感性等指标,筛选出具有较好的降胆固醇能力的优势菌株,为心脑血管疾病研究提供理论参考。
1 材料与方法
1.1 材料与仪器
10株分离菌株(表1) 实验室已保种鉴定;L.caseiATCC 334、植物乳杆菌299V 购自中国微生物菌种保藏管理委员会普通微生物中心;HT-29人结肠癌细胞 协和医科大学基础所细胞中心;MRS培养基 美国BD DIFCO;RPMI-1640培养液 美国Invitrogen;α-葡萄糖苷酶(≥100 U/mg)、4-硝基酚-α-D吡喃葡萄糖苷(PNPG)、 美国Sigma公司;胃蛋白酶(3000~3500 U/mg))生工生物工程(上海)股份有限公司;阿卡波糖 拜耳医药公司;庆大霉素、卡那霉素、链霉素、红霉素、克林霉素、氯霉素、氨苄青霉素、新霉素、甲氧苄啶、万古霉素 美国BBI;胆盐、巯基乙酸钠、胆固醇、甘氨酸等试剂 均为分析纯,生工生物工程(上海)股份有限公司。

表1 10株乳杆菌的分离来源Table 1 Sources of 10 different Lactobacillus
Bio-Tek Synergy 2多功能酶标仪 美国Biotek公司;LMQ.C-50E立式压力蒸汽灭菌器 山东新华医疗器械股份有限公司;5810R冷冻高速离心机 德国Eppendorf;SHP-080生化培养箱 上海精宏实验设备有限公司;DW-86L490超低温保存箱 青岛海尔股份有限公司。
1.2 实验方法
1.2.1 菌株活化 将10株菌分别从甘油保藏管中取出100 μL放入5 mL MRS液体培养基中37 ℃静置培养16~18 h进行菌株活化。后续菌株均用此活化菌液。
1.2.2 胆固醇降解率测定 无菌MRS培养基中加入过滤除菌的胆盐(30 mg/mL)、巯基乙酸钠(10%,w/v)、胆固醇(100 μg/mL)[9]。分别将10株菌活化并以1%接种量接种于该培养基中,37 ℃厌氧培养18 h后,离心(12000×g,4 ℃,10 min)取上清液,采用试剂盒法测定胆固醇含量[10],并根据公式(1)计算胆固醇降解率。
胆固醇降解率(%)=(m1-m2)/m1×100
式(1)
式中:m1、m2分别为发酵前、后上清液中胆固醇含量,μg。
1.2.3 BSH活力测定
1.2.3.1 标准曲线 采用茚三酮比色法[11]测定不同浓度甘氨酸溶液(0、1.0、2.0、3.0、4.0、5.0 mmol/L)在570 nm的吸光度,以绘制标准曲线。
1.2.3.2 BSH活力测定 参照文献[11]。分别将10株菌株发酵液离心(12000×g,4 ℃,3 min)收集菌体后,用0.1 mol/L PBS(pH6.8)将菌体浓度调至1×109CFU/mL,取1 mL加入4 mL 5 mmol/L甘氨去氧胆酸钠(GDCA)缓冲液(pH6.8)中混匀,于37 ℃反应30 min后测定570 nm的吸光值。BSH酶活(U)定义为1 CFU/mL菌液经过1 min反应产生甘氨酸的物质的量(μmol)。
1.2.4α-葡萄糖苷酶抑制率测定α-葡萄糖苷酶活性测定方法参考文献[12]。分别将1.2.1中菌液以1%接种量接种于MRS液体培养基,37 ℃厌氧培养18 h,离心(12000×g,4 ℃,10 min)收集上清液,取25 μL上清液加入96孔酶标板,然后加入25 μLα-葡萄糖苷酶溶液(0.5 U/mL),37 ℃保温5 min,再加入75 μL 0.1 mol/L PBS(pH6.8)、37.5 μL 20 mmol/L PNPG 溶液,反应25 min后加入100 μL 0.1 mol/L Na2CO3溶液终止反应,并在405 nm下测定吸光值。以0.8 mg/mL阿卡波糖作为阳性对照,并根据公式(2)计算α-葡萄糖苷酶抑制率。
α-葡萄糖苷酶抑制率(%)=[1-(C-D)/(A-B)]×100
式(2)
式中:A:含酶但样品替换为0.1 mol/L PBS(pH6.8)的吸光值;B:酶与样品均替换为0.1 mol/L PBS(pH6.8)的吸光值;C:含酶含样品的吸光值;D:含样品但酶替换为0.1 mol/L PBS(pH6.8)的吸光值。
1.2.5 酸耐受性试验 参考文献[13],分别配制pH2.0和pH3.0的人工胃液(胃蛋白酶3.2 g,NaCl 2.0 g,HCl调pH),0.45 μm薄膜滤器过滤除菌后对其进行37 ℃预热操作。取1 mL 1.2.1中菌液进行离心(5000×g,4 ℃,10 min)收集菌体,加入1 mL人工胃液,37 ℃下共培养0、2 h后分别测定两种酸度人工胃液处理后活菌数,根据公式(3)计算菌株的存活率。
菌株的存活率(%)=活菌数(2 h)/活菌数(0 h)×100
式(3)
1.2.6 胆盐耐受性试验 正常人体小肠中胆汁酸含量约0.3%~0.5%,并且乳酸菌对胆固醇的吸收也依赖于胆酸盐的存在[14]。食物经咀嚼后依次进入人体胃、肠道;此试验体外模拟体内消化过程,研究菌株在胆盐溶液的存活情况。参照文献[15],0.45 μm薄膜滤器对pH3.0的人工胃液及0.3%的胆盐溶液除菌并进行37 ℃预热5 min。取1 mL 1.2.1中菌液离心(5000×g,4 ℃,10 min)并收集菌体,加入1 mL pH3.0的人工胃液,检测菌体与pH3.0的人工胃液37 ℃共培养0 h时的活菌数;菌体与pH3.0的人工胃液共培养2 h后离心(5000×g,4 ℃,10 min)取菌体,加入1 mL胆盐溶液,然后检测菌体与胆盐溶液37 ℃共培养3 h后的活菌数,根据公式(4)计算菌株的存活率。
菌株的存活率(%)=活菌数(3 h)/活菌数(0 h)×100
式(4)
1.2.7 黏附试验 定植和黏附是菌株发挥益生功能的前提;以HT-29人结肠癌细胞来近似模拟机体结肠细胞,研究不同益生菌对机体细胞的黏附能力。菌株对HT-29人结肠癌细胞的黏附试验[16-18]过程如下:向HT-29细胞中加入0.5 mL 0.25%胰酶溶液充分浸润,消化时间约为1~3 min,肉眼观察瓶壁半透明的细胞层,当见到出现细针孔空隙时,弃去胰酶溶液,并加入1 mL RPMI-1640培养液(含10%胎牛血清,1%双抗即青霉素和链霉素)终止消化;然后用不含双抗的RPMI-1640培养液稀释将细胞浓度调整至2×105cell/mL,随后取1 mL加入12孔板中,静置培养使其长成致密单层细胞。同时,将1.2.1中菌液用RPMI-1640培养液将菌液调至5×108CFU/mL,取1 mL菌液加入到12孔板中与细胞共孵育90 min,孵育结束后用pH7.4 PBS漂洗除去未黏附的细菌。继而用胰酶消化细胞,对黏附菌体进行显微镜观察。
1.2.8 抗生素敏感性试验 配制不同种类的10种抗生素溶液(2.56 mg/mL),各取50 μL抗生素母液添加于微孔样板孔中。将1.2.1中菌液用生理盐水将菌浓度调整至1×109CFU/mL,混匀,取50 μL菌液置于各抗生素孔,37 ℃培养48 h,分光光度计测定OD625[19-20]。以菌株L.caseiATCC 334为质控菌株,阴性对照组添加50 μL去离子水和50 μL MRS培养液,阳性对照组添加50 μL去离子水和50 μL待测菌株的MRS菌液。当检测值低于阴性对照组的2倍即视为停止生长。则此时的菌液浓度为该抗生素对实验菌株的最小抑菌浓度(MIC)。将实验室自主筛选的菌株分别与植物乳杆菌和卷曲乳杆菌的MIC安全临界值对比,当所筛菌株能够生长的最低抗生素浓度超过安全界值时,表明该菌株对此浓度的抗生素具有抗性,能正常生长,则该菌株不能被用于益生菌的开发,存在潜在的耐药性[21]。
1.3 数据处理
试验中涉及的样本数据均重复做三次数据,试验数据表示为平均值±标准差(Mean±SD)。采用SPSS 17.0软件对试验中涉及的数据进行显著性分析(p=0.05),用Microsoft Excel 2013对实验数据进行绘图。
2 结果与讨论
2.1 菌株降胆固醇能力测定
由图1可知,10株菌均具有一定的降胆固醇的能力,但不同乳杆菌菌株降胆固醇能力存在差异。除植物乳杆菌OF38-8 pH5和植物乳杆菌SD-H9外,其余8株菌对胆固醇的降解率均达到了30%以上。其中,植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-4对胆固醇的降解率均达到了50%以上,显著高于对照菌株植物乳杆菌299V(p<0.05)。植物乳杆菌OF44-5pH5、植物乳杆菌10-14和卷曲乳杆菌OF48-2pH5体外降胆固醇能力与对照菌株植物乳杆菌299V相比无显著差异(p>0.05)。
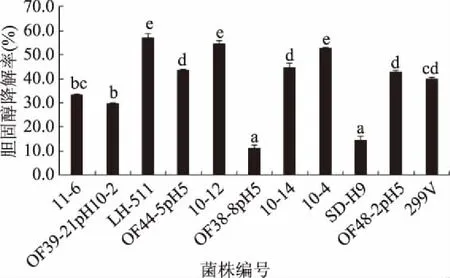
图1 菌株体外降解胆固醇能力Fig.1 Abilities of lowering-cholesterol from different strains in vitro注:不同字母表示差异显著,p<0.05;图2~图3,表2~表4同。
目前研究证明许多菌株都具有降胆固醇能力,但胆固醇的降解率存在差异。韦云路等[21]研究的三株益生菌的体外胆固醇降解率在23%左右。林斌等[22]证明从福建南平地区自然发酵的酸乳中分离得到的植物乳杆菌HLX37对胆固醇降解率达37.33%±2.55%。胡梦坤等[23]从泡菜中分离出来的植物乳杆菌LP1103对胆固醇降解率达42.5%。因此,本研究中降胆固醇能力最优的三株菌(植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-4)均高于目前报道的菌株,在体外胆固醇降解方面存在优势。
2.2 菌株BSH活力测定
具有BSH活力的菌株在体内能发挥更好的降胆固醇能力,因此BSH活力成为筛选具有降胆固醇能力的菌株的一个重要指标[24]。甘氨酸标准液浓度在0~5 mmol/L内绘制的标准曲线方程为y=0.2991x+0.0064,R2=0.9987。结果如图2所示,10株供试菌株均具有BSH活力,其中植物乳杆菌LH-511的BSH活力显著高于其余菌株(p<0.05),植物乳杆菌10-14、卷曲乳杆菌OF48-2pH5的BSH活力次之,且与对照菌株植物乳杆菌299V无显著性差异(p>0.05)。植物乳杆菌10-12、植物乳杆菌10-4、干酪乳杆菌11-6、戊糖乳杆菌OF39-21PH10-2、植物乳杆菌OF44-5PH5、植物乳杆菌OF38-8pH5和植物乳杆菌SD-H9的BSH活力相对较低,显著低于对照菌株植物乳杆菌299V(p<0.05)。

图2 菌株胆盐水解酶活力Fig.2 Activities of BSH from different strains
2.3 α-葡萄糖苷酶抑制率的测定
由图3结果可看出,10株供试菌株均表现出对α-葡萄糖苷酶的活性有抑制作用,并且抑制率均可达到30%以上。其中,植物乳杆菌10-12、植物乳杆菌10-14、植物乳杆菌SD-H9和卷曲乳杆菌OF48-2pH5对α-葡萄糖苷酶的抑制率显著高于阳性对照组阿卡波糖(p<0.05)。植物乳杆菌11-6、戊糖乳杆菌OF39-21pH10-2、植物乳杆菌LH-511、植物乳杆菌OF44-5pH5、植物乳杆菌OF38-8pH5、植物乳杆菌10-4对α-葡萄糖苷酶的抑制率则与阿卡波糖相比无显著性差异(p>0.05)。这与范文娅等[12]筛选的一株干酪乳杆菌对α-葡萄糖苷酶抑制率为37.36%相当,高于陈佩[25]筛选的干酪乳杆菌CCFM0412(29.41%)。
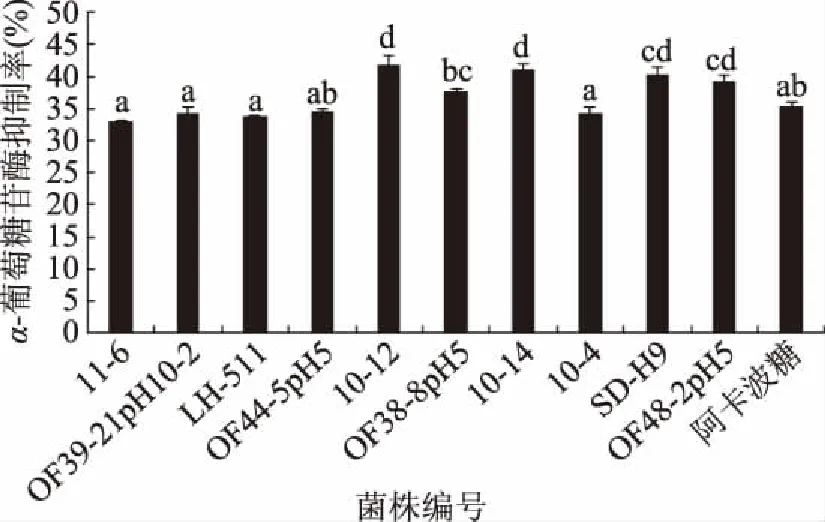
图3 菌株对α-葡萄糖苷酶活的抑制率Fig.3 Inhibitory rate of different strains to α-glucosidase
2.4 菌株对酸耐受能力的测定
益生菌在体内其益生作用必须要耐受胃中的酸性环境,因此本研究将供试菌株接种于pH2.0和pH3.0的酸性培养基中培养2 h以检测对胃酸的耐受性,结果如表2、表3所示。由表2可知,所有供试菌株在pH3.0条件下培养2 h活菌数仍维持在109CFU/mL,其存活率达到70%以上,说明10株供试菌株对pH3.0表现出较强的耐受性。其中,植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-4、干酪乳杆菌11-6在pH3.0条件下培养2 h后存活率较其余供试菌株存活率高,并与对照菌株植物乳杆菌299V耐酸能力相当。由表3可知,所有供试菌株在pH2.0环境下培养2 h后活菌数仍可达到106CFU/mL以上,其中植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-4的存活率较对照菌株植物乳杆菌299V高。结果表明,10株供试菌株在均可耐受pH2.0和pH3.0的酸性环境,能够通过耐受胃酸从而达到肠道中。这与靳志强等[14]的研究结果相近:植物乳杆菌H3可耐受pH2.0和pH3.0的酸性环境,并且培养2 h后活菌数维持在106CFU/mL左右。

表2 pH3.0时的活菌数及存活率统计Table 2 Statistics of bacteria colony counts and survival rate at pH3.0
2.5 菌株对胆盐耐受能力的测定
人体肠道中胆汁酸盐正常含量为0.3%~0.5%,因此通常以0.3%胆盐含量来衡量菌株耐受人体肠道胆汁酸的水平[13]。由表4可知,供试菌株在pH3.0条件下培养2 h转接于0.3%胆盐溶液培养3 h后存活率在0.59%~1.62%,活菌数有所下降,但均维持在107CFU/mL以上。其中,植物乳杆菌LH-511、植物乳杆菌10-14、植物乳杆菌10-4、卷曲乳杆菌OF48-2pH5和植物乳杆菌10-12的耐酸耐胆盐能力较其余供试菌株强,与对照菌株植物乳杆菌299V耐酸耐胆盐能力相近。这一结果与隋梦等[26]的研究结果相近,植物乳杆菌Zhang-LL利用0.3%胆盐培养3 h后活菌数维持在106~107CFU/mL。

表4 菌株在0.3%胆盐环境下的菌落计数及存活率统计Table 4 Statistics of bacteria colony counts and survival rate at 0.3% bile acid concentration
综合考虑BSH活力、α-葡萄糖苷酶抑制能力以及耐酸耐胆盐能力,认为植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-14、植物乳杆菌10-4和卷曲乳杆菌OF48-2pH5具有较好的应用潜力,因此选取此五株菌进行下一步的细胞黏附及抗生素试验。
2.6 菌株黏附HT-29细胞能力比较
乳酸菌定植并黏附于肠道上皮细胞是其发挥益生功能的先决条件[19]。由图4可知,植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-14、植物乳杆菌10-4和卷曲乳杆菌OF48-2pH5均具有黏附于HT-29细胞的能力,因此表明五株乳杆菌皆可定植于人体肠上皮细胞,进而起到降低机体胆固醇的作用。
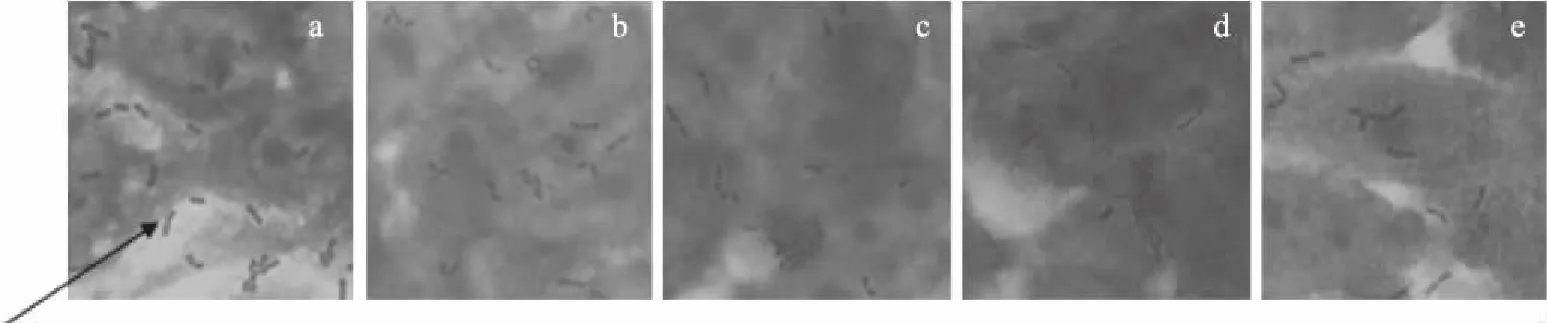
图4 菌株对HT-29细胞的黏附能力(1000×)Fig.4 Adhesion of bacteria to HT-29 cells(1000×)注:a、b、c、d、e、f分别代表植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-14、 植物乳杆菌10-4和卷曲乳杆菌OF48-2pH5对细胞黏附的状态图;箭头处指示菌株附着示意。
2.7 菌株抗生素敏感性试验
植物乳杆菌LH-511、植物乳杆菌10-12、植物乳杆菌10-14、植物乳杆菌10-4和卷曲乳杆菌OF48-2pH5对10种抗生素敏感性结果如表5所示。质控菌株L.caseiATCC 334对抗生素敏感性与报道数据吻合[27],因此该方法测定菌株抗生素敏感性结果可信。由表5可知,除植物乳杆菌10-12、10-14、10-4 对红霉素、克林霉素的敏感性超出了安全局规定的安全界限值范围外,其余菌株对10种抗生素的敏感性均在安全界限值内。综上可知,本研究筛选的植物乳杆菌LH-511和卷曲乳杆菌OF48-2pH5通过了菌株抗生素敏感性试验的安全性评价,可以作为有潜力的功能菌株进行深入挖掘及临床应用。

表5 不同菌株对10种抗生素的MIC值比较Table 5 Bacteria MIC values to 10 antibiotics
3 结论
本研究所筛选出2株具有降胆固醇功能的乳杆菌分别为植物乳杆菌LH-511和卷曲乳杆菌OF48-2pH5,其益生特性各有优劣。植物乳杆菌LH-511和卷曲乳杆菌OF48-2pH5体外降胆固醇能力较强,胆固醇降解率分别达到57.5%和41.9%;对α-葡萄糖苷酶也有较高的抑制率,分别达到33.8%和39.1%。另外,2株乳杆菌具有耐酸耐胆盐和黏附肠上皮细胞能力,且通过了抗生素敏感性安全评价,表明植物乳杆菌LH-511和卷曲乳杆菌OF48-2pH5能够很好地通过消化道的屏障作用而发挥降胆固醇和降血糖功能。本研究筛选到的2株乳杆菌下步将会进行动物实验以验证其降胆固醇和降血糖作用效果,以便于进一步对菌株进行开发和应用。
