不同提取方法对小麦麸皮多糖化学组分 及免疫调节活性的影响
2019-04-12,,,,,*,,*
, ,,, ,*,,*
(1.浙江农业商贸职业学院,浙江绍兴 312088; 2.淮阴师范学院,江苏省高校区域现代农业与环境保护协同创新中心,江苏淮安 223300)
小麦是重要的粮食作物,小麦麸皮由小麦的果皮、种皮层、糊粉层、少量胚和胚乳组成,是面粉加工过程中的主要副产品[1]。小麦麸皮中含有丰富的蛋白质、膳食纤维(多糖)、维生素、矿物质等营养成分[2]。小麦麸皮中的多糖主要由非淀粉多糖和淀粉多糖组成,非淀粉多糖含量占46%左右,是小麦细胞壁的主要成分[3]。小麦麸皮多糖具有抗衰老、提高免疫力、抗癌、降血脂降血压等功效[4]。因此,研究小麦麸皮多糖的高效提取对开发利用小麦麸皮资源具有重要的意义。
目前国内外关于多糖提取的报道,多集中于热浸水提、微波提取法、碱提取法、超声波提取法等[5]。研究发现,不同提取方法具有各自的优缺点,且对多糖的生物活性影响不同。传统热水浸提法以工艺简单、易于推广等特点为人们所接受[6];酶提法具有操作简便、条件温和、杂质易去除等优点[7];酸碱提取法具有可以降低多糖分子量、降低溶液粘度、提高其水溶性等优点。本文以淮麦33麸皮为原料,分别采用水提法、纤维素酶提取法、碱提法及酸提法提取小麦麸皮多糖,初探不同提取方法对小麦麸皮多糖的提取率、化学组分及生物活性等的影响,以期为小麦麸皮多糖的进一步研究与开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
小麦超微粉麸皮(淮麦33) 江苏省淮安农科院;氢氧化钠、乙醇、三氟乙酸 分析纯,国药集团;亚硝酸钠、甲氮甲唑蓝(MTT)、台盼蓝、葡萄糖(纯度≥99.5%)、半乳糖醛酸(纯度99%) Sigma公司;胎牛血清(FBS) HyClone公司;小鼠单核巨噬细胞系RAW264.7细胞 美国典型培养物保藏中心(ATCC);RPMI 1640培养基、双抗、青霉素、链霉素) Gibco公司;微量BCA蛋白定量试剂盒 北京康为世纪生物科技有限公司;Griess试剂盒北京康为世纪生物科技有限公司;盐酸 国药集团;乙醇 国药集团;二抗 Cell Signaling公司。
UV-8000紫外分光光度计 上海昂拉仪器有限公司;HH-8数显恒温水浴锅 江苏省金坛亿通电子有限公司;H1850R台式高速冷冻离心机 Eppendorf公司;Agilent7890A GC气相色谱仪 美国Agilent公司;M200 Tecan infinite PRO酶标仪 瑞士Tecan公司;MCO-15AC二氧化碳培养箱 日本SANYO公司;FEI Quanta 450FEG场发射扫描电子显微镜 美国FEI公司;ALPHA 1-2LDPLUS冷冻干燥机 德国CHRIST公司;JC-S12/24吹氮仪 南京荣华科学器材有限公司。
1.2 实验方法
1.2.1 小麦麸皮多糖的提取
1.2.1.1 酸法提取小麦麸皮多糖 称取10.00 g小麦超微粉麸皮,按1∶20 (m/V)料液比加入pH3.0的盐酸溶液,水浴加热50 ℃提取2 h,滤布过滤得上清液,滤渣按上述方法重复提取一次,合并滤液。用旋转蒸发仪将滤液浓缩至原体积的50%,加入4倍体积95%乙醇沉淀12 h,室温离心(6000 r/min 15 min)收集多糖沉淀,经冷冻干燥(-30 ℃18 h)得小麦麸皮粗多糖。
1.2.1.2 碱法提取麸皮多糖 称取10.00 g小麦超微粉麸皮,按1∶20 (m/V)料液比加入0.16 mol/L NaOH溶液,50 ℃水浴加热浸提2 h,滤布过滤得上清液,滤渣按上述方法重复提取一次,合并滤液。其余操作与1.2.1.1相同,得小麦麸皮粗多糖。
1.2.1.3 水法提取小麦麸皮多糖 称取10.00 g小麦超微粉麸皮,按1∶20 (m/V)料液比加入蒸馏水,水浴加热50 ℃下提取2 h,滤布过滤得上清液,滤渣按上述方法重复提取一次,合并滤液。其余操作与1.2.1.1相同,得小麦麸皮粗多糖。
1.2.1.4 酶法提取小麦麸皮多糖 称取10.00 g小麦超微粉麸皮,按1∶20 (m/V)料液比,加纤维素酶(酶活2000 U/g)0.75%(w/v),水浴加热50 ℃提取2 h,煮沸10 min灭酶。滤布过滤得上清液,其余操作同1.2.1.1,得小麦麸皮粗多糖。
1.2.2 多糖含量测定
1.2.2.1 标准曲线的绘制 准确称取105 ℃干燥至恒重的葡萄糖(纯度≥99.5%)10 mg,蒸馏水定容至10 mL容量瓶得标准液。将标准液稀释成质量浓度为50、100、150、200、250、300、350 μg/mL的工作液,吸取工作液0.2 mL,加入0.4 mL 5%苯酚,混合后迅速加2 mL浓硫酸,室温放置30 min,测定490 nm处吸光度,以蒸馏水做空白对照[8]。以葡萄糖浓度X(μg/mL)为横坐标,吸光度Y为纵坐标,制作标准曲线。计算标准曲线的回归方程:Y=0.002X-0.037(R2=0.994)。
1.2.2.2 粗多糖含量测定 准确称取50 mg 1.2.1.1~1.2.1.4中的粗多糖,蒸馏水定容至100 mL,吸取0.2 mL按标准曲线方法操作在490 nm测定吸光度。根据标准曲线计算多糖浓度,求得样品中的多糖含量,见式(1),粗多糖得率计算见式(2)。
多糖含量(%)=(V×C×f/M)×100
式(1)
其中:V:溶解粗多糖定容后的体积,mL;C:根据标准曲线得出多糖的浓度,g/mL;f:多糖的校正系数;M:称取的粗多糖质量,mg。
粗多糖得率(%)=粗多糖质量/原料质量×100
式(2)
1.2.3 小麦麸皮多糖糖醛酸含量测定
1.2.3.1 半乳糖醛酸标准曲线的绘制 称取半乳糖醛酸20 mg,蒸馏水溶解并定容至100 mL,制备成200 μg/mL的标准溶液。
分别取半乳糖醛酸标准溶液125、250、375、500、750、1000 μL置于2 mL具塞试管加水稀释至刻度,配制成浓度为12.5、25、37.5、50、75、100 μg/mL的标准液。移取400 μL半乳糖醛酸系列标准液分别在冰水浴加入2.4 mL四硼酸钠,沸水加热20 min,立即取出于冰上冷却,加入80 μL 0.15%的3-苯基苯酚溶液,室温下显色10 min,空白以蒸馏水替代,535 nm处测定吸光度[9]。以半乳糖醛酸浓度X(μg/mL)为横坐标,吸光度Y为纵坐标,绘制标准曲线,得到回归方程:Y=0.001X-0.009(R2=0.992)
1.2.3.2 样品测定 称取60 ℃干燥至恒重的小麦麸皮多糖25 mg,蒸馏水溶解并定容至100 mL,得浓度为250 μg/mL的样品溶液,其余操作如1.2.3.1,根据标准曲线的回归方程,测定半乳糖醛酸含量。

1.2.4.1 硫酸钾溶液标准曲线绘制 配制BaCl2-明胶溶液备用,称取0.50 g明胶加少量蒸馏水于60~90 ℃溶解,定容至100 mL 4 ℃保存过夜。称取0.50 g BaCl2用明胶溶液定容至50 mL,室温下放置2~3 h,4 ℃冰箱保存。
称取K2SO410 mg用蒸馏水溶解并定容至10 mL,分别移取0.2、0.6、1.0、1.4、1.8、2.0 mL K2SO4标准溶液于2 mL的具塞试管并加水至刻度,配制成浓度为0.1、0.3、0.5、0.7、0.9、1.0 mg/mL的K2SO4溶液。移取K2SO4标准溶液200(L于试管中,加3.8 mL 3%(w/v)的TCA溶液、1 mL BaCl2-明胶溶液,混合均匀,室温下放置15~20 min,空白以蒸馏水替代,测定360 nm处吸光度值[10]。以K2SO4浓度X(mg/mL)为横坐标,吸光度Y为纵坐标,制得标准曲线。所得标准曲线的回归方程为Y=1.775X+0.053(R2=0.993)

1.2.5 小麦麸皮多糖蛋白质含量的测定 按照BCA试剂盒说明书操作,测得标准曲线蛋白含量为Y=0.0129X-0.0144(R2=0.996),蛋白浓度测定范围为20~5000 g/mL。
小麦麸皮多糖溶解于蒸馏水中,配成250 μg/mL水溶液,采用BCA法在526 nm处测得吸光度,带入标准曲线得到蛋白质含量[11]。
1.2.6 单糖组分分析
1.2.6.1 单糖衍生物的制备 分别称取鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖10 mg置于具塞玻璃管中,加入盐酸羟胺10 mg,无水吡啶500 μL,90 ℃水浴加热30 min;取出后放置冰上迅速冷却至室温,加入500 μL醋酸酐,水浴加热90 ℃乙酰化反应30 min,反应完成后利用吹氮仪吹干,再加入1 mL三氯甲烷复溶。将各标准单糖衍生物混合,取1 μL混合液直接进行色谱分析[12]。
色谱条件:色谱柱:DM-5(30 m×0.25 mm,0.25 μm);柱温:从120 ℃以0.4 ℃/min升温至160 ℃,2 min后以0.1 ℃/min升温至162 ℃,再以3 ℃/min的速度升温至169 ℃,以0.2 ℃/min升温至171 ℃;N2作为载气;进样温度为235 ℃;进样方式:分流(分流比10∶1);检测器:FID为280 ℃(氮气体积流量30 mL/min,氢气体积流量30 mL/min,空气体积流量300 mL/min);进样量:1.0 μL。
1.2.6.2 小麦麸皮多糖的水解和衍生化 称取小麦麸皮多糖10 mg,加入4 mol/L 三氟乙酸溶液4 mL,混合均匀。100 ℃水解12 h,吹氮仪吹干备用。水解后的样品,按照单糖衍生物的制备方法进行衍生化处理,取1 μL样品进行气相色谱分析。
1.2.7 小麦麸皮残渣的微观形态观察 将不同提取液处理后的小麦麸皮残渣样品烘干,分别取样品适量,铺于电镜铜台上,喷金镀膜后置于扫描电子显微镜下观察。
1.2.8 细胞毒性的检测
1.2.8.1 细胞培养及传代方法 小鼠单核巨噬细胞系RAW264.7细胞,用含终浓度为10%胎牛血清、青霉素(100 μg/mL)及链霉素(100 μg/mL)的1640培养液培养并置于5% CO2、37 ℃细胞培养箱中。根据细胞生长情况约48 h换液1次。
传代方法:待细胞贴壁率达到80%左右后,用细胞刮将细胞刮下,加入5 mL的1640培养基,吹打分离细胞后进行传代培养,约3~4 d 传代1次,取12~25传代细胞用于后续实验。
1.2.8.2 细胞存活率实验 采用MTT法[13]检测样品对RAW264.7细胞毒性的影响。取细胞悬浮液稀释细胞数为1×106个/mL,以每孔100 μL接种于96孔培养板,培养16~18 h。向96孔板中加入不同提取方法所得小麦麸皮多糖(12.5、25、100、200 μg/mL)为实验组,未加小麦麸皮多糖的为空白组。每组设3个重复,于37 ℃、5% CO2培养箱中培养24 h,吸去上清,每孔加入100 μL MTT工作液,继续培养4 h,加入100 μL MTT终止液。待完全溶解后,用酶标仪在550 nm处测定OD值,实验重复3次,计算细胞的相对存活率。
细胞相对存活率(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100
1.2.8.3 不同提取方法小麦麸皮多糖对RAW264.7细胞释放一氧化氮(NO)的影响 取对数生长期细胞,调整细胞数为1×106个/mL,以每孔100 μL接种于96孔培养板,培养16 h。添加不同浓度小麦麸皮多糖溶液(0、12.5、25、50、100、200 μg/mL)处理细胞,24 h后采用Griess试剂盒法检测细胞上清液中NO的含量。
1.2.8.4 不同提取方法小麦麸皮多糖对RAW264.7细胞COX-2和iNOS蛋白表达的影响 取对数生长期的细胞,用细胞刮将细胞刮下,加入5 mL的1640培养基,吹打分离细胞后计数,用1640培养基调整细胞密度为5×105个/mL,按100 μL/孔接种于直径为40 mm的培养皿中,每个小培养皿接种5×105个细胞,置于37 ℃、5% CO2培养箱中,贴壁24 h后,吸弃孔内培养液,设置对照组和实验组(麸皮多糖100 μg/mL)每个浓度设3个复孔,在CO2培养箱中培养24 h后,收集细胞。加入RIPA裂解液及蛋白酶抑制剂提取总蛋白,BCA试剂盒法测定总蛋白浓度,建立30 μL的体系,95 ℃灭活蛋白5 min,蛋白样品经SDS-PAGE凝胶电泳后,半干转印至PVDF膜,用10 mL 1×TBS在洗膜10 min,加入3%的BSA洗膜1 h,再加入10 mL的TTBS继续洗膜3次,HRP标记的二抗于室温下孵育1 h,洗膜后加入辣根过氧化物酶试剂显色。分析不同提取方式获得的小麦麸皮多糖对RAW264.7细胞COX-2和iNOS蛋白表达的影响。
1.3 数据分析
实验数据使用SPASS 20.0进行Duncan法比较分析,p<0.05为差异显著,SigmaPlot绘制图表。
2 结果与分析
2.1 不同提取方法小麦麸皮多糖得率比较
如图1,四种提取方法对小麦麸皮多糖得率影响差异显著(p<0.05)。碱提法粗多糖得率为31.73%±1.60%,多糖含量为57.79%±0.60%(是水提法的1.7倍);酶提法粗多糖得率为14.47%±0.68%,多糖含量为49.2%±0.38%;酸提法和水提法粗多糖得率及多糖含量均较低。与张晓娜[14]的研究结果相似。小麦麸皮中的部分多糖与体系中的木质素、纤维素、蛋白质等组分间存在着许多以阿魏酸连接的共价酯键[15],形成水不溶性多糖。NaOH能够打断共价酯键的结合,有利于小麦麸皮多糖的溶出。小麦麸皮中酸性多糖含量较高,碱液能够使酸性多糖浸出,因此碱提法得到的多糖得率及含量最高[16]。

图1 不同提取方法对小麦麸皮多糖的 得率及多糖含量的比较Fig.1 Comparison of yield and content of polysaccharides from wheat bran by different extraction methods注:图中相同指标不同小写字母代表差异显著, p<0.05;图2~图3,图7同。
2.2 不同提取方法对小麦麸皮多糖糖醛酸、硫酸根含量的影响
图2中碱提取法所得小麦麸皮粗多糖的糖醛酸、硫酸根含量最高,为8.01%±0.08%、13.02%±0.07%;酶提取法的糖醛酸和硫酸根含量为6.19%±0.11%、9.91%±0.81%;酸提和水提法取糖醛酸及硫酸根含量较低。小麦麸皮半纤维素是由木糖、阿拉伯糖、葡萄糖、半乳糖及葡萄糖醛酸组成的异质木聚糖,葡萄糖醛酸及它的4-甲基醚存在于侧链的非还原末端。

图2 不同提取方法下小麦麸皮多糖的 糖醛酸及硫酸根含量比较Fig.2 Effects of different extraction methods on the contents of uronic acid and sulfuric acid of wheat bran polysaccharides
2.3 小麦麸皮多糖蛋白质含量的比较
图3可见不同提取方法得到粗多糖中蛋白质含量各不相同,酶提法得到粗多糖的蛋白质含量最高为22.74%±0.32%;碱提法粗多糖蛋白质含量为5.64%±0.78%;酸提和水提粗多糖中蛋白质含量分别为22.19%±0.64%和20.48%±1.46%,这一结果与周素梅等[17]一致。纤维素酶能酶解麸皮细胞壁并能将与多糖连接在一起的蛋白质游离出来;稀碱溶液只能使少量的碱溶性蛋白质游离出来,且部分蛋白质遇碱性溶液会降解成多肽或短肽类物质。因此,酶提法粗多糖中蛋白质含量最多,碱提法粗多糖中蛋白质含量最低,酸提和水提粗多糖蛋白质含量相当。
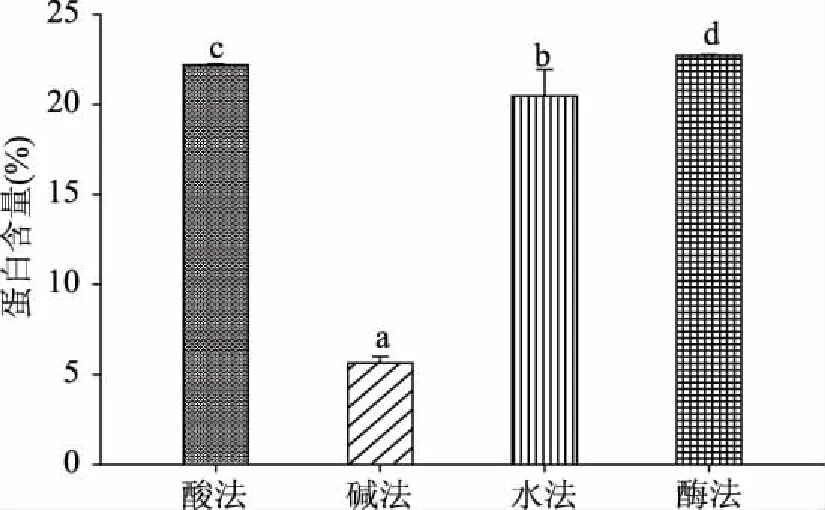
图3 不同提取方法下小麦麸皮多糖蛋白质含量的比较Fig.3 The protein content of wheat bran polysaccharides by different extraction methods
2.4 小麦麸皮粗多糖的单糖组分分析
根据各色谱峰与混合单糖标准品色谱峰的保留时间对照,由图4可知,四种不同提取方法提取的小麦麸皮多糖主要是由阿拉伯糖、木糖及葡萄糖组成的杂多糖。依据气相色谱面积归一化方法分析[18]得四种不同提取方法所得小麦麸皮多糖的单糖组分含量,酸提法小麦麸皮多糖的阿拉伯糖、木糖及葡萄糖含量摩尔比为0.43∶0.40∶0.10;碱提法小麦麸皮多糖的阿拉伯糖、木糖及葡萄糖含量摩尔比为0.42∶0.36∶0.08;水提法小麦麸皮多糖的阿拉伯糖、木糖及葡萄糖含量摩尔比为0.23∶0.20∶0.07;酶提法小麦麸皮多糖的单糖含量摩尔比为0.58∶0.71∶0.08。由气相色谱面积归一化方法分析得小麦麸皮多糖主要单糖组分是阿拉伯糖和木糖。

图4 不同提取方法下小麦麸皮多糖单糖组分的比较Fig.4 The monosaccharide composition analysis of wheat bran polysaccharides by different extraction methods注:(a)混合单糖标品:1:鼠李糖,2:阿拉伯糖,3:木糖,4:甘露糖,5:葡萄糖,6:半乳糖;(b)酸法提单糖组分分析;(c)碱法提单糖组分分析;(d)水法提单糖组分分析;(e)酶法提单糖组分分析。
2.5 小麦麸皮残渣的微观形态
图5a小麦麸皮超微粉原料存在较大块组织,除了片状外大部分呈棒状且细胞结构完整表面光滑。图5b~图5e可见经酸、碱、水、酶在相同提取条件下小麦麸皮超微粉细胞壁均有不同程度的破损且表面粗糙,组织碎片较多。其中,碱提法和酶提法对小麦麸皮细胞壁破坏程度较大,这是由于碱(NaOH)能够打断多糖与纤维素、半纤维素等以阿魏酸连接的共价酯键;纤维素酶在很大程度上破坏了纤维素的结构,使细胞壁的致密结构变得松散。这证明了不同提取方法下小麦麸皮多糖得率与小麦麸皮结构被破坏的程度有关。

图5 不同提取方法下小麦麸皮残渣的微观形态比较(8000×)Fig.5 The effect of different extraction methods on the microstructure of wheat bran(8000×)注:a:小麦麸皮超微粉;b:经酸提取后小麦麸皮超微粉;c:经碱提取后小麦麸皮超微粉; d:经水提取后小麦麸皮超微粉;e:经酶提取后小麦麸皮超微粉。
2.6 小麦麸皮多糖对RAW264.7细胞的影响
2.6.1 小麦麸皮多糖的细胞毒性 如图6可知,各样品处理组细胞存活率与空白对照组相比较差异不显著。不同提取方法所得小麦麸皮多糖在一定浓度范围内对细胞无明显的毒性作用。
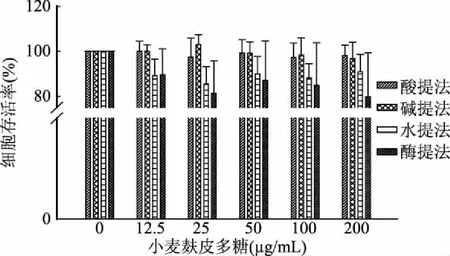
图6 不同提取方法提取的小麦麸皮多糖 对RAW264.7细胞毒性影响Fig.6 The cytotoxicity of wheat bran polysaccharides by different extraction methods on RAW264.7 cells
2.6.2 小麦麸皮多糖对RAW264.7细胞分泌NO的影响 如图7所示,空白对照组RAW264.7巨噬细胞上清液中仅含少量的NO,经不同浓度小麦麸皮多糖刺激后,各实验组细胞培养液中NO含量较空白对照组显著提高(p<0.05)。

图7 不同提取方法提取的小麦麸皮多糖 对RAW264.7细胞分泌NO的影响Fig.7 The nitric oxide inhibitory effect of wheat bran polysaccharides by different extraction methods on RAW264.7 cells
不同提取方法所得小麦麸皮多糖在一定浓度和作用时间范围内均可显著促进(p<0.05)RAW264.7细胞NO的分泌,具有激活巨噬细胞的功能。其中水提取法和酶提取法所得小麦麸皮多糖对巨噬细胞分泌NO因子的功能强于酸提法和碱提法。这是由于相同提取条件酸碱提取剂提取的多糖粘度较高,溶解度较差且多糖结构在一定程度上也遭到破坏,不利于多糖生物活性的发挥继而影响巨噬细胞分泌NO因子。
2.6.3 不同提取方法小麦麸皮多糖对RAW264.7细胞COX-2和iNOS蛋白表达的影响 如图8,Western Blot结果显示,正常对照组中,iNOS和COX-2蛋白不表达。不同提取方法所得小麦麸皮多糖对RAW264.7细胞COX-2和iNOS蛋白表达从高到低依次为:水提法>酶提法>酸提法=碱提法,其中酸提法和碱提法所得多糖对iNOS和COX-2蛋白不表达,水提法和酶提法小麦麸皮多糖可以上调iNOS和COX-2的蛋白表达水平且水提法效果强于酶提法。这是由于相同提取条件下酸碱作为多糖提取剂,所得多糖溶解度低,粘度较高且部分多糖由于酸碱作用其结构会发生改变,不利于其免疫活性的发挥;其次,相同提取条件下水作为提取剂提取的多糖,溶解度较大,分子量降低,粘度减小,大量的活性基团暴露出来有利于小麦麸皮多糖发挥其免疫调节的生物活性,Hromádková等[19]的研究结果表明分子量较低,水溶性好的麦麸麸皮多糖的生物活性较高,这与本实验的结果一致。因此,水提法小麦麸皮多糖能够有效刺激RAW264.7细胞并使其发挥免疫调节的生物活性作用。
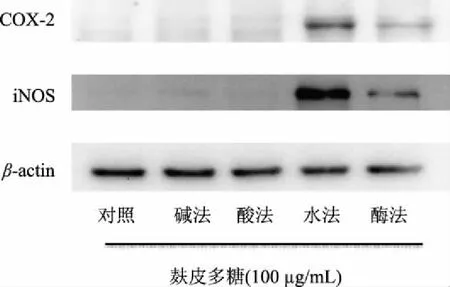
图8 不同提取方法提取的小麦麸皮多糖 对RAW264.7细胞COX-2和iNOS蛋白表达的影响Fig.8 The protein COX-2 and iNOS expression of RAW 264.7 cells in present of wheat bran polysaccharides by different extraction methods
3 结论
在本研究中,采用了四种提取方法对小麦麸皮多糖的提取率、化学组分及生物活性进行了比较。结果表明:四种不同提取方法得到的粗多糖得率、化学组分及生活性方面均存在差异性。其中碱提法粗多糖得率及多糖含量最高(是水提法的1.7倍),酶提法次之。小麦麸皮多糖化学组分的测定结果表明:相同提取条件下碱提法所得糖醛酸和硫酸根含量从高到低:碱提法>酶提法>酸提法>水提法。这是由于同等提取条件下稀碱溶液使大量的酸性多糖溶于稀碱溶液且稀碱溶液能使小麦麸皮细胞壁致密结构变得疏松,打断了葡萄糖醛酸与半纤维素之间分子的连接,从而使糖醛酸溶于稀碱溶液中,碱提法提取小麦麸皮中酸性多糖主要含有糖醛酸和硫酸根等酸性基团,故碱提法得到糖醛酸和硫酸根含量最高[20]。此外,电镜扫描结果显示:不同提取方法相同提取条件下纤维素酶对小麦麸皮细胞壁的破坏程度较其他提取工艺破坏程度大,几乎看不到完整的细胞结构和组织碎片。
MTT法检测得不同提取方法提取的小麦麸皮多糖对巨噬细胞无毒性作用。Griess法实验结果表明四种不同提取工艺所得小麦麸皮多糖对巨噬细胞分泌NO因子具有促进作用,其中酶提法和水提法所得麸皮多糖对RAW264.7分泌NO作用效果更为明显,由此可得,不同提取方法提取的小麦麸皮多糖具有激活巨噬细胞的功能;Western Blot 检测结果显示水提法和酶提法所得小麦麸皮多糖能够促进巨噬细胞iNOS和COX-2的蛋白表达且水提法多糖生物活性效果强于酶提法多糖。综上所述,不同提取方法对小麦麸皮多糖的化学组分及生物活性之间的比较,可为未来小麦麸皮的开发利用研究提供一定的理论依据。
