臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片PSII光化学活性的影响
2019-04-12耿庆伟邢浩翟衡蒋恩顺杜远鹏
耿庆伟,邢浩,翟衡,蒋恩顺,杜远鹏
臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片PSII光化学活性的影响
耿庆伟1,2,邢浩1,翟衡1,蒋恩顺3,杜远鹏1
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;2曲阜市吴村镇人民政府,山东曲阜 273100;3山东省果树研究所,山东泰安 271018)
【目的】自然界中臭氧与强光和高温逆境因素往往同时存在,探讨光强和温度及臭氧的交叉胁迫对葡萄叶片光系统功能的伤害机制,为生产上通过调控光照、温度缓解臭氧对葡萄的危害提供理论依据。【方法】以盆栽‘赤霞珠’葡萄为试验材料,利用叶绿素荧光动力学技术,研究(120±20)nL∙L-1的臭氧浓度下,不同光强(800、1 600 µmol∙m-2∙s-1)与温度(26℃、40℃)处理对光系统II光化学活性的影响。【结果】臭氧胁迫下40℃的高温和1 600 µmol∙m-2∙s-1的强光均可以显著降低叶片最大光化学效率(Fv/Fm)、线性电子传递速率(ETR)、单位面积有活性反应中心的数量(RC/CSm)以及光化学淬灭系数(qP),同时降低了光系统I激发能分配系数(α),增大了光系统II激发能分配系数(β),导致两个光系统之间的激发能分配严重偏离平衡,造成了光系统II的伤害,1 600 µmol∙m-2∙s-1的强光影响大于40℃的高温影响,强光、高温与臭氧复合胁迫对葡萄叶片影响最为严重。其中臭氧、适光、高温(T2)和臭氧、强光、适温(T3)处理后的叶片PSⅡ最大光化学量子产量Fv/Fm值分别比臭氧、适光、适温处理(T1)降低了10.3%和38.8%,臭氧、强光、高温(T4)处理后Fv/Fm降幅最大,达到54.8%。T2、T3和T4处理后叶片PSII的潜在活性Fv/Fo分别比T1降低了30.4%、69.6%和80.3%。与T1相比,T2、T3和T4处理后的叶片单位面积内有活性反应中心的数量RC/CSm值分别降低了26.8%、68.4%和70.2%,T2、T3和T4处理后的叶片Ψo值分别比T1降低了11.2%、21.6%、40.8%。T2、T3及T4处理葡萄叶片实际光化学效率Fv'/Fm'值分别比T1降低了7.9%、22.1%和42.3%;同时,各处理显著降低了植物叶片线性电子传递速率ETR,T4处理降幅最大,比T1降低了62.5%,T2和T3处理分别降低了17.6%和37.5%。T2、T3和T4的叶片光化学淬灭qP值分别比T1降低了10.7%和19.8%和39.5%。T2、T3和T4处理后葡萄叶片吸收的光能用于光化学反应的比例均有所下降,分别比T1处理降低18.8%和38.8%和62.0%。与T1相比,T2、T3和T4处理吸收的光能用于热耗散的比例均增加,增幅分别为15.9%、36.2%和60.5%,同时,过剩光能分别增加12.5%、19.1%和25.2%。不同处理显著降低了叶片PSI激发能分配系数(α),与T1相比,T2、T3和T4分别下降了6.6%和12.8%和25.1%;同时,不同处理后叶片PSII激发能分配系数(β)均显著上升,T2、T3、T4分别比T1升高了4.5%、8.7%、17.1%。光系统间激发能分配不平衡偏离系数(β/α–1)变化趋势与PSII激发能分配系数一致,T2、T3处理的β/α–1分别比T1升高37.7%和78.3%,T4升高幅度最大,达到187.8%。【结论】温度、光照逆境增加了PSII活性对臭氧胁迫的敏感性,以强光胁迫的作用效果更显著,而高温、强光胁迫下臭氧对PSII活性抑制程度最大。
葡萄;臭氧;光照;温度;叶绿素荧光参数
0 引言
【研究意义】近几十年来O3污染已经成为对流层中首要污染物,对作物生长和农业生产造成很大影响,全球近1/4的国家或地区面临O3浓度超出60 nL·L-1的威胁[1-2]。由于人类活动和生物源排放,O3浓度仍以每年约0.5%—2.5%的速率增长[3],预计2015—2050年全球地表O3浓度将在现有基础上增加20%—25%,21世纪末将增加40%—60%。O3具有强氧化性,可对植物产生氧化伤害[4]。臭氧污染往往发生在特定的时间段内,不同季节以夏季最强,一天之中又以10:00—14:00最强,臭氧污染与强光和高温同时存在,3个生态逆境因素存在协同胁迫作用。因此,本研究开展3个生态逆境因素协同胁迫对葡萄光化学活性的影响,旨在为生产上采取相应措施缓解臭氧伤害提供理论依据。【前人研究进展】气孔是植物与外界进行气体交换的主要通道,是臭氧进入植物体的主要途径[5],O3通过气孔进入叶片后导致叶片光下最大光化学效率(ΦPSII)和PSII开放程度(qP)受到抑制[6],孙永江等[7]研究发现,随着O3浓度升高,叶片净光合速率(Pn)、气孔导度(Gs)、PSII的实际光化学效率(ΦPSII)、光下最大光化学效率(Fv′/Fm′)、捕获光能用于QA以后的电子传递的概率(Eo)、单位面积有活性反应中心的数量(RC/CSm)均呈下降趋势;在低O3浓度条件下(25—55 nL∙L-1),Pn的下降主要是由于气孔限制引起的,O3浓度达到并超过80 nL·L-1时,叶绿素含量显著降低,非气孔限制占主导因素,葡萄叶片可以在短时间内(8 h)忍受一定浓度(不超过55 nL·L-1)的O3胁迫,O3浓度达到或超过80 nL·L-1时,PSII功能受到较严重的抑制[7],严重影响植物的蒸腾、光合、呼吸等重要生理过程[8-9]。光是植物进行光合作用所必需的环境因子,但在强光下,当光合机构吸收的光能超过光合作用的利用量时,即出现光抑制,若植物不能及时有效地利用或耗散,就会产生过量的活性氧[10],破坏光合色素和Dl蛋白等,引起PSⅡ的损伤[11-12]。高温胁迫会破坏叶片PSⅡ,导致植物叶片不能有效利用吸收的光能[13-14],最终会降低植物的光合作用、损坏细胞膜并打破活性氧平衡[15-16]。【本研究切入点】自然条件下,夏季强光和高温往往同时出现,伴随着臭氧的污染,植物遭受臭氧、强光、高温等3种逆境因子的交叉胁迫。但目前研究多从单一或两个胁迫因素开展研究,尚缺乏3个生态逆境因素协同胁迫影响机制研究。【拟解决的关键问题】以广泛栽培的酿酒葡萄品种‘赤霞珠’为试材,利用叶绿素荧光技术,在对植物叶片不造成伤害的前提下,探究光合机构的运转状况,探测和分析植物的光合功能,了解臭氧胁迫下强光、高温胁迫对葡萄叶片PSⅡ活性的影响,以期探寻减轻光抑制和提高逆境光合能力的有效途径,保证大田葡萄植株的生长和果实发育。
1 材料与方法
1.1 试验时间、地点
本试验于2016年7月—9月在山东农业大学葡萄核心试验园内进行。
1.2 试验材料和处理
试材为长势一致的‘赤霞珠’(L. Cabernet Sauvigon)一年生扦插苗,种植于直径25 cm、高35 cm的花盆中。基质﹕沙=1﹕1。待植株长至10—12片完全展开叶时进行试验处理。
处理分为5组,分别在自然大气臭氧浓度条件下正常光照与适温(35 nL∙L-1,800 µmol·m-2·s-1,26℃)、臭氧胁迫下正常光照与适温((120±20)nL∙L-1,800 µmol·m-2·s-1,26℃)、臭氧胁迫下正常光照与高温((120± 20)nL∙L-1,800 µmol·m-2·s-1,40℃)、臭氧胁迫下强光与适温((120±20)nL∙L-1,1 600 µmol·m-2·s-1,26℃)和臭氧胁迫下强光与高温(120±20 nL∙L-1,1 600 µmol·m-2·s-1,40℃)条件下处理3 h(5个处理分别表示为对照Control、T1、T2、T3、T4),臭氧浓度的选定依据前期试验确定[17]。处理结束后进行相关参数测定,每个处理重复5次,单株小区。
用于O3熏蒸的OTC[17]的框架由直径3 cm的镀锌钢管构成,四周用温室专用的聚乙烯塑料膜包被,顶部与大气相通。OTC内距离试验材料顶部50 cm有布气管,布气管上有一排斜向下与水平面呈45°的出气孔,O3发生器(WJ-HY5型)产生的O3在管道中与空气混合,在鼓风机(SF2-2型)的作用下被通入OTC内布气管。OTC内的O3浓度监测仪(DR70C-臭氧型)可以实时监测OTC内的O3浓度,并把数据传输到电脑上用于观察、保存。通过转子流量计调节O3发生器的进氧量,从而控制OTC内的O3浓度。在OTC气室内通过温度控制系统(Plant System,上海菲探仪器科技有限公司)调节叶片周围温度,用LED冷光源灯控制达到叶片表面光强。
1.3 测定项目和方法
采用英国Hansatech公司的FMS-2型便携脉冲调制式荧光仪测定荧光参数,测定程序如下:首先对叶片进行30 min暗适应,用饱和脉冲光(12 000 μmol·m-2·s-1)测定暗适应30 min后最大荧光(Fm)。对光适应下的叶片先用60 s作用光(1 000 μmol·m-2·s-1),然后用极弱的测量光(<0.05 μmol·m-2·s-1)测得叶片最小荧光(Fo'),再用饱和脉冲光(12 000 μmol·m-2·s-1)测定光适应下的最大荧光值Fm',打开作用光测定光下稳态荧光Ft。包括:天线转化效率:Fv'/Fm'=(Fm'-Fo')/Fm';线性电子传递速率:ETR=(ФPSII)×PFD×0.84× 0.5,其中PFD是被吸收的光通量密度(μmol·m-2·s-1),0.5代表光能在两个光系统间的分配系数,0.84指入射到叶片表面的光能平均有84%被叶片吸收;光化学淬灭:qP=(Fm'-Fs)/(Fm'-Fo'),其中Fs表示光适应下的稳态荧光。两个光系统之间的激发能分配系数按Braun等[18]的公式计算:光系统Ⅰ激发能分配系数α=f/(1+f),光系统Ⅱ激发能分配系数β=1/(1+f),f=(Fm'-Fs)/(Fm'-Fo');光系统Ⅰ和Ⅱ间激发能分配的不平衡性可用β/α-1表示。根据Demmig-Adams等[19]提出的公式计算光合机构吸收的光能用于光化学反应的份额P=Fv'/Fm'×qP,用于天线热耗散的份额D=1-Fv'/Fm',用于反应中心由非光化学反应耗散的份额(过剩光能,X耗散)Ex=Fv'/Fm'×(1-qP)。
用连续激发式荧光仪(Handy PEA,Hansatech,英国)测量荧光诱导动力学曲线,参考李鹏民等[20]的计算方法,获得如下参数:PSII最大光化学效率Fv/Fm,PSII的潜在活性Fv/Fo,单位面积有活性反应中心数目(RC/CSm)=Fm·φPo·(Vj/Mo),Vj表示j点相对可变荧光,Mo表示QA被还原的最大速率。捕获的激子将电子传递到QA以后的其他电子受体的概率(Ψo)=ETo/TRo=(1–Vj),ETo/CSo表示用于电子传递的能量,TRo/CSo表示还原QA的激发能。
1.4 数据处理及统计分析
采用Microsoft Excel软件处理数据和制图,采用DPS软件的LSD法进行差异显著性检验。
2 结果
2.1 对葡萄叶片Fv/Fm、Fv/F0、RC/CSm、Ψ0的影响
Fv/Fm是PSⅡ最大光化学量子产量,或称最大PSⅡ的光能转换效率,代表了光合机构把吸收的光能用于光化学反应的最大效率,反映光能吸收转化机构的完整性,非胁迫条件下该参数的变化极小,不受物种和生长条件的影响,常用Fv/Fm下降程度来反映光抑制程度的大小[21-22]。从图1可以看出,与对照相比,不同处理显著降低叶片的Fv/Fm值,与T1相比,T2、T3分别降低了10.3%和38.8% ,T4降幅最大,达到54.8%。Fv/Fo表示的是PSII的潜在活性,与T1相比,T2、T3和T4分别降低了和30.4%、69.6%和80.3%。RC/CSm反映了叶片单位面积内有活性反应中心的数量,o表示捕获的激子将电子传递到QA以后的其他电子受体的概率。与对照相比,不同处理均降低了叶片的RC/CSm值和Ψo值,与T1相比,T2、T3和T4处理分别降低了26.8%、68.4%、70.2%和11.2%、21.6%、40.8%。表明臭氧胁迫下,1 600 μmol·m-2·s-1的强光和40℃高温均可加剧PSII最大光化学效率和潜在活性的降低,但1 600 μmol·m-2·s-1的强光影响程度更大;当强光和高温同时出现时,抑制程度最大。

不同小写字母表示不同处理在0.05水平上的差异显著性。下同
2.2 对葡萄叶片Fv'/Fm'、ETR、qp的影响
Fv'/Fm'是PSⅡ有效光化学量子产量,为光条件下PSⅡ天线转化效率,可以用来反映开放的PSII反应中心的激发能捕获效率[23]。从图2可以看出,与对照相比,T1处理降低了植物叶片实际光化学效率,与T1相比,T2、T3分别降低了7.9%、22.1%,T4下降最显著,降幅为42.3%。ETR可以表示从PSⅡ到PSⅠ的电子传递情况[24],与对照相比,T1处理显著降低了植物叶片线性电子传递速率,与T1相比,T4处理降幅最大,达到62.5%,T2和T3处理分别降低了17.6%和37.5%。qP表示荧光淬灭中的光化学淬灭,从图2可知,与对照相比,不同处理显著降低了葡萄叶片的光化学淬灭,与T1相比,T2、T3的qP值分别降低了10.7%和19.8%,T4变化最显著,降低了39.5%。这表明臭氧胁迫下1 600 μmol·m-2·s-1的强光和40℃高温均可降低PSII激发能捕获效率、线性电子传递速率和光化学淬灭,导致叶片吸收的光能更多的以热耗散形式消耗,被用来进行碳固定的能量显著减少,但1 600 μmol·m-2·s-1的强光影响程度更显著;当强光和高温同时出现时,Fv'/Fm'、ETR和qP降幅最大,影响更显著。
2.3 对葡萄叶片吸收光能分配的影响
植物叶片吸收的光能有三条去路,一是在天线色素上进行热耗散(D),二是用于光化学反应(P),三是反应中心的过剩激发能(E)。图3反映了不同处理下吸收光能向光化学反应、热耗散及过剩光能分配的情况,由图可知,与对照相比,不同处理下吸收的光能用于光化学反应的比例均有所下降,与T1相比,T2、T3分别降低18.8%和38.8%,T4下降最明显,降幅为62.0%。与T1相比,T2、T3和T4处理吸收的光能用于热耗散的比例均增加,增幅分别为15.9%、36.2%和60.5%;过剩光能分别增加12.5%、19.1%和25.2%。这表明臭氧胁迫下1 600 μmol·m-2·s-1的强光和40℃高温均可增加吸收的光能用于热耗散和过剩光能的份额,降低用于光化学反应的比例,但1 600 μmol·m-2·s-1的强光造成过剩光能的份额更大。当强光和高温同时出现时,过剩光能的比例最大,这部分既没有被捕光天线色素耗散掉,也没有被光化学反应利用的过剩光能必然会导致葡萄叶片活性氧含量增加,进而对光合机构造成损伤。

图2 臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片Fv'/Fm'、ETR、qP的影响
Fig. 2 Effect of light and temperature on Fv'/Fm', ETR and qPin ‘cabernet sauvignon’ grape leaf under ozone stress
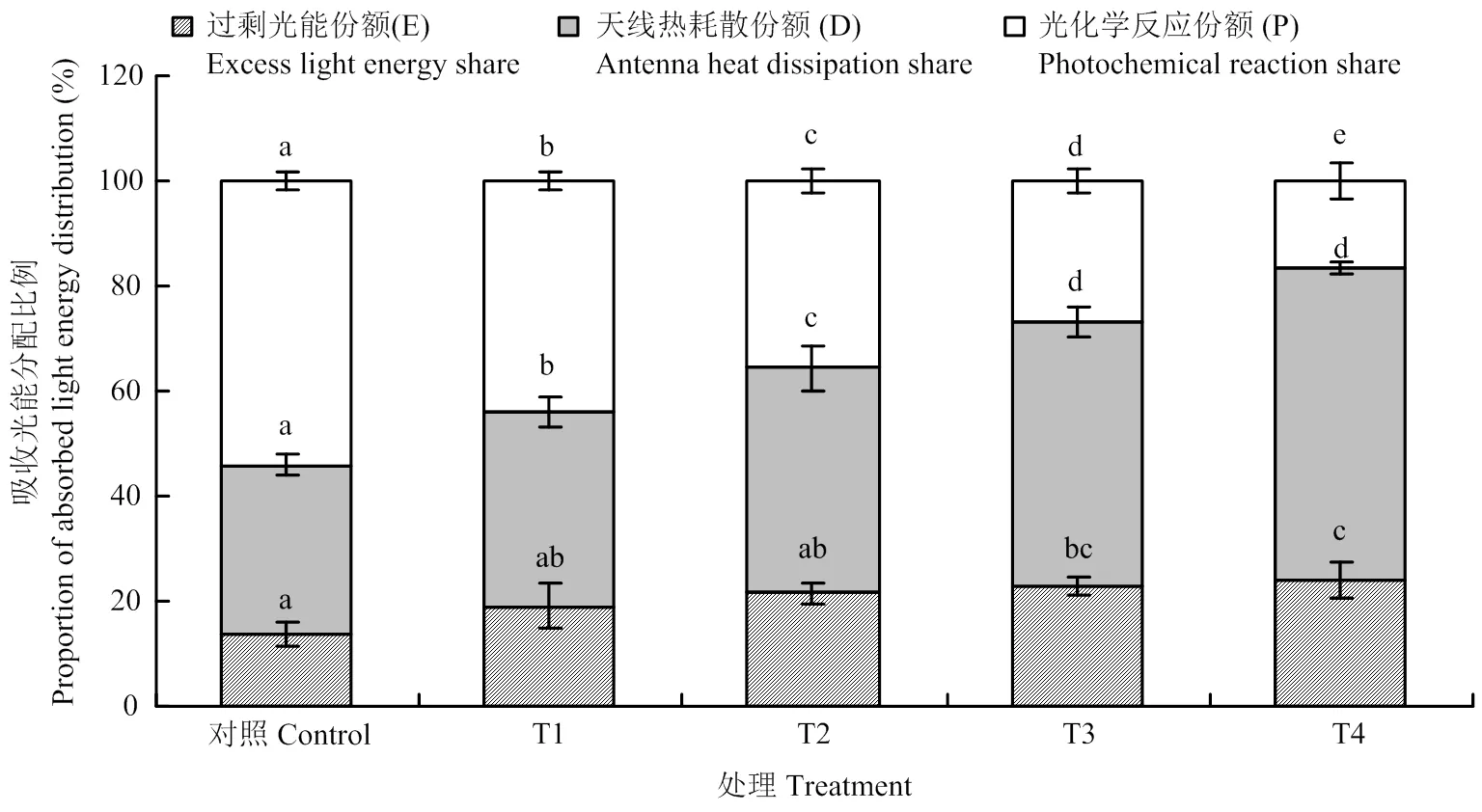
图3 臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片吸收光能分配的影响
2.4 对葡萄叶片光系统I、光系统II间激发能分配的影响
由图4可知,与对照相比,不同处理显著降低叶片PSI激发能分配系数(α)。与T1相比,T2、T3分别下降了6.6%和12.8%,T4下降幅度最大,降幅为25.1%;与之相反,不同处理后叶片PSII激发能分配系数(β)均显著上升,与T1相比,T2、T3、T4分别升高了4.5%、8.7%、17.1%。双光系统间激发能分配不平衡偏离系数(β/α–1)变化趋势与PSII激发能分配系数一致,与T1相比,T2、T3分别升高37.7%和78.3%,T4升高幅度最大,达到187.8%。这表明臭氧胁迫下强光、高温严重影响激发能在两个系统之间的均匀分配,导致光系统之间激发能分配的不平衡,但强光的影响更为严重;当强光、高温同时出现时激发能在两个光系统间分配偏离最严重。

图4 臭氧胁迫下不同光强与温度处理对‘赤霞珠’葡萄叶片光系统I、光系统II间激发能分配的影响
3 讨论
快速叶绿素荧光诱导动力学技术被认为是探测植物光合生理的无损探针,植物快速叶绿素荧光诱导曲线中包含着大量有关PSⅡ反应中心原初光化学反应的信息,其参数反映了植物原初反应和光合生理状况,常用来研究各种外界逆境因子对植物的影响[20]。大量研究表明,臭氧、强光和高温等非生物逆境因子跟农业生产和作物产量的有着紧密的联系。臭氧可以诱导植物体产生大量活性氧,造成过高的活性氧(ROS)积累,影响光抑制修复过程,从而导致叶片光抑制发生[25];强光可以使叶片发生光抑制,而且当光抑制达到一定程度时,光合机构中的D1蛋白发生降解,产生光破坏[26];在葡萄生长季节当气温高于40℃时会抑制新梢的生长;而当温度超过40℃时,由于细胞酶系统被钝化,葡萄体内的各种生理代谢活动受到严重阻碍,同时会造成PSII的结构和功能发生变化甚至损害,致使新梢停止生长、叶片发黄、果实日烧,最终导致葡萄减产并影响翌年葡萄生长发育。
在自然条件下,特别是夏季晴天,高温往往伴随强光发生,同时高辐射会造成对流层形成大量O3[27],因此,在葡萄生长的旺季—夏季,葡萄叶片通常要遭受高温、强光和O33种胁迫因子。本研究中发现臭氧胁迫下葡萄叶片最大光化学效率(Fv/Fm)、单位面积有活性反应中心的数量(RC/CSm)以及捕获光能用于向QA以后的电子传递的能量比例(ΨEo)显著降低,这表明叶片PSII的反应中心和受体侧出现光抑制[28]。光系统I激发能分配系数(α)大幅降低,光系统II激发能分配系数(β)显著增大,两个光系统之间的激发能分配严重偏离平衡。光化学淬灭系数(qP)下降的同时非光化学淬灭系数(NPQ)升高,这表明叶绿素吸收的光能用于光化学反应的比例降低,叶片过剩的光能通过热耗散的形式散失以保护叶片光合结构,虽然叶片热耗散能力增加,但是由于PSII实际光化学效率(ФPSII)的下降,叶片通过光化学反应对激发能的利用率大幅下降,热耗散途径不足以清除大量的过剩光能,最终造成光系统II的伤害,这与前人研究结果一致。
强光和高温均对臭氧胁迫有加剧作用,1 000 µmol·m-2·s-1光强下的臭氧胁迫对菜豆叶片的影响显著大于单一臭氧或光照胁迫处理[29],说明高光强可以加剧臭氧对光合作用的抑制。笔者课题组前期试验通过响应面试验设计不同光照与臭氧组合也发现光照强度和O3浓度存在交互作用,强光不仅可以加剧O3对植物叶片PSII的伤害,并且随着光强的增加伤害程度在逐渐升高[30]。本研究结果发现40℃的高温、1 600 µmol·m-2·s-1的强光均加剧了臭氧胁迫对PSII造成的伤害,但1 600 µmol·m-2·s-1的强光影响程度显著大于40℃的高温;当强光和高温同时存在时,O3胁迫对PSII的伤害最明显,不仅加大了强光因素引起的光系统II伤害,也加大了高温因素引起的光系统II伤害。这是由于强光产生的过剩光能导致ROS的积累,本身加剧了O3对植物的ROS伤害,造成光抑制的出现,加之高温通过伤害细胞质膜和光合电子传递链[31],破坏PSII反应中心的D1蛋白,同时降低暗反应相关的酶活性[32],进一步导致植物叶片Pn降低[33]。虽然叶片通过热耗散的形式散失/疏散过剩光能以保护叶片光合结构,但是ROS和高温对光合机构、细胞质膜和光合电子传递链的氧化伤害,导致叶绿素吸收的光能用于光化学反应的比例大幅降低,大量的过剩光能积聚在光合结构,热耗散途径不足以及时有效清除的情况下过剩光能继续积累,ROS物质继续伤害抗氧化系统和光合机构,并最终造成了PSII的严重伤害。
生产中高温和强光天气往往同时发生,本研究结果提示臭氧胁迫下强光的伤害高于高温,由此提示可以通过降低光强缓解臭氧伤害。叶幕结构与植物光合作用联系密切,成果等[34]比较了新疆地区多主蔓扇形和“厂”字形等方式对‘赤霞珠’葡萄光合特性的影响,研究结果发现不同整形方式改变叶幕光照透射率以及果际周围光合有效辐射,影响叶片光合速率及果实品质。本研究团队前期在田间观察也发现棚架‘摩尔多瓦’葡萄叶片受臭氧伤害症状弱于篱架,由此提示可以通过架式调整或铺设遮阳网降低光强来缓解臭氧伤害。
4 结论
温、光逆境增加了PSII活性对臭氧胁迫的敏感性,40℃的高温、1 600 µmol·m-2·s-1的强光均可以显著降低叶片最大光化学效率(Fv/Fm)、线性电子传递速率(ETR)、单位面积有活性反应中心的数量(RC/CSm)以及光化学淬灭系数(qP),导致两个光系统之间的激发能分配严重偏离平衡,造成光系统II的伤害。1 600 µmol·m-2·s-1的强光影响程度显著大于40℃的高温,而高温、强光胁迫下过剩光能的比例最大,导致葡萄叶片活性氧含量增加,进而对光合机构造成损伤。
[1] Ashmore M R. Assessing the future global impacts of ozone on vegetation., 2005, 28(8): 949-964.
[2] 张巍巍, 牛俊峰, 王效科, 田媛, 姚芳芳, 冯兆忠. 大气臭氧浓度增加对湿地松的影响. 环境科学, 2011, 32(6): 1710-1716.
Zhang W W, Niu J F, Wang X K, Tian Y, Yao F F, Feng Z Z. Effects of elevated ozone concentration on slash pine () seedlings.,2011, 32(6): 1710-1716. (in Chinese)
[3] 郑有飞, 胡程达, 吴荣军, 赵泽, 刘宏举, 石春红. 地表臭氧浓度增加对冬小麦光合作用的影响. 生态学报, 2010, 30(4): 847-855.
Zheng Y F, Hu C D, Wu R J, Zhao Z, Liu H J, Shi C H. Experiment with effects of increased surface ozone concentration upon winter wheat photosynthesis., 2010, 30(4): 847-855. (in Chinese)
[4] Feng Z Z, Hu E Z, Wang X K, Jiang L J, Liu X J. Ground level O3pollution and its impacts on food crops in China: A review., 2015, 199: 42-48.
[5] Leipner J, Oxborough K, Baker N R. Primary sites of ozone-in-duced perturbations of photosynthesis in leaves: identification and characterization inusing high resolution chlorophyll fluorescence imaging., 2001, 52: 1689-1696.
[6] Chen C P, Frank T D, Long S P. Is a short, sharp shock equivalent to long-term punishment? Contrasting the spatial pattern of acute and chronic ozone damage to soybean leaves via chlorophyll fluorescence imaging., 2009, 32: 327-335.
[7] 孙永江, 王金欢, 耿庆伟, 邢浩, 翟衡, 杜远鹏. 不同浓度臭氧处理对‘赤霞珠’葡萄叶片光系统Ⅱ功能的影响. 植物生理学报, 2015, 51(11): 1947-1954.
Sun Y J, Wang J H, Geng Q W, Xing H, Zhai H, Du Y P. Effects of different concentrations of ozone stress on photosynthetic system II incv. ‘Cabernet Sauvignon’., 2015, 51(11): 1947-1954. (in Chinese)
[8] 郑有飞, 赵泽, 吴荣军,胡程达, 刘宏举. 臭氧胁迫对冬小麦叶绿素荧光及气体交换的影响. 环境科学, 2010, 31(2): 472-479.
Zheng Y F, Zhao Z, Wu R J, Hu C D, Liu H J. Effects of long-term ozone exposure on chlorophylla fluorescence and gas exchange of winter-wheat leaves.2010, 31(2): 472-479. (in Chinese)
[9] 寇太记, 常会庆, 张联合, 徐晓峰,郭大勇, 周文利, 朱建国, 苗艳芳. 近地层O3污染对陆地生态系统的影响. 生态环境学报, 2009, 18(2): 704-710.
Kou T J, Chang H Q, Zhang L H, Xu X F, Guo D Y, Zhou W L, Zhu J G, Miao Y F. Effect of near-surface O3pollution on terrestrial ecosystems., 2009, 18(2): 704-710. (in Chinese)
[10] Foyer C H, Noctor G. Oxidant and antioxidant signaling in plants: A re-evaluation of the concept of oxidative stress in a physiological context., 28: 1056-1071.
[11] Pospíšil P.Production of reactive oxygen species by photosystem II., 2009, 1787(10): 1151-1160.
[12] Tyystjarvi E. Photoinhibition of photosystem II.2013, 300: 243-303.
[13] 罗海波, 马苓, 段伟, 李绍华, 王利军. 高温胁迫对‘赤霞珠’葡萄光合作用的影响. 中国农业科学. 2010, 43(13): 2744-2750.
LUO H B, MA L, DUAN W, LI S H, WANG L J. Influence of heat stress on photosynthesis inL. cv. Cabernet Sauvignon., 2010, 43(13): 2744-2750. (in Chinese)
[14] 孙永江, 付艳东, 杜远鹏, 翟衡. 不同温度/光照组合对‘赤霞珠’葡萄叶片光系统II功能的影响. 中国农业科学, 2013, 46(6): 1191-1200.
SUN Y J, FU Y D, DU Y P, ZHAI H. Effects of different temperature and light treatments on photosynthetic system II inL. cv. Cabernet Sauvignon., 2013, 46(6): 1191-1200. (in Chinese)
[15] Sun Y j, Geng Q w, Du Y p, Yang X h, Zhai H. Induction of cyclic electron flow around photosystem I during heat stress in grape leaves., 2017, 256: 65-71.
[16] SUN Y J, GAO Y L, WANG H, YANG X H, ZHAI H, DU Y P. Stimulation of cyclic electron flow around PSI as a response to the combined stress of high light and high temperature in grape leaves., 2018, 45(10): 1038-1045.
[17] 孙永江, 王金欢, 耿庆伟, 邢浩, 翟衡, 杜远鹏. 不同浓度臭氧处理对‘赤霞珠’葡萄叶片光系统Ⅱ功能的影响. 植物生理学报, 2015, 51(11): 1947-1954.
SUN Y J, WANG J H, GENG Q W, XING H, ZHAI H, DU Y P. Effects of different concentrations of ozone stress on photosynthetic system II incv. ‘Cabernet Sauvignon’., 2015, 51(11): 1947-1954. (in Chinese)
[18] Braun G, Malkin S. Regulation of the imbalance in light excitation between photosystem II and photosystem I by cations and by the energized state of the thylakoid membrane., 1990, 1017(1): 79-90.
[19] Demmig-Adams B, Adams W W. The role of xanthophyll cycle carotenoids in the protection of photosynthesis., 1996, 1(1): 21-26.
[20] 李鹏民, 高辉远, Strasser Reto J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 2005, 31 (6): 559-566.
LI P M, GAO H Y, STRASSER R J. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study., 2005, 31(6): 559-566. (in Chinese)
[21] Osmond C B. What is photoinhibition? some insights from comparisons of shade and sun plants., 1994.
[22] 莫伟平, 周琳耀, 张静逸, 黄俊波, 贝学文, 付欣雨, 王惠聪, 黄旭明. 遮荫和环剥对荔枝枝梢生长和光合生理的影响. 园艺学报, 2013, 40(1): 117-124.
Mo W P, Zhou L Y, Zhang J Y, Huang J B, Bei X W, Fu X Y, Wang H C, Huang X M. Effects of shading and girdling on shoot growth and photosynthesis in litchi., 2013, 40(1): 117-124. (in Chinese)
[23] 李亮, 董春娟, 尚庆茂. 内源水杨酸参与黄瓜叶片光合系统对低温胁迫的响应. 园艺学报, 2013, 40(3): 487-497.
Li L, Dong C J, Shang Q M. Role of endogenous salicylic acid in responding of cucumber leaf photosynthetic systems to low temperature stress., 2013, 40(3): 487-497. (in Chinese)
[24] Munekage Y, Hashimoto M, Miyake C, Tomizawa K I, Endo T, Tasaka M, Shikanai T. Cyclic electron flow around photosystem I is essential for photosynthesis., 2004, 429: 579-582.
[25] Mohanty P, Allakhverdiev S I, Murata N. Application of low temperatures during photoinhibition allows characterization of individual steps in photodamage and the repair of photosystem II., 2007, 94(2/3): 217-224.
[26] Schrader S M, Wise R R, Wacholtz W F, ORT D R, Sharkey T D. Thylakoid membrane responses to moderately high leaf temperature in Pima cotton., 2004, 27(6): 725-735.
[27] Mittler R. Abiotic stress, the field environment and stress combination., 2006, 11(1): 15-19.
[28] Meyer U, Kollner B, Willenbrink J, Ghm K. Effects of different ozone exposure regimes on photosynthesis, assimilates and thousand grain weight in spring wheat., 2000, 78(1): 49-55.
[29] Guidi L, Tonini M, Soldatini G F. Effects of high light and ozone fumigation on photosynthesis in., 2000, 38(9): 717-725.
[30] Geng Q W, Xing h, Sun Y J, HAO G M, ZHAI H, DU Y P. Analysis of the interaction effects of light and O3on fluorescence properties of ‘Cabernet Sauvignon’ grapes based on response surface methodology., 2018, 227: 255-260.
[31] Wise R R, Olson A J, Schrader S M, Sharkey T D. Electron transport is the functional limitation of photosynthesis in field-grown Pima cotton plants at high temperature., 2004, 27(6): 717-724.
[32] Chaitanya K V, Sundar D, Reddy A R. Mulberry leaf metabolism under high temperature stress., 2001, 44(3): 379-384.
[33] Hosono M, Katsura Y. Temperature response of photosynthesis in transgenic rice transformed with ‘sense’ or ‘antisense’ rbcS., 2007, 48(10): 1472-1483.
[34] 成果, 陈立业, 王军, 陈武, 张振文. 2种整形方式对‘赤霞珠’葡萄光合特性及果实品质的影响. 果树学报, 2015, 32(2): 215-224.
Cheng G, Chen L Y, Wang J, Chen W, Zhang Z W. Effect of training system on photosynthesis and fruit characteristics of Cabernet Sauvignon.2015, 32(2): 215-224. (in Chinese)
Effects of Different Light Intensity and Temperature on PSII Photochemical Activity in ‘Cabernet Sauvignon’ Grape Leaves Under Ozone Stress
Geng QingWei1,2, Xing Hao1, Zhai Heng1, Jiang EnShun3, DU YuanPeng1
(1College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong;2Town government of Wucun, Qufu 273100, Shandong;3Shandong Institute of Pomology, Tai’an 271018, Shandong)
【Objective】Ozone stress, high light and high temperature usually exist simultaneously in nature, but little is known about the effect of the combination of three stress factors on plants. So the combined effects of different temperature (26, 40℃), light (800, 1 600 µmol∙m-2∙s-1) and ozone treatments on the operation of photosynthetic apparatus were investigated to reveal the mechanism of inhibition of photosynthesis, which provided a theoretical basis for reducing ozone injury by regulating the light and temperature. 【Method】Potted Cabernet Sauvignon grapes were used as materials to be treated with different temperatures (26, 40℃), two kinds of light intensities (800, 1 600 µmol∙m-2∙s-1) combined with (120±20) nL∙L-1ozone. Chlorophyll a fluorescence parameters were analyzed to investigate the effects of different treatments on the PSII function. 【Result】40℃and 1 600 µmol·m-2·s-1both significantly decreased the maximal photochemical efficiency (Fv/Fm), linear electron transport rate (ETR), the unit area number of reactive centers (RC/CSm) and photochemical quenching coefficient (qP) of leaf under ozone stress. At the same time, the decreased excitation energy partition coefficient (α) of PSI and increased excitation energy partition coefficient (β) of PSII induced a serious imbalance of excitation energy distribution between the two photosystems and caused the damage of photosystem II, and the influence of strong light intensity (1 600 µmol·m-2·s-1) was more significant. The maximal photochemical efficiency (Fv/Fm) under T2 and T3 treatment decreased 10.3% and 38.8% than that under T1 treatment, Fv/Fmunder T4 treatment decreased most for 54.8%. PSII quantum efficiency Fv/Founder T2, T3 and T4 treatment decreased 30.4%, 69.6% and 80.3% than that of T1 treatment, respectively. The number of reaction centers per unit area (RC/CSm) under T2, T3 and T4 treatment decreased 30.4%, 69.6% and 80.3% than that of T1 treatment, respectively, and the probability of that a trapped exciton the moves an electron further than QAby trapped exciton (Ψo) under T2, T3 and T4 treatment decreased 11.2%, 21.6% and 40.8% than that of T1 treatment, respectively. The effective photochemical efficiency Fv'/Fm' under T2, T3 and T4 treatment decreased 7.9%, 22.1% and 42.3% than that under T1 treatment, respectively. Linear electron transport rate (ETR) of T4 decreased most (decreased 62.5% than that under T1 treatment), and ETR under T2 and T3 treatment decreased 17.6% and 37.5% than that of T1 treatment, respectively. The photochemical quenching coefficient (qP) under T2, T3 and T4 treatment decreased 10.7%, 19.8% and 39.5%than that of T1 treatment, respectively. The photochemical reactions share under T2, T3 and T4 treatment decreased 18.8%, 38.8% and 62.0% than that of T1 treatment, respectively. While the antennal heat dissipation share under T2, T3 and T4 treatment increased 15.9%, 36.2% and 60.5% than that of T1 treatment, respectively, and the excess light energy share of T2, T3 and T4 treatment increased 12.5%, 19.1% and 25.2% than that of T1 treatment, respectively, the excitation energy partition coefficient (α) of PSI under T2, T3 and T4 treatment decreased 6.6%, 12.8% and 25.1% than that under T1 treatment, respectively, and the excitation energy partition coefficient (β) of PSII under T2, T3 and T4 treatment increased 4.5%, 8.7% and 17.1% than that under T1 treatment, respectively, and the change trend of imbalance of partitioning of excitation energy between PSⅠand PSⅡ(β/α-1) wasconsistentwiththechangeofthe excitation energy partition coefficient, β/α-1 under T2, T3 and T4 increased 37.7%, 78.3% and 187.8% than that under T1 treatment.【Conclusion】Temperature and light stress increased the sensitivity of PSII activity to ozone stress, and the influence of light stress was more significant, while high temperature and high light stress causedto
grape; ozone; light; temperature; chlorophyll fluorescence parameters
10.3864/j.issn.0578-1752.2019.07.006
2018-07-09;
2019-01-03
国家自然科学基金(31572084)、国家现代农业产业技术体系建设专项资金(CARS-29)、长江学者和创新团队发展计划项目(IRT15R42)
耿庆伟,E-mail:841295333@qq.com。通信作者蒋恩顺,E-mail:enshunjiang@163.com。通信作者杜远鹏,E-mail:duyuanpeng 001@163.com
(责任编辑 赵伶俐)
