不同处理方法对灵芝有效成分提取率的影响
2019-04-12罗汝锋罗艳萍蓝泽基
罗汝锋,罗艳萍,蓝泽基
(广东一方制药有限公司,广东佛山 528244)
0 引言
灵芝为多孔菌科真菌赤芝(Ganoderma lucidum(Leyss.exFr.)Karst.)或紫芝(Ganoderma sinense Zhao) 的干燥子实体[1]。
我国是世界上最早栽培和食用灵芝的国家之一,因其具有独特的药用价值,功效确切,早在东汉时期,我国第一部中草药著作《神农本草经》中就有相关收录,并把灵芝称为“上药”;而之后的《本草纲目》 《开元本草》等著作中,也一直被称为“扶正固本”“滋补强身”“延年益寿”的中药珍宝和食疗瑰宝。而我国也于2018年公开征求关于将灵芝等作为药食同源管理意见函,这也为日后灵芝作为药食同源产品的开发注入强大的动力。
灵芝中含有丰富的化学成分,主要包括多糖、三萜类、蛋白质、麦角甾醇、生物碱,以及多种微量元素等,孢子中还含甘露醇、海藻糖(Trehalose)等[2]。三萜类化合物是灵芝的主要活性成分之一,种类很多,它们是灵芝的苦味成分,其含氧功能团对苦味的产生起重要作用。药理研究表明,灵芝三萜具有解毒、保肝、抗肿瘤、抗炎、抗氧化、抗组织胺释放、抑制血管紧张素、调节免疫力等功效[3-4]。灵芝酸A和灵芝酸B是1982年首次从灵芝中分离出的三萜类化合物,具有抑制组织胺释放、降血脂、降血压、调节肝功能等作用[5]。在日本,正是因为灵芝酸的功效显著,人们非常看重灵芝商品中灵芝酸的含量,并把其作为衡量灵芝及其制品品质的重要指标。灵芝多糖也是灵芝的主要活性成分,其与多种药理活性有关,现代药理研究表明,灵芝多糖具有显著的提高免疫力、抗肿瘤、清除自由基、抗衰老等活性[6-12]。因此,灵芝多糖、三萜类化合物作为主要活性成分是评价灵芝品质高低的重要指标。然而,不同的提取方法对于灵芝有效成分的溶出具有较大的影响,前处理方法作为提取前的重要一环同样具有不可或缺的影响。
因此,试验对灵芝药材分别进行粗碎、粉碎、切薄片及切厚片4种处理方法后加水回流提取,测定出膏率及提取物中灵芝多糖、三萜及甾醇、灵芝酸A和灵芝酸B含量,比较不同处理方式有效成分的提取率,以筛选出有利于提取灵芝有效成分的药材处理方式。
1 材料与方法
1.1 材料与试剂
灵芝药材,山东省临沂金泰药业有限公司提供,经广东一方制药有限公司质量中心鉴定为多孔菌科真菌赤芝Ganoderma lucidum(Leyss.exFr.)Karst.的干燥子实体。
灵芝酸A对照品、灵芝酸B对照品,上海安谱实验科技股份有限公司提供;D-无水葡萄糖对照品、齐墩果酸对照品,中国食品药品检定研究院提供。
1.2 仪器与设备
UV-2450型紫外可见分光光度计,岛津仪器(苏州)有限公司产品;1260型高效液相色谱仪,安捷伦仪器有限公司产品;AB265-S/10型电子天平,梅特勒-托利公司产品。
1.3 试验方法
1.3.1 前处理
(1)粗碎处理。取灵芝药材,除去杂质,用破碎机(1.6 cm孔径筛网)打碎。
(2)粉碎处理。取灵芝药材,除去杂质,用破碎机(1.6 cm孔径筛网)打碎,后用高速粉碎机粉碎,使其全部通过10目。
(3)薄片处理。取灵芝药材,拣选除杂,切成0.1~0.2 cm的薄片。
(4)厚片处理。取灵芝药材,拣选除杂,切成0.2~0.4 cm的厚片。
1.3.2 提取工艺
前处理过的灵芝→加水回流提取3次(第1次加入10倍水,煎煮1.5 h;第2次加入8倍水,煎煮1.5 h;第3次加入5倍水,煎煮0.5 h) →过滤→浓缩→干燥→灵芝提取物。
1.4 含量测定
1.4.1 多糖含量测定
标准曲线的制作:取105℃干燥至恒质量的无水葡萄糖对照品6 mg,精密称定,加水溶解并定容至50 mL,制成每1 mL含0.12 mg的对照品溶液。分别精密量取对照品溶液 0.2,0.4,0.6,0.8,1.0,1.2 mL,分别置于10 mL具塞试管中,各加水至2.0 mL,迅速精密加入硫酸蒽酮溶液(精密称取蒽酮0.1 g,加硫酸100 mL使溶解,摇匀)6 mL,立即摇匀,放置15 min后,立即置冰浴中冷却15 min,取出,以相应的试剂为空白,于波长625 nm处测定吸光度,以吸光度为纵坐标、质量浓度为横坐标,绘制标准曲线。
供试品溶液的制备及含量测定:取灵芝提取物粉末约2 g,精密称定,置于圆底烧瓶中,加水60 mL,静置1 h,加热回流4 h,趁热滤过;用少量热水洗涤滤器和滤渣,将滤渣及滤纸置于烧瓶中,加水60 mL,加热回流3 h,趁热滤过,合并滤液,置于水浴上蒸干;残渣用水5 mL溶解,边搅拌边缓慢滴加乙醇75 mL,摇匀,在4℃放置12 h,离心,弃去上清液;沉淀物用热水溶解并转移至50 mL量瓶中,放冷,加水至刻度,摇匀;取溶液适量,离心,精密量取上清液3 mL,置于25 mL量瓶中,加水至刻度,摇匀,即得供试品溶液。精密量取供试品溶液2 mL,置10 mL具塞试管中,按照标准曲线制备项下的方法,自“迅速精密加入硫酸蒽酮溶液6 mL”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中无水葡萄糖的含量,计算后即得。
灵芝多糖标准曲线见图1。
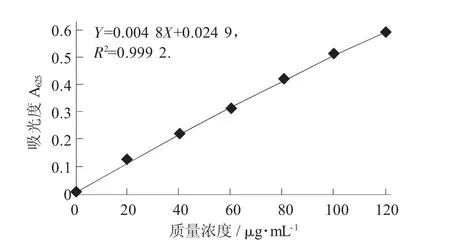
图1 灵芝多糖标准曲线
1.4.2 三萜及甾醇含量测定
标准曲线的制备:精密称取齐墩果酸对照品10 mg,置于50 mL容量瓶中,加甲醇溶解并定容至刻度,制成每1 mL含0.2 mg的溶液,即得对照品溶液。量取对照品溶液0.1,0.2,0.3,0.4,0.5 mL,分别置于15 mL具塞试管中,挥干,放冷,精密加入新配制的香草醛冰醋酸溶液(精密称取香草醛0.5 g,加冰醋酸使溶解成10 mL,即得) 0.2 mL、高氯酸0.8 mL,摇匀,在70℃水浴中加热15 min,立即置于冰浴中冷却5 min,取出,精密加入乙酸乙酯4 mL,摇匀,以相应试剂为空白,于波长546 nm处测定吸光度,以吸光度为纵坐标、质量浓度为横坐标绘制标准曲线。
供试品溶液的制备及含量测定:取灵芝提取物粉末约 2 g,精密称定,置具塞锥形瓶中,加乙醇50 mL,超声处理(功率140 W,频率42 kHz)45 min,滤过,滤液置于100 mL量瓶中,用适量乙醇,分次洗涤滤器和滤渣,洗液并入同一量瓶中,加乙醇至刻度,摇匀,即得供试品溶液。精密量取供试品溶液0.2 mL,置15 mL具塞试管中,照标准曲线制备项下的方法,自“挥干”起,同法操作,测定吸光度,从标准曲线上读出供试品溶液中齐墩果酸的含量,计算后即得。
灵芝三萜及甾醇标准曲线见图2。
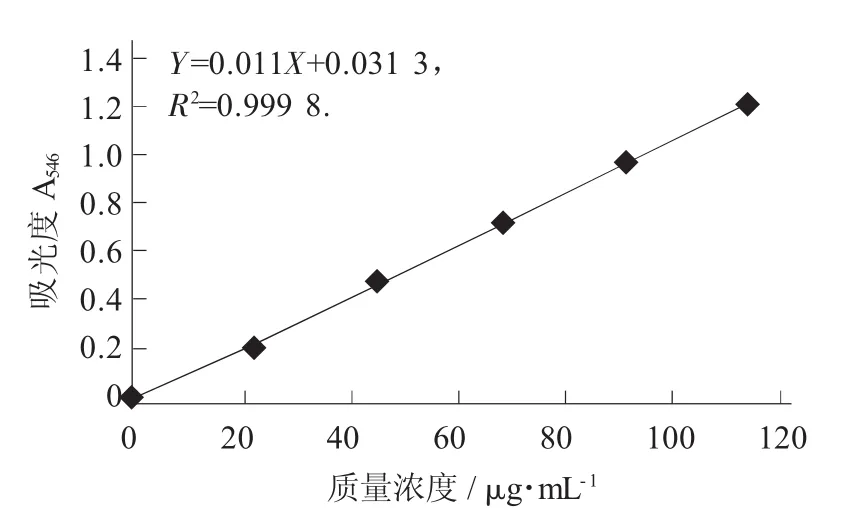
图2 灵芝三萜及甾醇标准曲线
1.4.3 灵芝酸含量测定
色谱柱:十八烷基硅烷键合硅胶柱(4.6 mm×250 mm,5 μm);以 0.4%甲酸为流动相 A,乙腈为流动相B,按下表中的规定进行梯度洗脱,流速为1.0 mL/min,检测波长254 nm,柱温25℃。
灵芝酸含量测定梯度洗脱见表1。

表1 灵芝酸含量测定梯度洗脱
对照品溶液的制备:取灵芝酸A和灵芝酸B对照品适量,精密称定,加甲醇溶解,制成每1 mL含0.25 mg的混合溶液,即得。
供试品溶液的制备:取灵芝提取物粉末2.5 g,精密称定,置50 mL容量瓶中,精密加入甲醇35 mL,超声处理40 min,放冷至室温,用甲醇定容至刻度,摇匀,取上清液用滤膜滤过,即得。
测定法:分别精密吸取对照品溶液、供试品溶液各10 μL,注入液相色谱仪,测定后即得。
灵芝酸标准品液相色谱图见图3。

图3 灵芝酸标准品液相色谱图
2 结果与分析
2.1 不同处理方法对灵芝提取吸水率和出膏率的影响
不同处理方法对灵芝提取吸水率和出膏率的影响见表2。
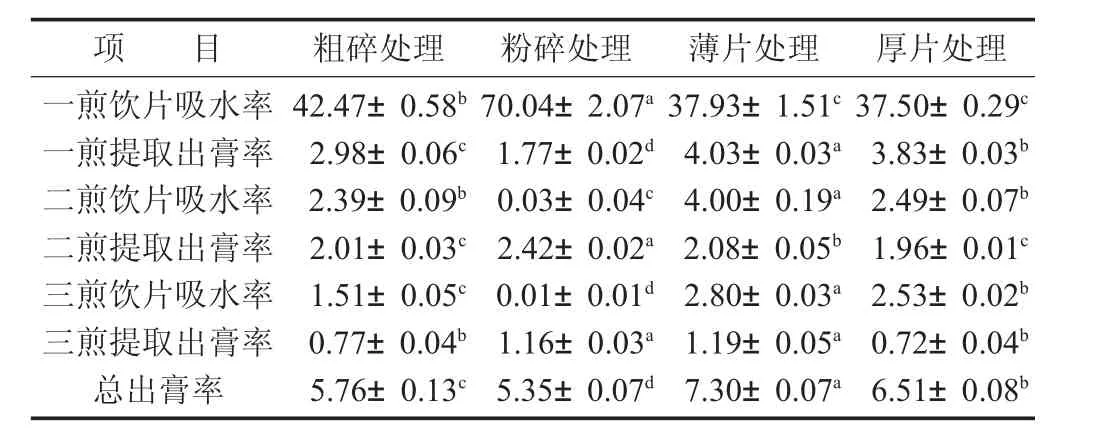
表2 不同处理方法对灵芝提取吸水率和出膏率的影响/%
由表2数据可知,不同灵芝药材的处理方式,对饮片吸水率有显著性(p<0.05)的影响,直接影响着灵芝提取溶出效果,导致了出膏率的变化。通过对比可以发现,粉碎处理后的灵芝在第1次煎煮时,吸水率高达70.04%,远高于粗碎、薄片及厚片处理的吸水率(37.5%~42.47%),而切薄片和切厚片对饮片吸水率影响并不显著(p>0.05)。同时,饮片一煎吸水率高的粉碎组,在一煎提取出膏率方面仅有1.77%,远低于其余3组处理(2.98%~4.03%)。最后,从总出膏率数据可以看出,不同的灵芝处理方式对总出膏率具有显著性差异(p<0.05),其中,灵芝切薄片处理的总出膏率最高,达到7.30%,是粉碎处理组的1.36倍;其次为厚片组,总出膏率为6.51%。
2.2 不同处理方法对灵芝多糖提取的影响
不同处理方法对灵芝多糖提取的影响见表3。
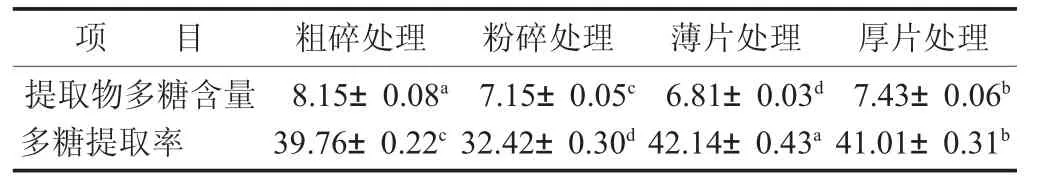
表3 不同处理方法对灵芝多糖提取的影响/%
由表3数据可知,不同处理方式所制得的灵芝提取物多糖含量及提取率差异显著(p<0.05)。提取物多糖含量依次为粗碎处理>厚片处理>粉碎处理>薄片处理,其中粗碎处理所制得的灵芝提取物多糖含量高达8.15%,远高于出膏率最高的薄片处理所得的灵芝提取物(6.81%),这是由于薄片组出膏率高,非多糖类物质溶出相对较多,导致提取物多糖含量整体偏低。而另一方面,多糖提取率大小依次为薄片处理>厚片处理>粗碎处理>粉碎处理,说明在固定提取条件下,切薄片处理后的灵芝饮片,更利于灵芝多糖的溶出,其提取率达到了42.14%;相反的,粉碎处理后的多糖提取率仅有32.42%,粉碎后饮片吸水率高的同时,也不利于多糖的溶出。
2.3 不同处理方法对灵芝三萜及甾醇提取的影响
不同处理方法对三萜及甾醇含量的影响见表4。
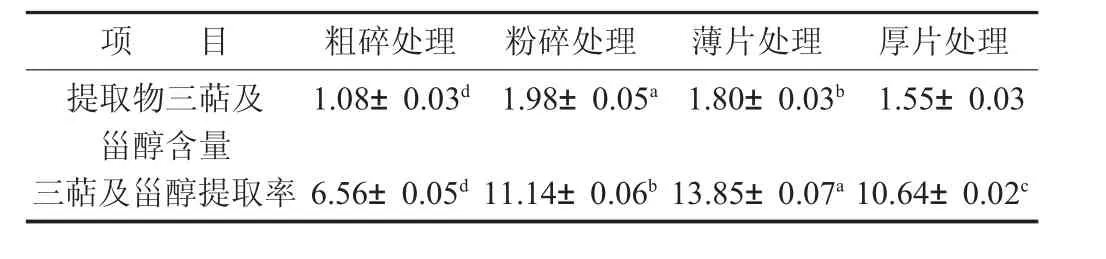
表4 不同处理方法对三萜及甾醇含量的影响/%
由表4数据可知,不同处理方式所制得的提取物三萜及甾醇含量及提取率差异显著(p<0.05)。提取物含量依次为粉碎处理>薄片处理>厚片处理>粗碎处理,粉碎处理后制得的灵芝提取物三萜及甾醇含量最高,达到1.98%,其次为薄片处理后制得的灵芝提取物,含量为1.80%;而在提取率方面,薄片处理的灵芝三萜及甾醇提取率最高,为13.85%,但4种处理方式的灵芝提取物三萜及甾醇提取率均不高,仅有6.56%~13.85%,处于较低水平,这是由于三萜及甾醇在热水中溶解度较低所造成的。另一方面,不同处理方式对三萜及甾醇提取率的影响规律与多糖提取率的影响规律也有较大的区别,如多糖提取率最高的粗碎处理方式,其三萜及甾醇提取率仅有6.56%,这也说明,不同的灵芝处理方式对不同的有效成分溶出有较大的影响。
2.4 不同处理方法对灵芝酸(A+B)提取的影响
不同处理方法对灵芝酸(A+B)含量的影响见表5。
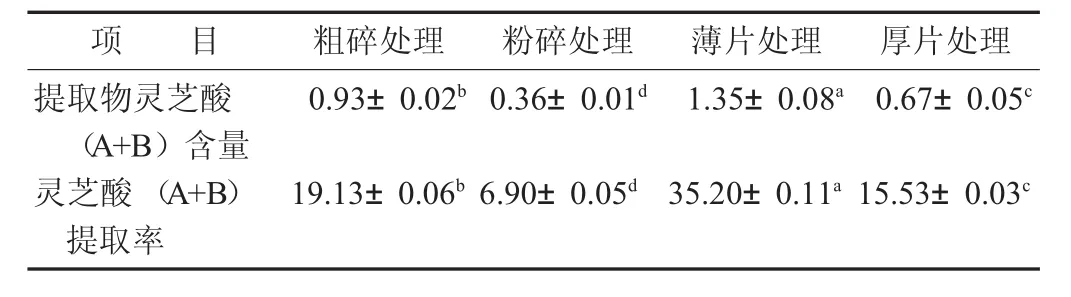
表5 不同处理方法对灵芝酸(A+B)含量的影响/%
灵芝酸是一种三萜类物质,大多为四环三萜。由表5数据可知,不同处理方式所制得的提取物灵芝酸(A+B)含量及提取率差异显著(p<0.05),其中薄片处理所制得的灵芝提取物含量最高,达到1.35%,其提取率也是最高的,达到35.2%,远高于其他处理方式的样品。灵芝酸的提取率除了薄片处理组外,其余均不高,这是因为灵芝酸在热水中的溶解度较低所造成的,但整体而言,灵芝酸(A+B)的提取率比三萜及甾醇的提取率高。
3 结论
试验发现,灵芝提取过程中饮片吸水率以薄片处理为最低,这样不仅利于灵芝多糖等水溶性成分的溶出,也利于三萜及甾醇、灵芝酸(A+B)等脂溶性成分的提取,避免有效成分过多残留在药渣中。结果表明,不同药材处理方式对灵芝出膏率、多糖提取率、三萜及甾醇提取率、灵芝酸(A+B)提取率的影响差异明显,以切薄片处理的灵芝药材更利于有效成分的提取。
目前,关于灵芝提取工艺的相关研究较多,如刘晓艳等人[13]利用响应面法优化灵芝三萜的提取工艺,得到较高的三萜得率,白凤岐等人[14]利用正交试验获得较优的灵芝多糖提取工艺,崔晓莹[15]通过比较不同的提取溶剂和提取方法,获得较理想的灵芝酸提取工艺,但研究均集中在提取溶剂、提取方法的选择上,且大部分现有灵芝提取工艺文献中前处理方法为破碎或粉碎处理,对灵芝药材前处理后,对于提取的影响还没有相关文献参考,试验通过对药材前处理方法的探讨,为进一步完善灵芝各项有效成分的溶出提供参考依据。
