不同盐度条件下葡萄糖对余氯等水质的影响
2019-04-11秦海鹏许威威廖栩峥胡世康刘雪婷郑义华苏玉芹孙成波
秦海鹏,许威威,王 博,廖栩峥,胡世康,刘雪婷,郑义华,苏玉芹,孙成波,2*
(1.广东海洋大学水产学院,广东湛江 524088;2.广东高校海产无脊椎动物养殖工程技术研究中心,广东湛江 524025)
含氯消毒制剂起消毒作用的是含氯的离子、分子、自由基等。余氯就是用含氯消毒制剂进行消毒,有效氯在一定时间与微生物、有机物、无机物等接触作用消耗一部分氯量后水中所残留的氯量,余氯可分为化合性余氯和游离性余氯,而总余氯即化合性余氯与结合性余氯之和[1]。作为一种有效的杀菌消毒手段,因其使用方便且价格低廉等原因,含氯消毒制剂被广泛应用于水产养殖、食品加工、饮水、工业水处理、医院、卫生、防疫等领域[2]。只要水中保持一定量的余氯,就能有效地抑制微生物的繁殖。但在使用含氯消毒制剂后残留的余氯出现的一些问题也日益显现。目前,各处医院在污水处理、余氯保持量和余氯测定方面均存在一些问题,有些医院氯化消毒管理不完善,排放的污水中总余氯含量高于国家规定。此外,发达的农副业、工业冷却水和自来水处理使用的含氯消毒剂更是巨量,排放了大量的余氯。这种使用氯来处理的外排污水每升含有数毫克至数百毫克的余氯,对水产养殖业造成了严重的污染[3]。我国《生活饮用水卫生标准》规定:氯与水在接触30 min后不得低于0.3 mg/L,但在渔业用水中,如果余氯高达0.02 mg/L以上,则会对鱼虾黏膜造成强烈的腐蚀伤害,超过0.01 mg/L可能会使一些敏感的鱼虾致死[4]。研究表明,如果水体余氯含量为0.014~0.029 mg/L时,金鱼在接触96 h后有50%死亡;如果水中余氯达0.65~10.10 mg/L时,藻类在接触5~10 min后生长明显受到抑制,但因为医院、工业等外排污水进入湖泊、水库、鱼塘,时有大量死鱼的现象发生[5]。不仅如此,氯是一种活泼的氧化剂,杀死致病微生物时也容易与水中的有机物作用产生具有很强致突变性和致癌的物质,如三氯甲烷等[6]。因此,在工农业用水尤其是生活饮用水等余氯含量的控制显得极为重要,降低余氯含量可解决很多问题。当前对含氯消毒制剂的研究日益增多,但对余氯的去除研究鲜见报道。目前,余氯处理主要有2种方法,即化学氧化还原和活性炭处理。张怀旭等[7]研究表明,活性炭能高效去除余氯,其作用机理是吸附和化学反应的结果,且在去除余氯的过程中,接触时间越长,去除余氯量越大。周建斌等[8]研究表明,竹炭对水中余氯有较好的去除效果。笔者选用化学氧化还原方法,研究余氯的去除效果,并分析水体中微生物的生长衰亡对水体中三氮的影响,以及余氯对水体pH的影响,旨在为水体余氯去除提供参考。
1 材料与方法
1.1试验材料葡糖糖(分析纯)、生产用漂粉精、海水晶调配的各个盐度海水。
1.2试验方法使用12个50 L白桶,随机将白桶分成盐度0、10、20、30这4个组,每个盐度设置3个平行组。每组葡萄糖和漂粉精用量均为50 mg/kg。漂粉精在投放葡萄糖前24 h开始加入水中,不对水进行曝气。
1.3测定项目与方法
1.3.1总余氯。总余氯开始测定是在加入葡萄糖0 h进行,此后每隔1 h采集水样测定白桶水中的总余氯含量,直到其中一个盐度条件下的总余氯浓度降至0。其余各项指标在添加葡萄糖后各测定1次,此后每隔24 h定点测定1次,连续测定7 d。
1.3.2细菌。试验水样的总菌数目与弧菌数量的测定均采用平板计数法。用营养琼脂培养基测定可培养细菌数量,弧菌数量的测定采用TCBS培养基[9]。
1.3.3水质因子。水质理化性质的测定包括总余氯、pH、氨氮、硝酸盐、亚硝酸盐。根据养殖水环境化学试验[10],水体氨氮的测定采用靛酚蓝分光光度法;硝酸盐的测定采用锌-镉还原法分光光度法;亚硝酸盐的测定采用盐酸萘乙二胺分光光度法;总余氯的测定采用N,N-二乙基-1,4-苯二胺滴定法。
1.4数据处理试验数据采用Excel 2010软件统计分析,用SPSS 17.0进行显著性差异分析。
2 结果与分析
2.1不同盐度条件下葡萄糖对余氯的去除效果由图1可知,4个不同盐度梯度下水体中的余氯含量均不同程度的降低,在0 h时4个盐度梯度的余氯浓度表现为盐度0>盐度10>盐度20>盐度30,但在0 h后盐度30的余氯浓度显著低于其他3组(P<0.05)。当水体盐度为0的试验组中,0~6 h时,余氯降低率为12.41%;0~30 h时,余氯降低率为26.55%。当水体盐度为10时,在0~6 h时,余氯降低率为70.00%;在0~30 h时,余氯降低率为91.84%。当水体盐度为20时,在0~6 h时,余氯降低率为69.40%,在0 ~30 h时,余氯降低率为95.15%。当水体盐度为30时,在0~6 h时,余氯降低率为67.72%,在30 h时,余氯含量为0,0 ~30 h时,余氯降低率为100%。
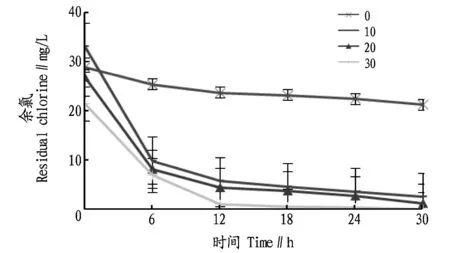
图1 不同盐度条件下葡萄糖对余氯的去除效果Fig.1 Removal effects of glucose on residual chlorine under the different salinities
2.2不同盐度条件下弧菌数目的变化由图2可知,盐度为0时,在0、24、48、72、96、120、144 h时,弧菌数量均为0,弧菌无法生长。在盐度为10时,在0、24、48 h时,弧菌数量为0,在48 h后,弧菌开始出现,并在96 h达到顶峰,此时弧菌数量为(23±10)CFU/mL;在96 h后弧菌数量陡降。在盐度为20时,在0、24、48 h时弧菌数量也为0,在48 h后弧菌开始出现,并在96 h达到顶峰,在96 h后弧菌开始消亡,96 h时弧菌数量为(33±15)CFU/mL。在盐度为30时,在0、24、48 h时未检测到弧菌,在48 h后弧菌开始出现,并在96 h弧菌数量达到最大,为(46±9)CFU/mL,弧菌在96 h后逐渐消亡。方差分析结果表明,在96 h时,4组之间差异显著(P<0.05)。
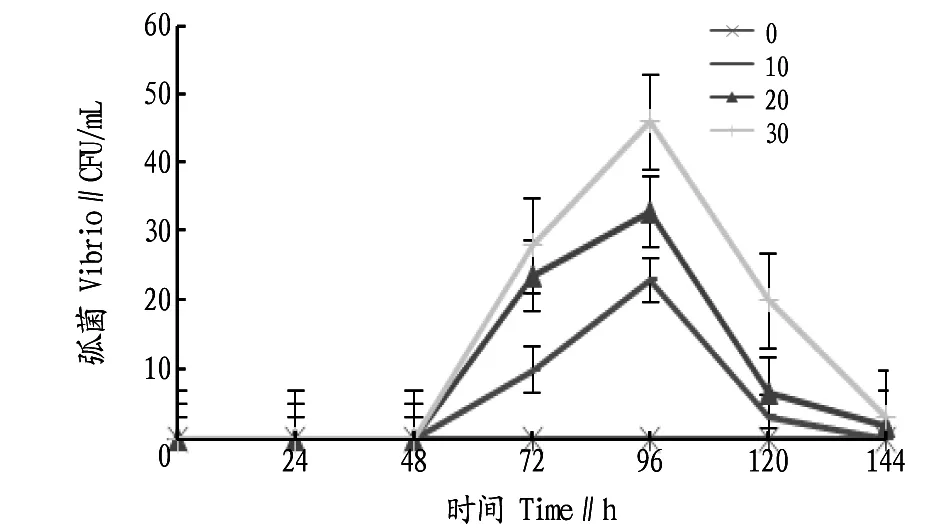
图2 不同盐度条件下弧菌数目的变化Fig.2 Changes in the number of vibriones under the different salinities
2.3不同盐度条件下总菌数目的变化由图3可知,4个不同盐度梯度下的总菌数目在24 h后不同程度的增长,经过一段时间后开始减少。在盐度为0时,细菌在24 h后开始出现但增长速度缓慢,直到120 h才达到顶峰,此时细菌总数为(3 100±361)CFU/mL。在盐度为10时,细菌数目在120 h时达到最大,为(32 667±5 508)CFU/mL。在盐度为20时,细菌在24 h后开始出现,并经过24~72 h的缓慢增长,在72~96 h时暴发式增长,在96 h总菌量最大,为(28 667±2 516)CFU/mL。在盐度为30时,细菌在24 h开始出现,然后缓慢增长并在120 h达到最大,为(4 300±149)CFU/mL。
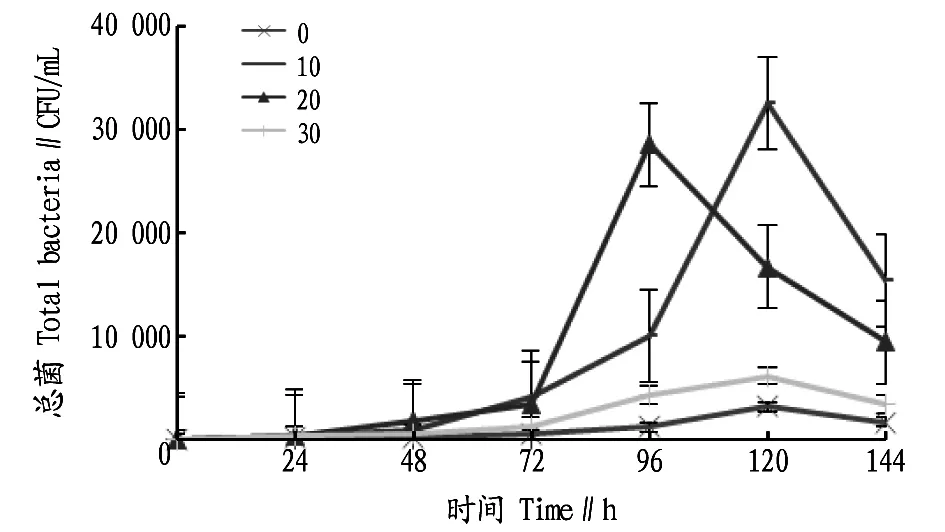
图3 不同盐度条件下总菌数目的变化Fig.3 Changes in the number of total bacteria under the different salinities
2.4不同盐度条件下pH的变化由图4可知,在7个时间点内盐度为0时水体的pH比其他3个盐度梯度的pH均高,盐度10、20、30这3个盐度梯度的水体pH在各个时间点上均较接近,盐度0与另外3组差异显著(P<0.05),盐度10、20、30之间差异不显著(P>0.05)。在盐度为0时,pH在7个时间点上保持为9.00左右。在盐度为10时,在24 h时pH比0 h降低了11.58%,在24 h后5个时间点pH在7.79左右微小波动,趋势平缓。在盐度为20时,0、24 h的pH分别为8.67±0.064和7.68±0.050,24 h时的pH比0 h降低了11.41%,在24 h后的5个时间点pH波动很小。盐度为30时,0、24 h时的pH分别为8.63±0.010和7.70±0.031,24 h时的pH比0 h降低了10.77%,在96 h时pH为试验过程中最小值,为7.51±0.047。

图4 不同盐度条件下pH的变化Fig.4 Changes of pH value under the different salinities
2.5不同盐度条件下氨氮浓度的变化由图5可知,在7个时间内4个盐度梯度的氨氮变化趋势是缓慢升高然后上升速度逐渐变快,最后快速下降,盐度为30的氨氮浓度在96 h达到最大,其他3个盐度梯度的氨氮浓度则在120 h达到最大。在盐度为0时,120 h时氨氮浓度比0 h升高了97.58%,144 h时的氨氮浓度比120 h时降低了13.06%。盐度为10时,120 h氨氮浓度比0 h升高了229.65%,144 h时的氨氮浓度比120 h时降低了11.92%。盐度为20时,120 h时氨氮浓度比0 h升高了213.93%,144 h的氨氮浓度比120 h时降低了13.12%。盐度为30时,96 h的氨氮浓度比0 h升高了160.50%,120 h时的氨氮浓度比96 h降低了14.83%。
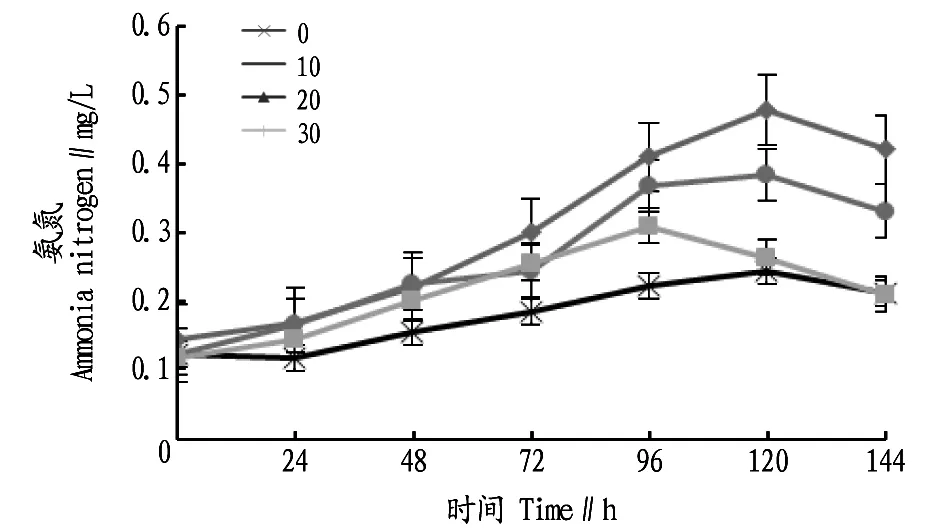
图5 不同盐度条件下氨氮浓度的变化Fig.5 Changes of ammonia concentration under the different salinities
2.6不同盐度条件下硝酸盐浓度的变化由图6可知,在7个时间内4个盐度梯度的硝酸盐变化趋向于平缓,波动不大,4个组之间差异不显著(P>0.05)。在盐度为0时,在0 h后的6个时间点,硝酸盐的浓度与0 h相差不大。在盐度为10时,各时间点的硝酸盐浓度差异微小。在盐度为20时,与0 h时硝酸盐浓度相比,之后的6个时间点均比其大,但差异微小。在盐度为30时,各时间点的硝酸盐浓度变化不大,差异微小。
图6 不同盐度条件下硝酸盐浓度的变化Fig.6 Changes of nitrates concentration under the different salinities
2.7不同盐度条件下亚硝酸盐浓度的变化由图7可知,在7个时间点内4个盐度梯度的亚硝酸盐含量在0~72 h出现微小波动,但72 h后开始略有升高且在升高后保持稳定。在盐度为0时,亚硝酸盐浓度在72 h后有所升高;在盐度为10时,亚硝酸盐浓度在72 h后升高,之后保持稳定;在盐度为20时,亚硝酸盐浓度在96 h后明显升高并保持稳定;在盐度为30时,96 h后亚硝酸盐浓度开始有所上升并保持稳定。方差分析结果表明,4个组之间差异不显著(P>0.05)。
图7 不同盐度条件下亚硝酸盐浓度的变化Fig.7 Changes of nitrate concentration under the different salinities
3 结论与讨论
葡萄糖是一种具有还原性的单糖,它的结构式中有5个羟基和1个醛基,分子上的醛基决定其还原性。漂粉精的主要成分是次氯酸钙,当它溶于水中时生成次氯酸[11]。具有还原性的葡萄糖与具有强氧化性的次氯酸接触会发生氧化还原反应,从而使水体中的次氯酸物质减少,达到去除目的。随着反应的进行,葡萄糖与次氯酸的浓度减少,化学反应速度变得缓慢。比较4个盐度梯度各个时间点的余氯浓度,盐度30时的余氯浓度各时间点均最小,且最先降至0。在这4个盐度梯度中,在30 h时,盐度0、10、20、30的降低率分别为26.55%、91.84%、95.15%、100%,可见盐度为30时,葡萄糖对余氯的去除效果最佳。
漂粉精的强氧化特性,使其能够高效消毒且能杀死水中的藻类及其他生物,高浓度的有效氯更是能灭杀水体中所有生物[12]。该试验中,0 h时4个盐度梯度中余氯最小的浓度为21.4 mg/L,足以将试验水体的生物灭杀。因此,在0、24、48 h没有细菌或数量极少。由于海水中有残留下来的有机物质,为后来细菌的滋生提供了可能性,因此在48 h后细菌开始暴发式增长,在达到最大容纳量后细菌开始消亡。弧菌的出现与增长规律与测得的总菌数据近似。水体中残留的余氯使细菌的生长受限,由于盐度0时余氯衰减缓慢,水中保留的余氯使得细菌难以滋生,在试验过程中盐度为0的水体未测出细菌。此外,盐度10和盐度20的海水中细菌生长也受余氯的影响。高盐度的海水能抑制某些细菌的生长,低盐度的海水更适合许多细菌的生长,盐度为30时的海水细菌数量少于盐度10和20时的细菌数量[13]。
漂粉精的主要成分是次氯酸钙,同时还含有少量氯化钙或氢氧化钙等。次氯酸钙是强碱弱酸盐,溶于水后呈碱性[14]。加入葡萄糖后水体中发生氧化还原反应,降低了碱性。在盐度为0时,由于水体中只有漂粉精,水体的pH保持在9.00左右。盐度10、20、30均在加入葡萄糖后pH降低,然后保持稳定。
根据氮循环的规律,从氮的来源及去向2条途径分析,含氮有机物通过氨化作用转化为氨氮,氨氮在有氧条件下通过硝化作用转化为亚硝酸盐和硝酸盐,亚硝酸盐和硝酸盐在
缺氧条件下通过反硝化作用可转化为氮气[15]。该试验7 d中,4个盐度梯度的氨氮浓度曲线走势相似,先升高再略降低;亚硝酸盐浓度曲线的走势在试验前期平缓波动,在试验后期有所升高;硝酸盐浓度曲线的走势在0.25 mg/L处平缓波动。细菌是在24 h后开始出现,水体中的含氮有机物开始被分解,随着细菌数量递增氨氮被释放,在细菌开始消亡后,氨氮的浓度受到制约,不再增长。亚硝酸盐浓度在初期变化不大,是受到亚硝化菌的制约,之后随着细菌数量增大,也出现波动有略微的升高,但可能细菌中含有的亚硝化细菌数量只有很少部分,导致亚硝酸盐浓度变化不显著。硝酸盐是经过硝化作用转化而来,由于亚硝酸盐只含少量以及缺少足够的硝化细菌,导致亚硝酸盐转化为硝化盐的通道缺失,因此水体中的硝酸盐浓度无明显的变化[16]。
