鲁氏酵母菌对发酵香肠品质的影响研究
2019-04-11,,,,
,,,,
(黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319)
发酵香肠是指在自然或人工控制条件下,利用微生物和酶的发酵作用[1],制成具有稳定贮藏性能、典型发酵风味及诱人色泽等特性的肉制品[2,3]。目前广泛使用的是乳酸菌,乳酸菌能将原料中的碳水化合物分解为乳酸,使产品的pH值下降,起到抑制病原菌及腐败菌,延长货架期的作用,同时发酵碳水化合物产生的乙酸和乳酸,会产生某些挥发性风味物质[4,5],可赋予产品特有的风味和坚实的质地[6]。
鲁氏酵母菌(Zygosaccharomycesrouxii)是传统豆酱、酱油酿造过程中重要的风味微生物,是最常见的嗜高渗透压酵母菌[7,8]。研究发现,Z.rouxii的生长并不影响发酵的进程,且对产品风味物质的形成及在发酵后熟阶段香气成分的产生起到积极作用[9,10]。酵母菌是发酵肉制品中常用的微生物,赋予产品酵母香味,但酵母产酸能力较弱,不具备还原硝酸盐的能力,可能减弱肉中固有微生物菌群的硝酸盐还原能力,因此,在肉制品加工中,多采用复配菌种制备发酵产品[11]。
本研究前期对鲁氏酵母菌在肉制品中的发酵性能及安全性能进行了评价,试验得出鲁氏酵母菌可以应用于肉制品发酵,本试验将鲁氏酵母菌和分离自传统发酵香肠的植物乳杆菌作为发酵剂,混合制作发酵香肠,研究对发酵香肠理化品质、微生物指标及感官品质的影响,探讨将鲁氏酵母菌加入发酵香肠中的适用性,以拓宽发酵剂的种类及鲁氏酵母菌的应用领域。
1 材料与方法
1.1 材料与仪器
1.1.1 试验原料
原料肉:购自北京华联超市;肠衣:购自天津市利成肠衣厂;YPD液体培养基、MRS肉汤培养基、NB肉汤培养基、琼脂糖:青岛高科技工业园海博生物技术有限公司。
1.1.2 菌种来源
鲁氏酵母菌(编号:32899):中国工业微生物菌种保藏管理中心;植物乳杆菌:分离自传统发酵香肠。
1.1.3 仪器设备
色彩色差计 日本柯尼卡美能达有限公司;Scientz-04无菌均质器 宁波新芝生物科技股份有限公司;MB 45水分测定仪 瑞士奥豪斯仪器有限公司;H1850 R型医用冷冻离心机 湖南湘仪实验室仪器开发有限公司;SW-CJ-1 FD型超净工作台 苏州安泰空气技术有限公司。
1.2 试验设计及方法
1.2.1 发酵香肠的生产工艺
1.2.1.1 基本工艺流程
肥膘(切丁)、瘦肉(绞碎)→腌制→接种→灌肠→发酵成熟→真空包装。
1.2.1.2 基本配方
将瘦肉剔除筋膜、绞碎(绞肉机筛板孔径为3 mm),背膘手工切成3 mm见方的丁状,生产发酵香肠时,肥瘦比为1∶9,其他调料按肉重计,玉泉大曲1%,葡萄糖5%,味素0.3%,盐2%,NaNO20.01%,发酵剂106cfu/g。
1.2.2 试验设计
将试验分成4组,分别为:未添加菌种,添加鲁氏酵母菌,添加植物乳杆菌,添加鲁氏酵母菌及植物乳杆菌的复配菌种。
在各组发酵香肠的发酵成熟过程中,每隔3天对发酵香肠的色差、水分含量、pH值、乳酸菌数、酵母菌数和细菌总数进行测定,并对最终的4组发酵香肠进行感官评定。
1.2.3 试验方法
1.2.3.1 色差的测定
将样品去除肠衣,挑出脂肪颗粒,均匀平铺于托盘。色差仪接通电源,确保使用D60,10°标准光源,先利用仪器自带白板进行矫正,然后将样品置于色差仪反射区(57 mm),将反射区完全覆盖进行测量,记录L*,a*,b*值。并计算色差影响参数e值[12],作为评判发酵香肠色泽的主要参数,该值表示亮度和偏黄度影响下样品的偏红度值。
式中:a*为香肠的红度值;b*为香肠的黄度值;L*为香肠的亮度值。
1.2.3.2 水分含量的测定
将样品去除肠衣备用,接通水分含量仪电源,取铝盘放入仪器中清零,将样品剪碎,均匀平铺于铝盘内,样品大于0.5 g即可测量,记录数值。
1.2.3.3 pH的测定
取10 g样品于无菌均质袋中,加入无菌生理盐水90 mL,用均质器高速均质30 s,使其分散均匀。取上述均质液,用校准好的pH计直接测定其pH值,并记录。
1.2.3.4 乳酸菌数的测定
无菌环境下将发酵香肠去肠衣,用无菌剪刀将其剪碎,取样10 g,放入含有90 mL无菌生理盐水的无菌均质袋中,高速均质1 min,然后取1 mL上清液进行加倍递增稀释,稀释至10-6,稀释梯度做3个重复,用MRS培养基平板涂布计数。乳酸菌培养条件:30 ℃/48 h。
1.2.3.5 酵母菌数的测定
同上乳酸菌数测定操作,培养基选用YPD培养基,并于28 ℃培养。
1.2.3.6 菌落总数的测定
同上乳酸菌数测定操作,培养基选用NB培养基,并于28 ℃培养。
1.2.3.7 感官评定
采用感官评定之描述定量分析法(quantitative described analysis,QDA)[13],由具有食品专业背景的成员组成感官评定小组,以外观20分、质地30分、风味50分为标准进行评定,评定标准见表1。
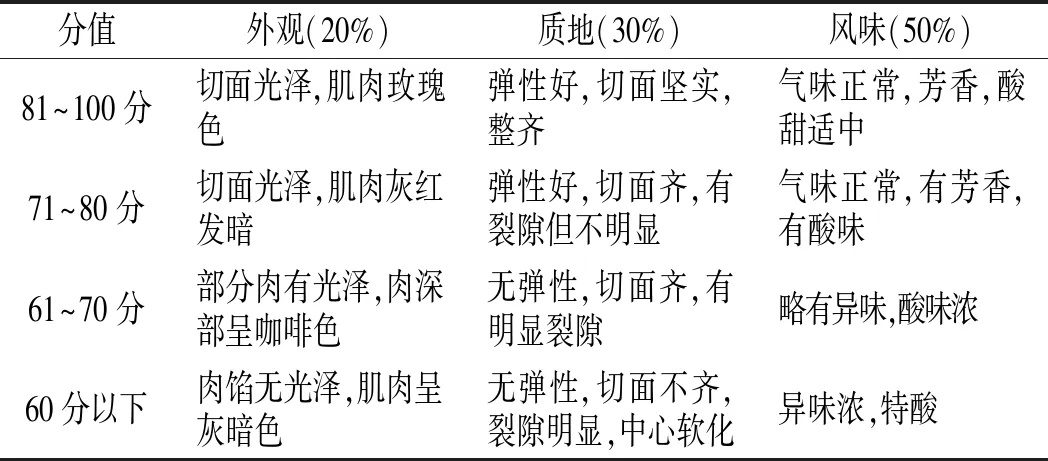
表1 发酵香肠感官评分标准Table 1 Sensory evaluation standards of fermented sausages
1.3 数据分析
2 结果与分析
2.1 不同组发酵香肠理化指标分析
2.1.1 色差的测定
用TCP 2全自动色差计测定,其结果用L*(亮度值)、a*(红度值)、b*(黄度值)系统表示。本研究引入了影响参数e值作为评判香肠色泽的主要参数。
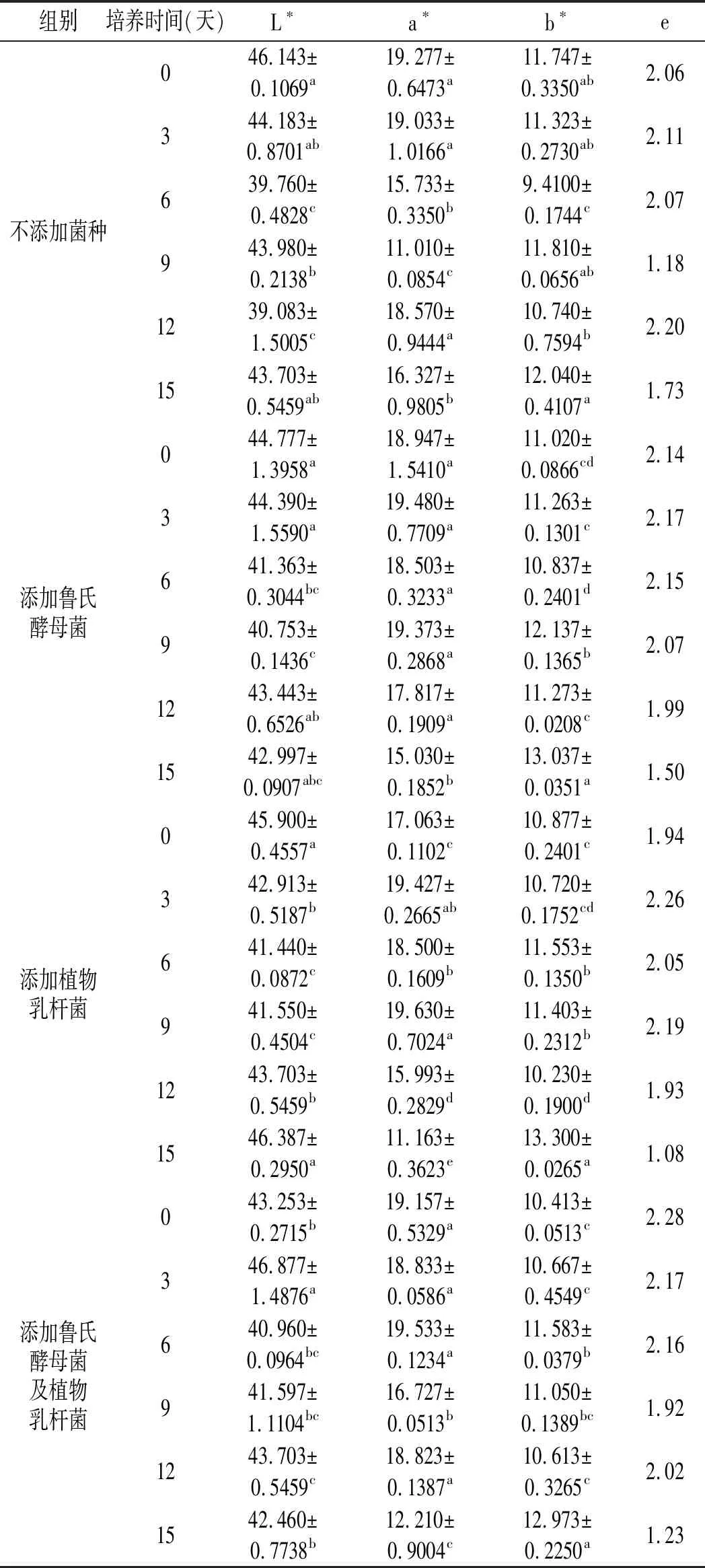
表2 不同组发酵香肠发酵过程中的色差值变化Table 2 Changes of chromatic aberration in different groups of fermented sausages during fermentation
注:同一列不同小写字母表示差异显著,P<0.05。
由表2可知,未添加菌种和仅添加乳酸菌的发酵香肠的e值在整个发酵成熟过程中呈现先上升后下降而后又缓慢上升又下降的趋势,添加鲁氏酵母菌的发酵香肠的e值则处于先上升而后缓慢下降的趋势,而第4组添加鲁氏酵母菌及植物乳杆菌的发酵香肠的e值则呈现缓慢下降而后上升再下降的趋势。首先,未添加菌种和常规的添加乳酸菌制作的发酵香肠在发酵3天时的e值分别为2.11,2.26,说明添加传统的乳酸菌作为发酵剂可以促进呈红色的亚硝酸肌红蛋白和亚硝酸血红蛋白的合成,使发酵香肠呈色明显。而添加鲁氏酵母菌的发酵香肠在发酵过程中的e值最高为2.17,且在发酵后熟阶段e值呈下降趋势,可能是由于鲁氏酵母菌对促进发酵香肠发色的蛋白合成能力较弱。在添加2种菌种的发酵香肠中,发酵初期的e值便高达2.28,在发酵过程中e值处于缓慢下降阶段,说明应用鲁氏酵母菌及乳酸菌的复合发酵剂不会减弱乳酸菌的发色作用,同时也不会因鲁氏酵母菌而抑制发酵香肠的发色。试验说明,鲁氏酵母菌不会减弱发酵剂在发酵期间对发酵香肠色泽的显著影响。
2.1.2 水分含量的测定
发酵香肠在发酵过程中的水分含量,可以直观、迅速地说明发酵香肠的产品品质。
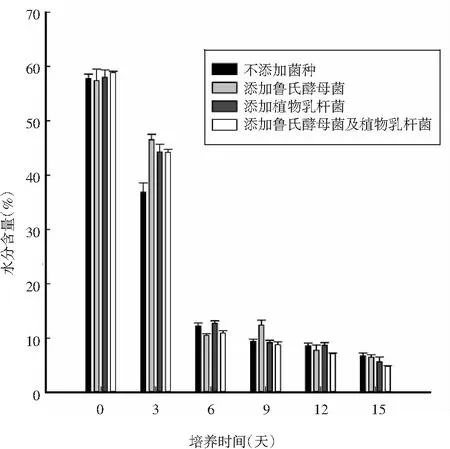
图1 不同组发酵香肠发酵过程中的水分含量变化Fig.1 Changes of moisture content in different groups of fermented sausages during fermentation
由图1可知,4组发酵香肠在发酵初始阶段的水分含量相近,并随着发酵时间的增加,水分含量逐渐降低。在发酵初始至发酵6天时,4组发酵香肠的水分含量均明显降低,且在发酵3天时,未添加菌种的发酵香肠的水分含量较其他组较低,可能是由于添加发酵菌种的发酵香肠在发酵初期菌种的活性较高,可能会在该阶段控制水分的流失,以促进发酵剂在发酵香肠中的作用[14,15]。在发酵6~15天时,4组发酵香肠的水分含量均缓慢下降,且添加鲁氏酵母菌和植物乳杆菌的发酵香肠水分含量最低,说明添加发酵菌种的发酵香肠中的菌种在6 天后生长速度缓慢或止步,进而促使水分降低,加速发酵进程。试验说明,添加鲁氏酵母菌并不影响发酵剂在发酵香肠中降低水分含量,缩短发酵时间的作用。
2.1.3 pH值的测定
发酵香肠在发酵过程中,由于微生物及酶对碳水化合物的分解作用,促使乳酸等有机酸大量生成,致使香肠的pH值在此过程中急剧下降[16]。
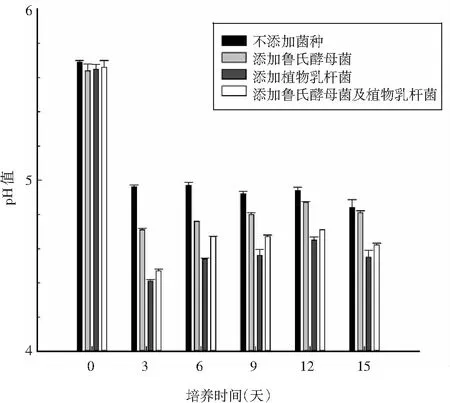
图2 不同组发酵香肠发酵过程中的pH值变化Fig.2 Changes of pH values in different groups of fermented sausages during fermentation
由图2可知,在发酵初期阶段,4组发酵香肠的pH值相近,随着发酵时间的增加,pH值均明显降低,且未添加菌种的发酵香肠的pH值显著高于其他3组添加菌种的发酵香肠,由此可知降低pH值可抑制香肠中腐败菌的生长繁殖,从而提高香肠的品质和安全性,而添加发酵剂可加速碳水化合物发酵产酸的速度,从而加快香肠发酵成熟的速度。在发酵过程中,pH值的大小排序大致为:添加鲁氏酵母菌的发酵香肠的pH值>添加鲁氏酵母菌和植物乳杆菌的发酵香肠的pH值>传统添加植物乳杆菌的发酵香肠的pH值,可能是由于低酸度环境对氨基酸脱羧酶有较强的抑制作用,低酸香肠可限制有害生物胺的产生,故而传统会选择添加植物乳杆菌系列的乳酸菌而降低香肠中的pH值,而添加2种菌种的发酵香肠中的植物乳杆菌同样发挥了乳酸菌的作用。在后续干燥成熟过程中,4组发酵香肠的pH值缓慢上升,可能因香肠中微生物及酶的作用,分解产生一些含氮物质,致使pH值开始缓慢上升。试验表明,添加鲁氏酵母菌不影响发酵剂有助于发酵香肠的pH值变化,促进发酵香肠的发酵成熟的作用。
驮子盯着周小羽,周小羽的眼睛里充满了水,但他却咬着嘴唇,硬是没让眼泪滴下来。在眼泪没滴下来的时候,周小羽的嘴巴里终于有了声音——
2.2 不同组发酵香肠微生物数量分析
2.2.1 不同组发酵香肠乳酸菌数的变化
发酵香肠中乳酸菌的消长反映了发酵动态过程,研究乳酸菌在发酵过程中的数量变化,有助于改进发酵工艺,控制发酵进程。
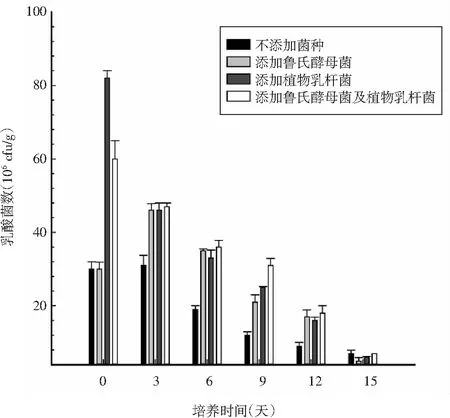
图3 不同组发酵香肠发酵过程中的乳酸菌数的变化Fig.3 Changes of lactic acid bacteria number in different groups of fermented sausages during fermentation
由图3可知,发酵初期,添加植物乳杆菌及添加鲁氏酵母菌和植物乳杆菌的2组发酵香肠的乳酸菌数最高,说明在这2组发酵香肠中乳酸菌将成为香肠内的优势菌,这对抑制香肠内不良微生物的生长繁殖具有重要意义。发酵3天后,未添加菌种及添加鲁氏酵母菌的2组发酵香肠的乳酸菌数有所增加,其他2组发酵香肠的乳酸菌数有所下降,可能是因为自然发酵状态下,未添加乳酸菌的发酵香肠自然产生乳酸菌,从而促进香肠的发酵,而添加乳酸菌的2组发酵香肠随着发酵时间的增加,乳酸菌的活性逐渐降低,致使乳酸菌的总数下降,该现象符合客观事实。试验表明,鲁氏酵母菌不会影响发酵香肠中乳酸菌的生长,复配菌中的鲁氏酵母菌亦不会产生不利影响。
2.2.2 不同组发酵香肠酵母菌数的变化
酵母菌是发酵肉制品中常用的微生物,添加酵母菌有助于发酵香肠中风味物质的产生,因此研究酵母菌数在发酵过程中的变化,有助于推进鲁氏酵母菌在发酵香肠中的进一步应用。
由图4可知,发酵初期,添加鲁氏酵母菌的2组发酵香肠的酵母菌数较高,说明在发酵初期酵母菌将充分利用发酵香肠的优势环境迅速生长成为优势菌,促进发酵香肠香气物质的形成。在发酵3天后,未添加鲁氏酵母菌的2组发酵香肠中酵母菌的数量先增加而后降低,由于在自然条件下发酵,香肠本身会产生一定数量的酵母菌,分解蛋白质产生醇类、醛类及酮类等,改善风味的物质,随着时间的增加,香肠中的环境逐渐不适合酵母菌的生长,因此会出现下降趋势,符合客观事实。试验说明,鲁氏酵母菌能够在发酵香肠中良好生长。

图4 不同组发酵香肠发酵过程中的酵母菌数变化Fig.4 Changes of yeast number in different groups of fermented sausages during fermentation
2.2.3 不同组发酵香肠菌落总数的变化
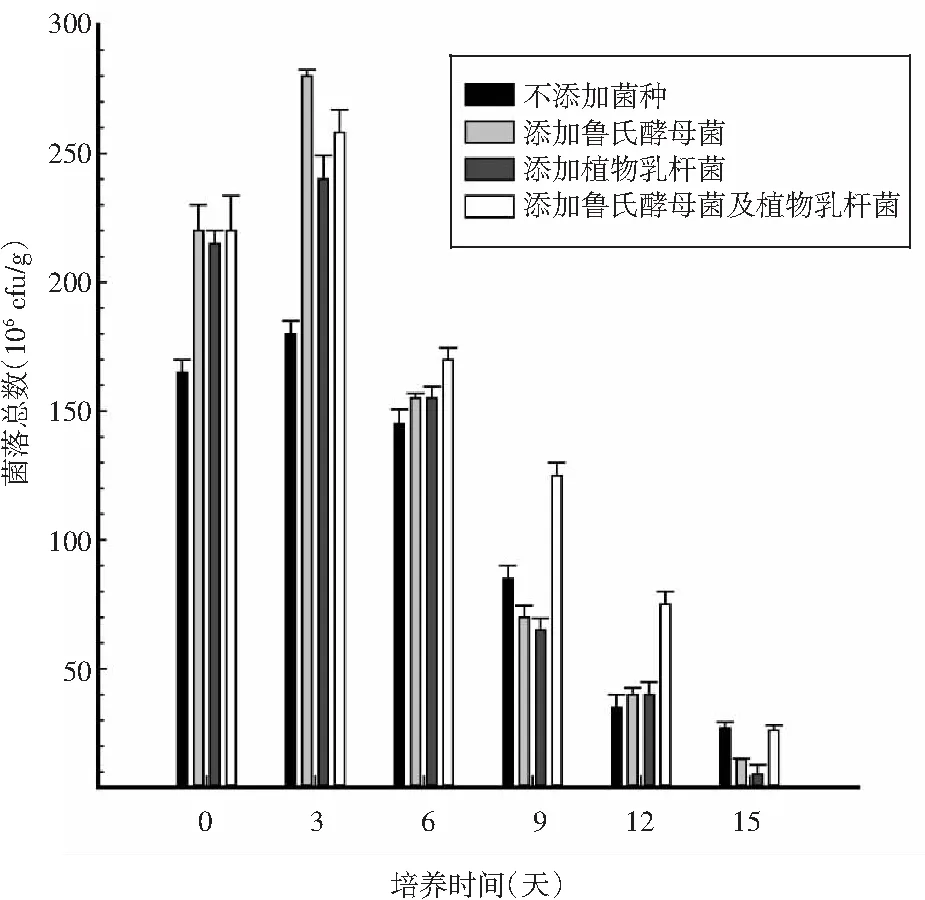
图5 不同组发酵香肠发酵过程中的菌落总数变化Fig.5 Changes of total bacterial count in different groups of fermented sausages during fermentation
发酵剂是制作发酵香肠的关键,研究发酵香肠中菌落总数的变化,能够更准确地掌握微生物对发酵香肠感官品质的影响。
由图5可知,4组发酵香肠发酵过程中菌落总数呈先增长后降低的趋势。发酵初期,添加发酵菌种的3组发酵香肠呈对数增长,未添加发酵菌种的发酵香肠的菌落总数明显较低,说明添加发酵剂后的发酵香肠的内部微生物数量较多,并与发酵香肠中的内源微生物一起良好生长。试验说明,鲁氏酵母菌能够存活在发酵香肠中并良好生长。
2.3 不同组发酵香肠感官评分
感官评分能够最直观地说明大众对于新产品研发结果的接受程度,也是对产品进行评价最准确的指标。
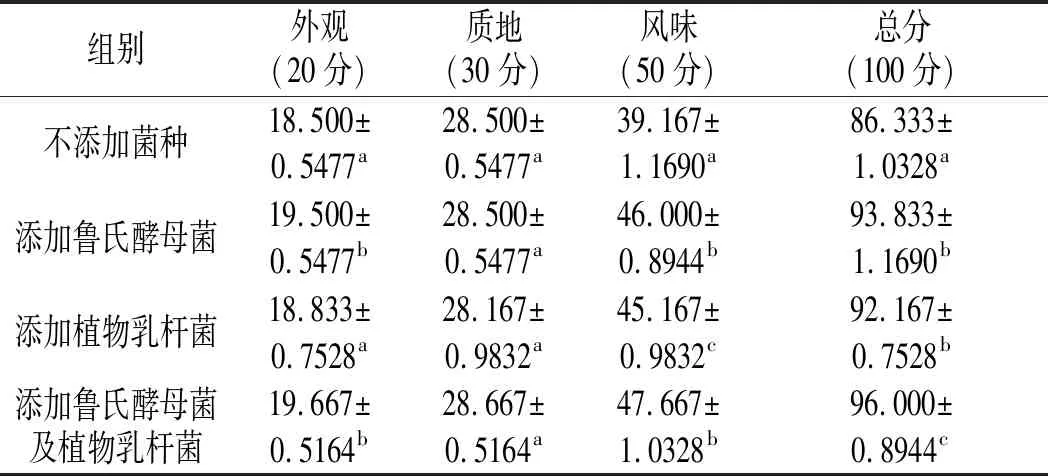
表3 不同组发酵香肠的感官评分表Table 3 Sensory scores of different groups of fermented sausages
由表3可知,添加鲁氏酵母菌的发酵香肠的感官评分为93.83,说明鲁氏酵母菌产生的呋喃酮类化合物对于发酵香肠的风味及香气成分的形成有促进作用,且产生的香气成分在发酵香肠中起到了提鲜增香的作用。添加传统植物乳杆菌的发酵香肠同样接受度极高,由于添加的乳杆菌产酸使香肠内的pH值降低,能促进发酵过程的进行,增加香肠的口感。而未添加菌种的发酵香肠的感官评分最低,可能是由于自然发酵产生的菌种并不能迅速且明显地对香肠的内部条件进行调整,致使感官评分稍低于添加菌种的各组。同时,添加鲁氏酵母菌及植物乳杆菌的发酵香肠的感官评分最高,表明鲁氏酵母菌在发酵香肠中产生的风味物质与植物乳杆菌在香肠中产酸的特性相结合,使发酵香肠的接受度得到进一步提高。
3 结论
通过对比未添加菌种、添加鲁氏酵母菌、添加植物乳杆菌及添加鲁氏酵母菌和植物乳杆菌4组发酵香肠的理化指标、微生物指标及感官评分,探讨将鲁氏酵母菌加入发酵香肠中的适用性。研究发现,添加鲁氏酵母菌有助于提高发酵香肠的颜色,对水分含量的降低有一定的促进作用,同时可加速pH值的下降,从而缩短发酵香肠的成熟时间;鲁氏酵母菌在发酵香肠中生长状态良好,且未对发酵香肠内原有的乳酸菌产生影响,同时有效控制了香肠内部腐败菌种的生长;成熟后,鲁氏酵母菌产生的风味物质及香气成分对发酵香肠有促进作用,能够更好地让大众接受,说明鲁氏酵母菌在发酵香肠生产发酵过程中有促进作用,可进一步应用于发酵肉制品中。
