颈槽蛇的地理变异
2019-04-11谢昕宏刘芹崔亮伟郭鹏
谢昕宏,刘芹,崔亮伟,郭鹏*
(1. 西南林业大学生物多样性保护与利用学院,云南省高校极小种群野生动物保育重点实验室,昆明650224;2.宜宾学院生命科学与食品工程学院,四川宜宾644007)
Fitzinger(1843)通过描述物种TropidonotussubminiatusSchlegel,1837(现名为Rhabdophissubminiatus)建立颈槽蛇属Rhabdophis。但该属一直未被承认,属内物种被置于游蛇属Natrixsensulato(赵尔宓等,1998)。Malnate(1960)基于鼻间鳞和半阴茎形态、上颌齿结构、鼻孔位置、颈背纵沟、有无颈腺以及背鳞有无端窝等形态特征将原隶属于游蛇属Natrixsensulato的部分物种分离,恢复了Fitzinger(1843)所建立的颈槽蛇属Rhabdophis。目前颈槽蛇属有21种(Wallachetal.,2014),其中,中国分布有10种(Zhuetal.,2014)。
Boulenger(1893)依据湖北省宜昌市样本描记了颈槽蛇Rhabdophisnuchalis。江耀明和赵尔宓(1983)依据四川九龙的样本描记了颈槽蛇九龙亚种R.nuchalispentasupralabialis。赵尔宓(1995)基于形态特征比较认为颈槽蛇九龙亚种与指名亚种在形态上的分化已经达到了种级水平,于是将九龙亚种提升为种,称为九龙颈槽蛇R.pentasupralabralis。目前颈槽蛇无亚种分化。
对地理分布广泛的蛇类进行形态学研究,可为探索其生物多样性提供有效的依据(Pearsonetal.,2002;Manier,2004;Devittetal.,2008;Zhongetal.,2017)。颈槽蛇广泛分布于我国的重庆、湖北、湖南、甘肃、广西、贵州、河南、陕西、四川和云南(赵尔宓等,1998;康祖杰等,2009;雷隽,丁利,2013);国外分布于越南(Leetal.,2015)。该种常见于海拔620~1 860 m的马路边、草丛和农田(赵尔宓等,1998)。这为研究其地理变异模式提供了理想的条件。本文通过对我国的颈槽蛇标本进行形态观察、测量和统计分析,探索该物种的地理变异模式以及是否存在隐存种。
1 材料和方法
共观察并测量来自重庆、湖北、湖南、甘肃、广西、贵州、河南、陕西、四川和云南等地的61号馆藏标本(附录Ⅰ)的吻腹长、尾长、鳞片数、色斑等44个特征(附录Ⅱ)。吻腹长和尾长用直尺测量,精确到1 cm;其他数量特征使用游标卡尺测量,精确到0.1 cm。腹鳞数参考Dowling(1951)的方法;为方便测量,将尾背鳞的变化位置规定为其垂直对应的尾下鳞位置。对称的测量型特征(如鼻鳞长)左右两边均测量,取其平均值;对称的计数型特征(如上唇鳞数)左右两侧均计数,但独立分析、比较。为避免测量误差,所有数据均由本文第一作者独自完成。
为排除异速生长对后续分析的影响,测量型特征通过其在各分组间的回归系数与吻腹长按一定方式调整(Guoetal.,2009;Malhotra & Thorpe,2015)后用于后续分析。大多数蛇类都存在两性异形(Krauseetal.,2003;Gregory,2004;Vincentetal.,2004;Zhongetal.,2017),所有特征通过单因素方差分析(One-Way ANOVA)确定雌雄间形态差异是否存在统计学意义,若存在则按性别分析。

图1 颈槽蛇地理分布及样本采集地Fig. 1 Geographical distribution of Rhabdophis nuchalis and the localities of the specimens
依据样本的采集地进行分组(图1,附录Ⅰ)。利用单因素方差分析和单因素协方差分析(ANCOVA)筛选各组间具有显著差异的特征;当这些显著差异的特征之间的相关性r>0.7时,为避免在进行主成分分析(principal component analysis,PCA)的过程中被加权,仅选取其中一个特征(Thorpe,1976)。典型变量分析(canonical variate analysis,CVA)是用于识别能够区分各簇的形态特征的一种重要的分析方法。CVA需要1个先研分组,但是这在不确定各样本间的亲缘关系的情况下是不适用的,因此把PCA结果形成的簇作为CVA的先研分组。为排除潜在的异方差性,叙述型特征使用该特征在PCA中的得分进行CVA(Guoetal.,2009)。所有分析都在SPSS 17.0中进行,P≤0.05时差异有统计学意义。
2 结果
所有测量和记录样本均具有15行中段背鳞和6枚上唇鳞(2-2-2)等特征,据此可以与相近物种区别,如缅甸颈槽蛇R.leonardi(17行中段背鳞)和九龙颈槽蛇(5枚上唇鳞2-2-1)等,确认本研究所用标本为颈槽蛇。
2.1 两性异形
单因素方差分析结果显示,雌性和雄性颈槽蛇在尾长、前颔片宽、头左部下唇鳞数、颈槽结束于第几枚背鳞、尾背鳞左部8枚至6枚的变化位置、尾背鳞右部8枚至6枚的变化位置、尾背鳞左部6枚至4枚的变化位置和尾背鳞右部6枚至4枚的变化位置等特征上的差异有统计学意义(表1)。雄性样本具有更多的尾下鳞、更长的尾,颈槽结束的背鳞位置更靠近头部;雌性样本则具有更多的下唇鳞和更宽的前颔片,尾背鳞的变化位置更靠近泄殖腔。
2.2 地理变异
颈槽蛇存在两性异形,雌性样本和雄性样本分别分析。单因素方差分析和单因素协方差分析结果显示,雄性样本只有头左部眶后鳞数、头右部眶后鳞数、腹鳞数、尾下鳞数、上唇鳞黑纹的数量、后颔片间是否有小鳞和尾背鳞左部8枚至6枚的变化位置在地理组之间的差异有统计学意义并用于后续分析。

表1 颈槽蛇两性异形的形态特征统计Table 1 Statistical summary of sexual morphological characters of Rhabdophis nuchalis
PCA结果表明,雄性样本形成2个独立的簇:其中一簇由10个来自云南高黎贡山的样本组成,另一簇由其他地区的样本组成(图2,A);前2个主成分的贡献值57.664%(表2)。主成分1解释为后颔片间是否有小鳞、上唇鳞黑纹的数量、头右部眶后鳞数、头左部眶后鳞数和腹鳞数5个特征,主成分2主要解释为尾下鳞数和尾背鳞左部8枚至6枚的变化位置。由于18个雌性样本中只有2个样本来自高黎贡山,仅筛选出头左部眶后鳞数和头右部眶后鳞数这2个特征用于PCA。结果显示,主成分1的贡献值88.730%(表2)与雄性样本不同,高黎贡山的样本与2条来自四川巴中和甘肃文县的聚成一簇,四川茂汶与云南德钦独立于其他地方,其他地方聚成一簇。
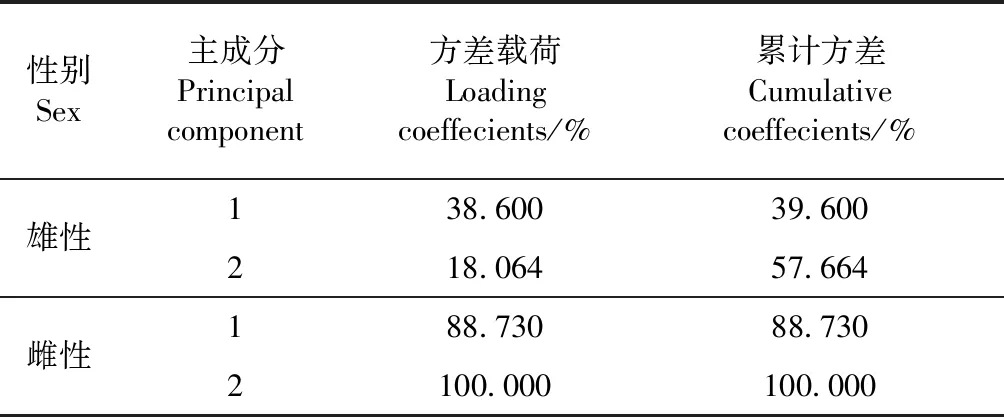
表2 雄、雌性颈槽蛇特征变量的主成分贡献值Table 2 Total variance explained by principal components of morphological traits in male and female Rhabdophis nuchalis

图2 颈槽蛇雄性(A)和雌性(B)的前2个主成分得分散点图Fig. 2 Plots of the first two principal components for male (A) and female (B) Rhabdophis nuchalis
颈槽蛇雄性样本的CVA与PCA结果相似(图3:A),高黎贡山的雌性样本未从其他地区的样本中分离出来。

图3 颈槽蛇雄性(A)和雌性(B)前2个典型变量得分散点图Fig. 3 Plots of the first two canonical variates for Rhabdophis nuchalis in males (A) and females (B)
3 讨论
3.1 两性异形
颈槽蛇在尾长、尾下鳞变化位置等的两性异形模式与其他蛇类相似(Krauseetal.,2003;雷焕宗,2005;Zhongetal.,2017),即雄性尾长长于雌性,雌性尾下鳞的变化位置较雄性更靠近泄殖腔。解释蛇类两性异形现象的观点有性选择(Darwin,1871)、自然选择(Shine & Shetty,2001;González-Gómez & Estades,2009)和形态约束假说(King,1989)。形态约束假说主张雄性拥有更大的头,主要与捕食的数量有关(Forsman & Lindell,1993)。Shine(1999)提出尾长与半阴茎长正相关,并通过比较正常雄性个体与损失部分尾巴的雄性个体,发现尾长影响雄性交配的成功率,这可能是性选择和自然选择的共同结果。
3.2 地理变异
PCA和CVA的结果均表明雄性颈槽蛇在高黎贡山种群和其他种群间存在显著差异,主要体现在头左部眶后鳞数、头右部眶后鳞数、腹鳞数、上唇鳞黑纹的数量和后颔片间是否有小鳞。PCA和CVA结果雌雄样本略不一致,可能是雌性样本太少导致了结果偏差。形态比较结果显示:高黎贡山种群83%的样本具有2枚眶后鳞(雄性80%,雌性100%),而其他种群90%的样本具有3枚眶后鳞(雄性91%,雌性81%);高黎贡山种群83%的样本的后颔片间无小鳞(雄性80%,雌性100%),然而其他种群73%的样本后颔片间有小鳞(雄性76%,雌性69%);此外高黎贡山种群16%的样本上唇鳞间有黑纹,而其他种群73%的样本上唇鳞间有黑纹(表3)。

表3 高黎贡山种群和其他种群间地理变异的特征Table 3 Geographic variation between Gaoligong Mountains population and the other
地理隔离对物种形成至关重要,通过对物种地理变异的研究,为确定其分类地位提供了重要的依据(Thalmann & Geissmann,2000;Gergely,2003;Manier,2004;Moratellietal.,2011)。高黎贡山属于横断山脉,拥有丰富的生物多样性,是中国最具生物多样性的温带地区,不断有新物种被发现,说明其特有的环境对物种的进化有较大的影响(杨大同等,1979;Vogel & Luo,2011)。本次对颈槽蛇的地理变异模式的研究,丰富了对高黎贡山生物多样性的认识。我们认为,来自高黎贡山种群与其他种群之间显著的形态差异可能暗示它代表一个不同的种或者亚种。由于获取的样本为无法获得分子遗传数据样本,所以高黎贡山种群与其他地区的种群间是否存在遗传差异以及差异的大小,还需要以后利用分子遗传资料来解决。
致谢:感谢中国科学院成都生物研究所、中国科学院昆明动物研究所惠允查看标本;感谢李家堂博士、任金龙、苏思博、王平、谢雨林等在标本测量和数据分析上的帮助;感谢高颖对文中地图制作的帮助。
附录Ⅰ标本信息
AppendixⅠSpecimensexaminedinthisstudy
省标本信息河南栾川:CIB94009(M)湖北利川:CIB10523~24(M)、CIB10525(F)、CIB10530(M)、CIB10532~33(M)、CIB10536~38(M)、CIB10542~43(M)、CIB10545(M)、CIB10547(M)、CIB10549~51(M)、CIB10556(M)、CIB10559(M)湖南常德壶瓶山:YBU071031(M)甘肃文县:CIB10644~10646(M)广西柳州:CIB10581(M)贵州兴义:CIB10607(F)、CIB10600(M)陕西周至:CIB10648(F)重庆奉节:CIB10614(F)四川洪雅:CIB83673(M)安县:YBU071013(F)、YBU061034(M)巴中:YBU15109(M)、YBU15102(F)、YBU15104(M)茂汶:KIZ84092~93(M)、KIZ84096~97(F)云南绿春:KIZ85Ⅱ003(F)德钦:KIZ80Ⅰ365(F)、KIZ80Ⅰ367(F)、KIZ80Ⅰ366(M)景东:KIZ75Ⅱ0188(F)泸水:KIZⅡ0396(F)、KIZⅡ0474(F)、KIZⅡ0385(M)、KIZⅡ0481(F)、KIZⅡ0499(M)、KIZ730103(F)高黎贡山:KIZ057456(F)、KIZ057461(F)、KIZ057448~49(M)、KIZ057451(M)、KIZ057453(M)、KIZ057454~55(M)、KIZ057458(M)、KIZ057460(M)、KIZ057462(M)、KIZ730023(M)
注: CIB. 中国科学院成都生物研究所, KIZ. 中国科学院昆明动物研究所, YBU. 宜宾学院; F. 雌性, M. 雄性
Notes: CIB. Chengdu Institute of Biology, Chinese Academy of Sciences, KIZ. Kunming Institute of Zoology, Chinese Academy of Sciences, YBU.Yibin University; F. female, M. male
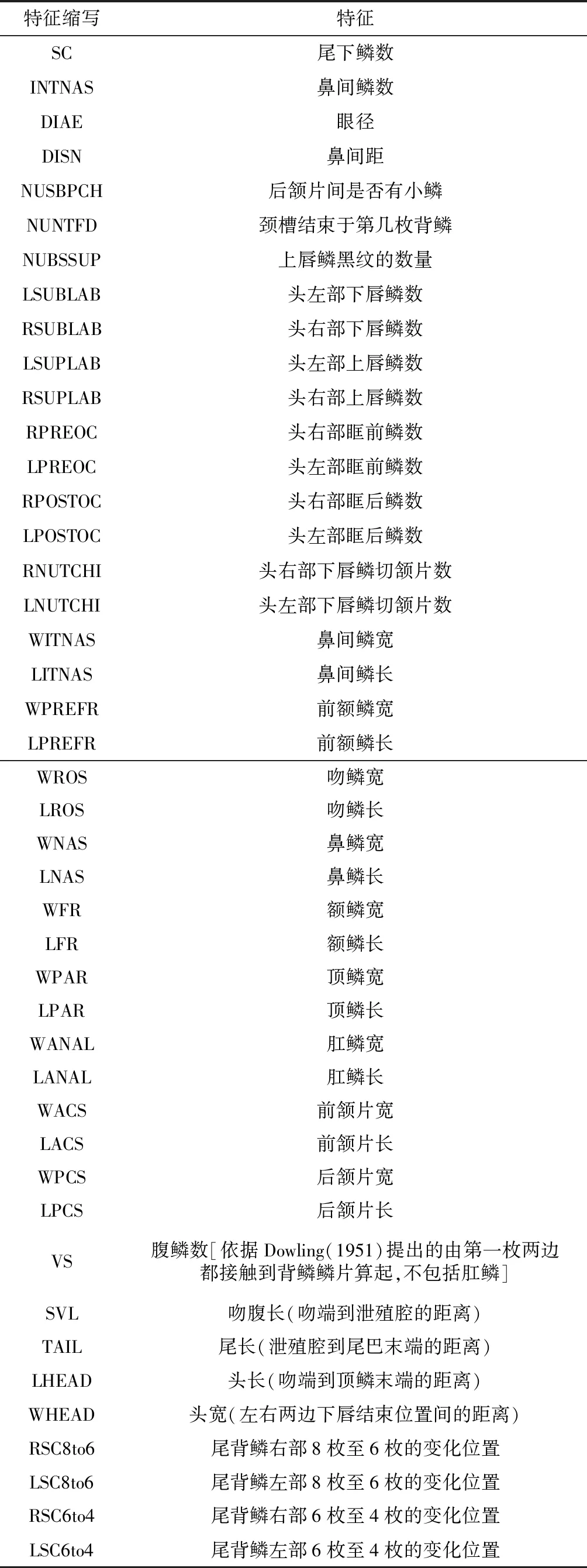
附录Ⅱ 形态特征及其缩写Appendix Ⅱ Morphological charactersand their abbreviations
