家鸡GPR15基因的克隆、功能探究及组织表达分析
2019-04-11方超张剑南李枭虓陈军安李娟王亚军
方超, 张剑南, 李枭虓, 陈军安, 李娟, 王亚军
(四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都610065)
人Homosapiens的G蛋白偶联受体15(G protein-coupling receptor 15,GPR15)于1996年被首次克隆(Heiberetal.,1996),研究表明GPR15在哺乳动物中调节多种生理功能:在小鼠Musmusculus大肠T细胞中,GPR15通过介导上皮中T细胞归巢调节免疫反应,参与调控调节性T细胞(Treg cells)抑制非感染性炎症,对预防大肠病理性炎症至关重要(Kimetal.,2013;Nguyenetal.,2015);在小鼠皮肤淋巴细胞归巢中,GPR15有助于淋巴细胞靶向不同的上皮部位(Lahletal.,2014);GPR15还参与先天性免疫调节,并与多种疾病存在密切关联,如克罗恩病和类风湿性关节炎(Cartwrightetal.,2014);GPR15在吸烟者体内高表达亦暗示其可能参与调控吸烟引起的疾病(Koks & Koks, 2017)。除了炎症反应之外,肠道微生物菌群可以影响小鼠GPR15的表达水平,暗示GPR15可能参与调控肠道的微生物菌群稳态平衡(Kimetal.,2013)。GPR15调节的生理功能与其在组织中的特异性表达图谱密切相关,人类组织转录组测序数据表明GPR15在淋巴细胞中具有最高的表达丰度,表明其在免疫反应中的重要作用,其次高表达于结肠和小肠中,表明GPR15可参与调节肠道稳态(Koks & Koks,2017)。
因为GPR15是孤儿受体,故人们致力于寻找其内源性配体。最新研究报道人类C10ORF99基因编码GPR15的内源性配体蛋白GPR15L,可以激活GPR15并抑制毛喉素(forskolin)诱导的环腺苷酸(cAMP)产生(Suplyetal.,2017)。Ocon等(2017)的研究表明人类C10ORF99基因和小鼠2610528A11Rik基因可编码GPR15L,并鉴定其可作为一种淋巴细胞趋化因子,通过激活GPR15发挥功能。但我们发现GPR15L基因在非哺乳类脊椎动物中消失,因此,在鸟类等非哺乳动物类群中,GPR15的配体仍待鉴定。因GPR15与爱帕琳肽受体(APLNR)和GPR25具有较高的结构相似性(Leeetal.,2001),提示APLNR (Chngetal.,2013;Paulietal.,2014)和GPR25 (Zhangetal.,2018)的配体Apelin和Apela也可能会作为GPR15的潜在配体,但该假设有待验证。
目前,关于GPR15的研究主要集中在哺乳动物中,在其他脊椎动物类群中的研究几属空白。鉴于GPR15在哺乳动物炎症反应和肠道稳态中的重要调控作用(Kimetal.,2013;Koks & Koks,2017),本研究以家鸡Gallusgallusdomesticus为模型,首次针对GPR15的基因结构、功能和表达特征进行了探究,以期为探究GPR15在非哺乳类脊椎动物中的功能奠定基础。
1 材料与方法
1.1 材料与试剂
罗曼粉蛋鸡购于成都牧星种鸡场,本实验室提供大肠杆菌EscherichiacoliDH5α感受态细胞。真核表达载体pcDNA3.1(+)购于美国Invitrogen公司,斑马鱼DaniorerioGPR25真核表达质粒保存于本实验室(Zhangetal.,2018)。RNAzol购于美国Molecular Research Center公司;限制性内切酶、RNA反转录酶M-MLV及其配用体系购于TaKaRa公司;高保真聚合酶KOD及其配用体系购于日本TOYOBO公司;Easy Taq酶及其配用体系购于全式金公司;引物合成及后续测序工作由成都擎科生物技术有限公司完成;DMEM低糖培养基购于GIBCO公司;转染试剂JetPEI购于Polyplus-transfection公司;5×细胞裂解液(5×Passive Lysis Buffer)和荧光素酶报告系统购于Promega公司。家鸡Apelin多肽(TPLRQNPARAGRSQRPAGWRRRRPRPRLSHKGPMPF)和Apela多肽(LVRPRGARRGNVRRPGGWRRLRRP-RPRLSHKGPMPF)由上海吉尔生化公司合成。
1.2 方法
1.2.1家鸡组织总RNA的提取分别取家鸡不同组织样品(盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑、小脑)于液氮中充分研磨至粉末,将60 mg磨碎组织加入到600 μL RNAzol中涡旋混匀;加入240 μL焦碳酸二乙酯(DEPC)灭菌水后涡旋混匀,于4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑(BAN)后涡旋混匀,于4 ℃、12 000 r·min-1离心10 min;吸取上清液,加入等体积的异丙醇,涡旋混匀后于-20 ℃静置20 min,于4 ℃、12 000 r·min-1离心15 min;吸弃上清,用70%乙醇漂洗沉淀,于4 ℃、12 000 r·min-1离心3 min,重复该操作一次,吸弃上清;用20 μL DEPC-H2O溶解RNA沉淀,并储存于-80 ℃冰箱中。
1.2.2cDNA模板制备以家鸡组织总RNA为模板,按照逆转录试剂盒说明书操作。配制混合液1:RNA 2 μg和Olig-dT 1 μL,加入DEPC-H2O补足5 μL,于PCR仪中70 ℃反应10 min,取出静置于冰上10 min。配制混合液2:5×Buffer 2 μL、dNTP 1 μL和M-MLV反转录酶0.5 μL,加入DEPC-H2O补足5 μL;将混合液1与混合液2混匀,然后放入PCR仪中,42 ℃反应1.5 h,70 ℃反应10 min,取终产物加入70 μL灭菌水后存于-20 ℃中,即为cDNA模板。
1.2.3家鸡GPR15的引物设计及扩增根据Ensembl数据库(http://www.ensembl.org)中检索得到的家鸡GPR15的预测序列(登录号:XM_004938212),设计了用于克隆其cDNA序列的引物GPR15 F1/GPR15 R1,并且设计用于检测GPR15在组织表达图谱的实时定量PCR引物(表1)。

表1 引物序列Table 1 Primer sequences
PCR反应以家鸡盲肠来源的cDNA为模板。PCR反应体系按照KOD酶说明书配制,体系如下:5 μL 2×KOD缓冲液,2 μL盲肠cDNA模板,2 μL dNTPs,上、下游引物各0.1 μL,0.5 μL KOD-Fx聚合酶,0.3 μL去离子灭菌水。PCR反应程序为:94 ℃2 min;98 ℃10 s,60 ℃30 s,68 ℃90 s,35个循环;72 ℃20 min,12 ℃保存。经1%琼脂糖凝胶电泳检测后,纯化后的PCR产物连接至pcDNA3.1(+)载体,通过序列测定,确定GPR15的cDNA序列。
1.2.4细胞转染及荧光素酶活性测定待培养细胞密度至60%左右进行质粒转染。转染体系为:受体基因表达载体或pcDNA3.1(+)空载体200 ng/孔;荧光素酶报告质粒800 ng/孔;转染试剂JetPEI 2 μL/孔;用转染缓冲液配成总体系为100 μL的混合液,室温放置10 min后,将转染混合液加入到 6孔板中,4 h后更换培养基。配体(多肽或药物)处理前,用胰蛋白酶液消化细胞,再将HEK293细胞传代至96 孔板中,置于5%浓度CO2的37 ℃恒温培养箱培养24 h后进行配体处理。配体处理时,按照10-12~10-5mol·L-1配制,处理6 h后,使用1×Passive Lysis Buffer充分裂解细胞,加入Luciferase底物后,在酶标仪中测定荧光素酶活性。具体方法参见Mo等(2017)和Zhang等(2018),实验数据使用GraphPad Prism 7进行分析处理。
1.2.5GPR15表达图谱分析通过实时定量PCR(qPCR)技术,以家鸡不同组织(盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑、小脑)的cDNA为模板,检测GPR15基因的表达水平。PCR反应程序为:94 ℃2 min;98 ℃10 s,60 ℃20 s,68 ℃15 s,40个循环;72 ℃20 min,PCR产物由成都擎科梓熙生物技术有限公司进行测序,具体方法参见祝国强等(2017)和邓秋洋等(2018)。同时利用转录组数据分析GPR15基因的组织表达。RNA-seq数据下载于NCBI数据库(登录号:PRJEB4677),该实验在1只雄性和1只雌性成年红原鸡Gallusgallus中共取得27个组织,包括脂肪、肾上腺、胸肌、小脑、大脑、心脏、下丘脑、肾脏、肝脏、肺、卵巢、腺胃、坐骨神经、脾脏和精巢等,之后利用Salmon(v0.82)对RNA-seq数据进行转录本的定量(Patroetal.,2017)分析,TPM(transcripts per million)值表示转录本丰度,使用GraphPad Prism 7绘制图片。
1.2.6生物信息学分析采用SeqMan和EditSeq进行测序结果序列拼接,用DNAMAN进行DNA和蛋白质序列比对,使用CFX Manager进行qPCR数据定量分析;通过SWISS-MODEL(https://www.swissmodel.expasy.org/)网站进行蛋白三维结构同源建模,使用MEGA 7进行系统发育分析,采用邻接法(neighbor-joining method),重复计算引导值(bootstrap values)达1 000次。
2 结果与分析
2.1 家鸡GPR15基因的克隆及序列分析
根据家鸡GPR15的预测序列(登录号:XM_004938212),设计引物GPR15 F1/R1。以家鸡盲肠cDNA为模板进行PCR扩增,测序获得家鸡GPR15基因的cDNA序列(登录号:MH293603)。序列分析表明:家鸡GPR15基因编码区cDNA序列长度为1 107 bp,含1个外显子,编码含368个氨基酸的受体蛋白(图1:A)。家鸡GPR15是具有7次跨膜结构的G蛋白偶联受体(图1:B、C)。家鸡GPR15具有保守的GPCR结构特征:包括维持GPR15三维结构的二硫键(Cys113~Cys190)、参与受体激活和G蛋白偶联信号转导的保守“DRY”基序(位于第二胞内域)以及“NP(XX)Y”基序(位于第七跨膜区)。通过同源建模方法,本研究模拟了家鸡GPR15的三维结构,可观察到经典的7次跨膜结构域,并预测其在C端具有1个α-螺旋结构(图1:C)。

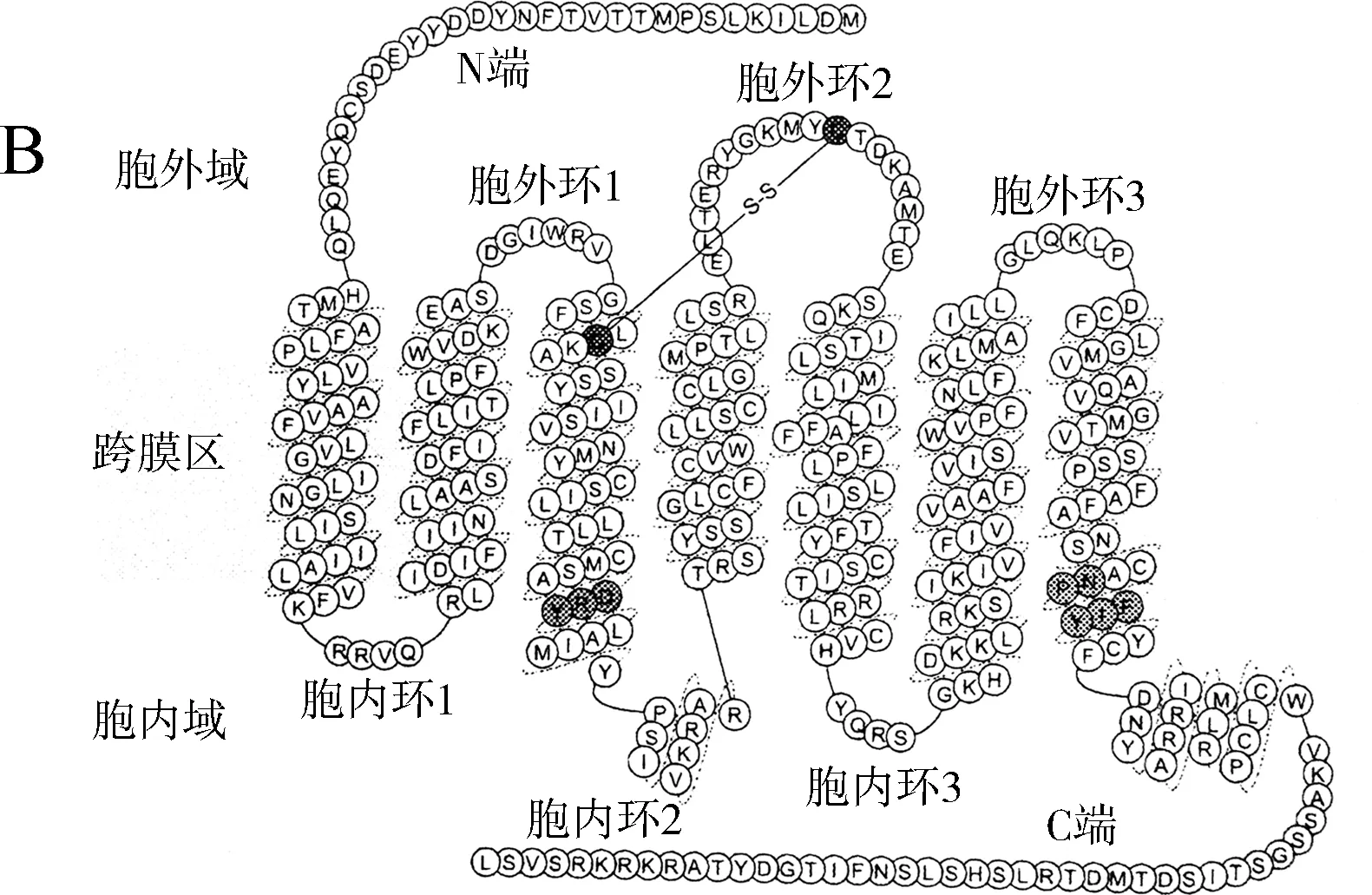
2.2 多物种GPR15的氨基酸序列比对
多物种氨基酸序列比对表明(图2):家鸡GPR15分别与人、北美绿蜥蜴Anoliscarolinensis、小鼠GPR15具有中度的氨基酸序列一致性,分别为56.2%、55.9%、55.7%;与斑点雀鳝LepisosteusoculatusGPR15的氨基酸序列相似度相对较低,为35.2%。

图2 家鸡Gallus gallus domesticus GPR15与人Homo sapiens、北美绿蜥蜴Anolis carolinensis、小鼠Mus musculus、斑点雀鳝Lepisosteus oculatus GPR15的氨基酸比对Fig. 2 Amino acid sequence alignment of Gallus gallus domesticus GPR15 with that of Homo sapiens, Anolis carolinensis,Mus musculus, and Lepisosteus oculatus
2.3 GPR15系统进化分析及功能探究
GPR15基因位于家鸡1号染色体上。选取斑胸草雀Taeniopygiaguttata、中华草龟Chinemysreevesii、北美绿蜥蜴、人和家鸡的GPR15基因进行共线性分析。结果表明,家鸡GPR15基因与斑胸草雀、中华草龟、北美绿蜥蜴、人的GPR15基因为直系同源基因(图3)。
由于有研究报道GPR15与GPR25、APLNR受体有序列相似性,因此,本研究对GPR15、GPR25、APLNR、AGTR1、AGTR2等基因进行系统进化分析。聚类分析表明(图4),多个脊椎动物的GPR15、GPR25和APLNR基因可形成一个大的分支,并且GPR15还与GPR25形成一个小分支。这些结果提示GPR15与GPR25有较近的进化关系。在近期研究中,发现孤儿受体GPR25可被APLNR的配体Apelin和Apela多肽激活(Zhangetal.,2018)。据此,假设“Apelin和Apela或是GPR15的潜在配体”。
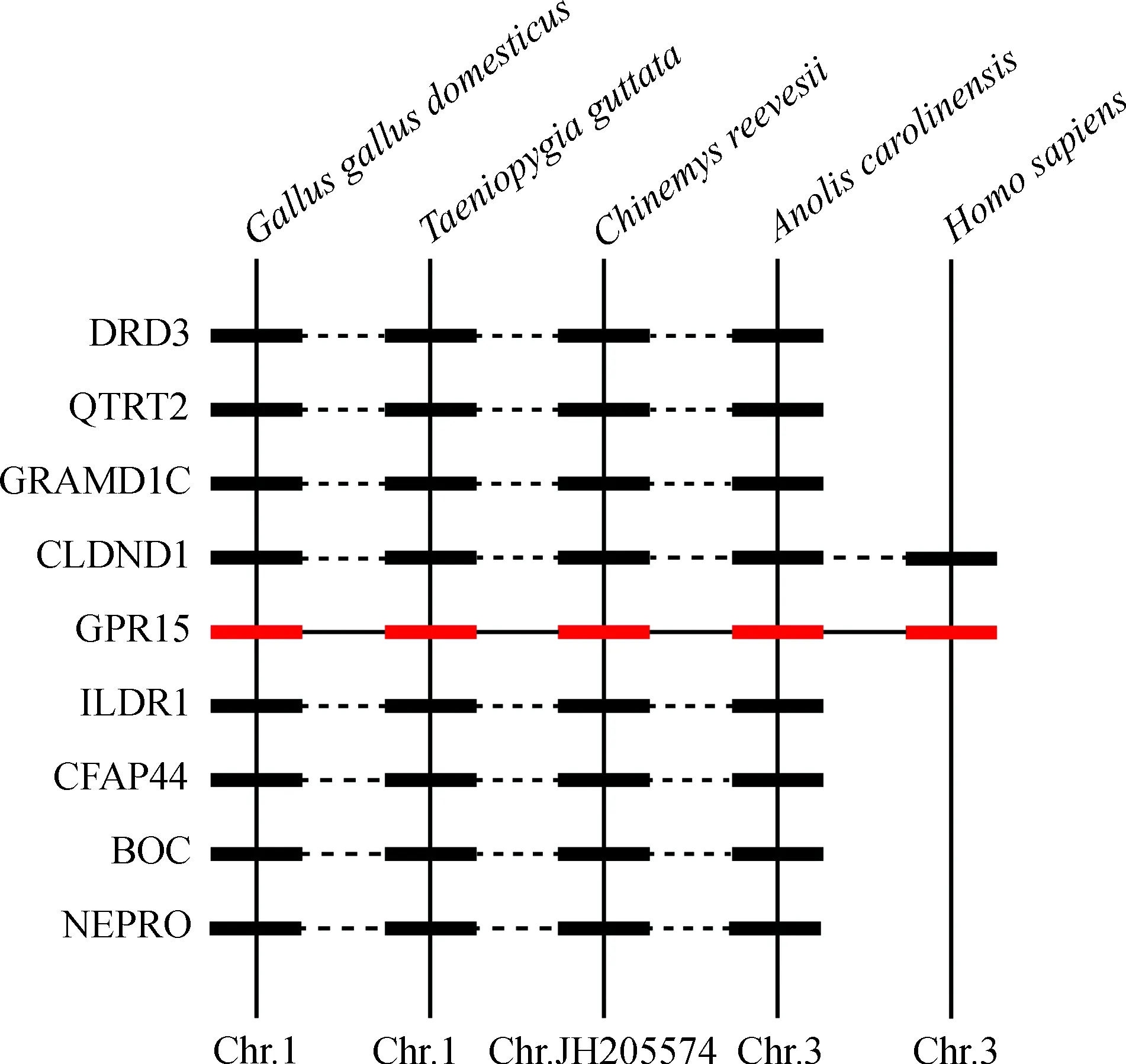
图3 家鸡Gallus gallus domesticus、斑胸草雀Taeniopygiaguttata、中华草龟Chinemys reevesii、北美绿蜥蜴Anoliscarolinensis和人Homo sapiens GPR15基因的共线性分析Fig. 3 Synteny analysis of GPR15 gene among Gallus gallus domesticus, Taeniopygia guttata, Chinemys reevesii,Anolis carolinensis and Homo sapiens
为验证上述假设,本研究采用了pGL3-CRE-luciferase报告系统(Moetal.,2017;Zhangetal.,2018),探究Apelin和Apela多肽(10-12~10-5mol·L-1,6 h)对表达于HEK293细胞中的家鸡GPR15(cGPR15)的激活效应。家鸡Apelin和Apela多肽不能激活家鸡GPR15受体,从而无法影响forskolin(5 μmol·L-1)刺激的HEK293细胞的荧光素酶活性(图5:A)。相反,在相同实验条件下,家鸡Apelin和Apela多肽可以剂量依赖地激活斑马鱼GPR25(zfGPR25),抑制forskolin刺激的荧光素酶活性(图5:B)(Zhangetal.,2018)。采用pGL4-SRE-luciferase报告系统(Moetal.,2017)也发现家鸡Apelin和Apela多肽不能激活家鸡GPR15(图5:C)。上述结果暗示,与GPR25和APLNR不同(Chngetal.,2013; Paulietal.,2014; Zhangetal.,2018),GPR15不能被Apelin和Apela肽激活。
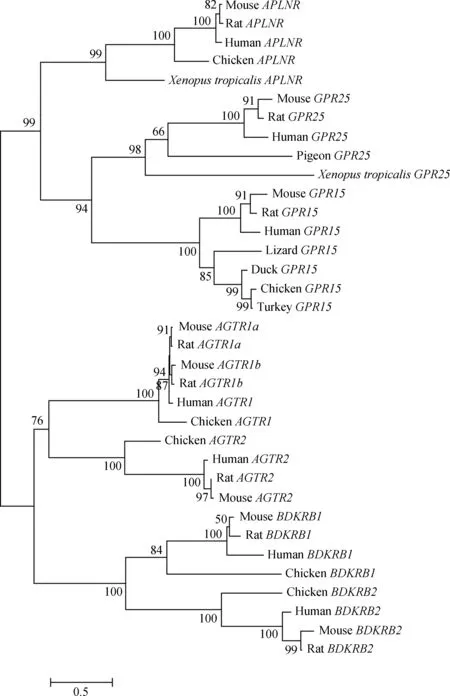
图4 脊椎动物中G蛋白偶联受体A家族的系统进化分析Fig. 4 Phylogenetic analysis of class A GPCR family among vertebrates
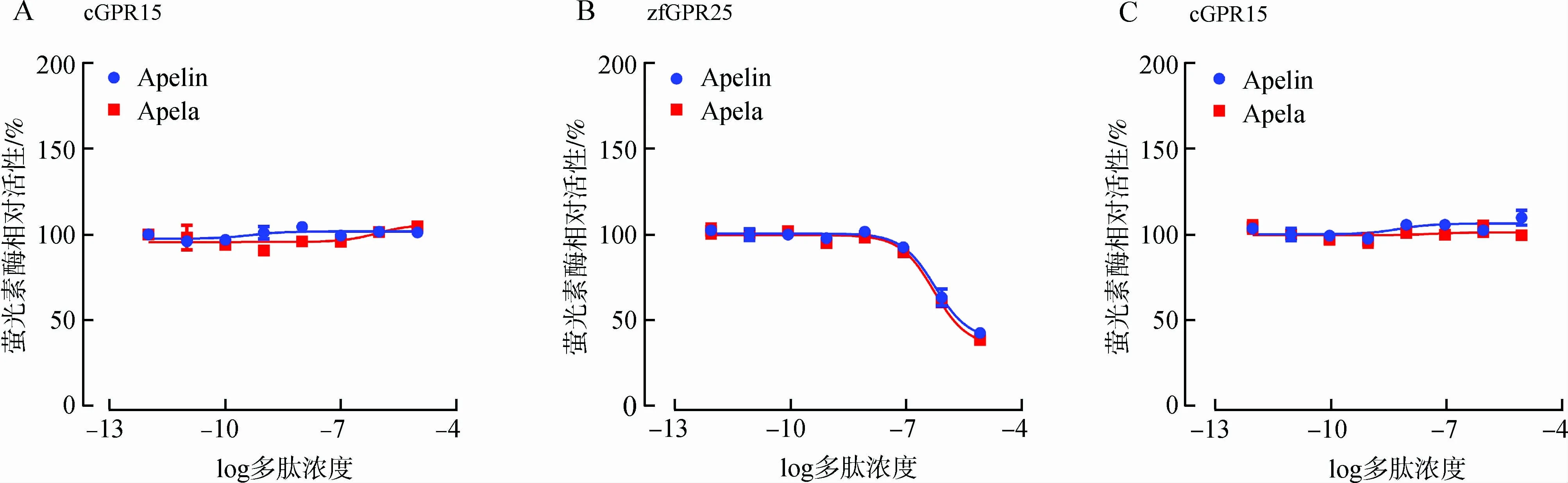
图5 家鸡Gallus gallus domesticus GPR15的功能分析Fig. 5 Functional analysis of Gallus gallus domesticus GPR15 in cultured HEK293 cells by cell-based luciferase reporter system
2.4 GPR15的组织表达图谱
采用qPCR检测GPR15基因在家鸡盲肠、心脏、肝脏、脾脏、肺、肾脏、卵巢、精巢、大脑和小脑中的表达分布情况(图6:A),以肺中的表达水平为参照,GPR15基因相对高表达于脾脏中,而在盲肠和肺中有中等水平表达,在心脏、肝脏、肾脏、卵巢、精巢、小脑和大脑中,仅检测到微弱表达。与qPCR结果高度类似,转录组数据分析(图6:B)也揭示GPR15基因高表达于家鸡祖先红原鸡脾脏中,在肺中中等表达,而在卵巢、精巢、坐骨神经等组织中微弱表达。
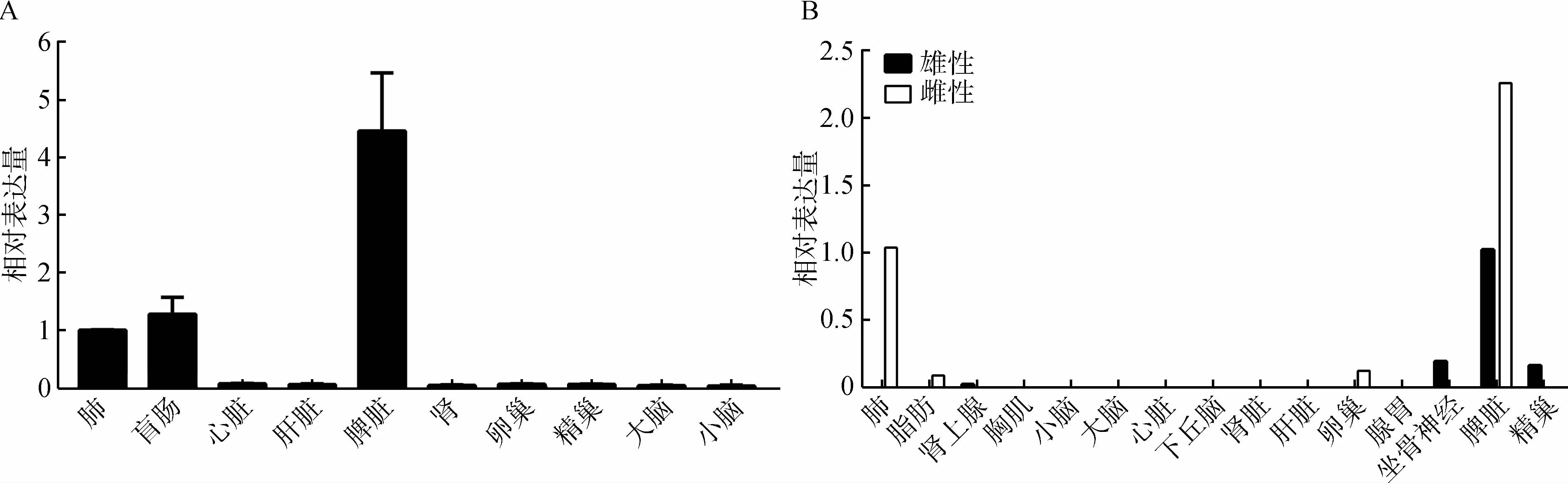
图6 鸡GPR15基因的组织表达图谱分析Fig. 6 Tissue expression of chicken GPR15 gene
3 讨论
GPR15作为G蛋白偶联受体家族成员备受关注。已有研究表明在小鼠中,GPR15可介导肠道稳态并参与调控肠道炎症反应(Kimetal.,2013)。鉴于GPR15的重要生理功能,本研究首次从家鸡中成功克隆到GPR15基因,并尝试寻找其内源性配体,揭示其组织表达特征,为阐释GPR15在禽类免疫和肠道稳态中的生理作用奠定基础。
本研究首先克隆了家鸡GPR15基因,发现其编码区序列全长为1 107 bp,含1个外显子,编码含368个氨基酸的受体蛋白。家鸡GPR15也具7次跨膜结构域,其氨基酸序列与人、北美绿蜥蜴、小鼠具有约56%氨基酸序列一致性;共线性分析表明家鸡GPR15基因是人GPR15基因的直系同源基因。系统进化分析显示GPR15与GPR25和APLNR有较近的进化关系。尽管有研究发现小鼠和人GPR15L基因可以编码GPR15的配体(Suplyetal.,2017),但是GPR15L基因在非哺乳类脊椎动物中似乎已消失,因此,在包括家鸡在内的非哺乳动物中,GPR15的配体仍待鉴定。同时,本研究小组最新研究结果表明,APLNR内源性配体Apelin和Apela肽可以激活GPR25(Zhangetal.,2018)。鉴于GPR15与GPR25具有较近的进化关系,亦初步探究了Apelin和Apela对家鸡GPR15的激活效应。结果表明Apelin和Apela不能激活表达于HEK293细胞中的家鸡GPR15,而在相同实验条件下,Apelin和Apela可以激活斑马鱼GPR25。因此,在非哺乳类脊椎动物中,GPR15的功能和内源性配体仍待鉴定。
qPCR分析发现,家鸡GPR15基因在脾脏中表达丰度最高,其次是盲肠、肺等。这与哺乳动物中的发现基本一致,如GPR15在人淋巴细胞中具有最高的表达水平,其次高表达于结肠和小肠等组织(Koks & Koks, 2017),在脾脏亦能检测到较高的表达水平(Dengetal.,1997)。Western blot检测到GPR15蛋白可在人睾丸和肝脏中表达,而在大脑、胎盘、肺、子宫、心脏、胰腺或骨骼肌中无表达(Claytonetal.,2001)。在小鼠中,脾脏GPR15可与血栓调节素相互作用缓解败血症(Panetal.,2017)。GPR15在家鸡脾脏中的高表达,提示其可能参与脾脏中的免疫反应。家鸡GPR15在盲肠组织中的表达结果与哺乳动物中的发现也一致(Dengetal.,1997)。在小鼠中,广谱抗生素治疗可降低肠道GPR15的表达量,推测GPR15可能在平衡肠道微生物菌群中发挥作用(Kimetal.,2013),至于GPR15是否在家鸡盲肠中发挥类似效应,值得关注和深入研究。
