实时荧光环介导等温扩增技术检测土壤中的类鼻疽伯克霍尔德菌
2019-04-11,,,,,,,,
, , , , ,,, ,
类鼻疽伯克霍尔德菌(Burkholderiapseudomallei)又称类鼻疽杆菌,隶属于伯克霍尔德菌属(Burkholderia),是借鞭毛而运动的革兰阴性杆菌,无芽孢[1];分布广泛,主要存在于水及土壤中,其耐受力极强,可在土壤中存活几十年之久;类鼻疽伯克霍尔德菌污染的土壤和水被人和动物接触后,可引起人和动物的类鼻疽,是一种典型的热带疾病致病菌,能感染机体几乎任何器官,被美国CDC列为B类生物恐怖剂[2]。类鼻疽临床表现多样且缺乏特异性,易被误诊为肺炎、肺结核、肺脓肿或其他化脓菌所致的菌血症,有似“百样病”之称[3];此外,类鼻疽伯克霍尔德菌表现出对多类抗生素的固有耐药,包括β-内酰胺类、氨基糖苷类、大环内酯类和多粘菌素等,给临床治疗带来很大的困难,导致患者死亡率高[4]。类鼻疽主要流行于澳大利亚北部、泰国等热带地区,我国自1990年首次报道皮肤类鼻疽病例以来,陆续有类鼻疽病例的报道,且死亡率高达50%以上;广东、广西、海南等地也是其重灾区,就目前而言,类鼻疽已经成为了严重的公共卫生问题[5]。
目前,检测类鼻疽伯克霍尔德菌的主要方法有细菌分离培养[6]、生化鉴定[7]、抗原检测[8]、抗体检测[9]、气液相色谱分析[10]和分子检测[11]等。虽然鉴定临床标本中分离培养的的类鼻疽伯克霍尔德菌是诊断类鼻疽的标准方法,但是培养和鉴定耗费时间长,易错过最佳治疗时间;传统的生化培养常常出现错误;抗体检测在类鼻疽流行地区的应用存在背景抗体的干扰;近年来,分子诊断类鼻疽伯克霍尔德菌引起了研究学者的关注,但是传统的PCR技术耗费时间较长、操作繁琐。2000年,Notomi[12]等发明了一种新型的核酸等温扩增技术-环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP),利用具有链置换活性的BstDNA聚合酶(BstDNA polymerase)提供反应的动力,在恒温条件下几十分钟即可完成靶基因的高效扩增。该方法规避了常规PCR反应的变性、退火、延伸等一系列复杂的过程,大大节省了反应时间和成本,已被广泛应用于对细菌、病毒、寄生虫的快速检测和动物胚胎性别鉴定等领域[13]。本文根据类鼻疽伯克霍尔德菌filc基因片段设计LAMP引物[14],同时利用反应产物与荧光染料结合发出荧光的特点,向反应体系中加入荧光染料EvaGreen,随着反应产物的增加,与其结合的荧光染料也越来越多,荧光信号强度也随之增强,通过实时荧光定量仪对荧光信号进行搜集,实现实时定性检测,建立实时荧光环介导等温扩增技术检测类鼻疽伯克霍尔德菌的方法。
1 材料与方法
1.1 材料
1.1.1菌株 类鼻疽伯克霍尔德菌、土拉弗朗西斯氏菌、布鲁氏菌、鼠疫菌和蜱虫DNA、副溶血弧菌、肠出血性大肠杆菌O157∶H7型、单核细胞增生李斯特氏菌、沙门氏杆菌、金黄色葡萄球菌、肺炎克雷伯菌、脆弱拟杆菌、双歧杆菌、乳酸杆菌DNA均由生物应急与临床POCT北京市重点实验室提供。
1.1.2主要试剂与仪器 PCR扩增试剂盒(上海生工生物工程股份有限公司);BstDNA聚合酶大片段(New England Biolabs);EvaGreen染料(上海开放生物科技有限公司);细菌核酸提取试剂盒(北京开景基因技术有限公司);甜菜碱(Sigma-Aldrich);Line-Gene 9600 Plus 实时荧光PCR仪(杭州博日科技有限公司);XMTD-6000电热恒温水浴锅(北京市长风仪器仪表公司);DYY-8C型电泳仪(北京市六一仪器厂);质粒提取试剂盒(天根生化科技有限公司,北京)。
1.2 方法
1.2.1引物的设计与合成 根据类鼻疽伯克霍尔德菌filc基因序列(GenBank accession no.: KJ814953.1),利用软件PrimerExplorer V5 (日本荣研化学株式会社)在线设计特异的LAMP引物对(包括外引物F3/B3,内引物FIP/BIP,环引物LF/LB),序列如表1所示。

表1 引物序列Tab.1 Information of the primers
1.2.2细菌DNA模板的制备 采用热裂解法制备细菌DNA模板。取培养过夜的类鼻疽伯克霍尔德菌菌液1 mL,8 000×g离心1 min弃上清液。加入100 μL无菌水充分悬浮菌体,沸水浴中煮沸10 min,10 000×g离心2 min,上清液即可作为扩增模板,保存温度为-20 ℃。
1.2.3RealAmp反应体系 10×Thermopol buffer(1 μL),EvaGreen(0.2 μL), 2 mmol/L MgSO4(0.2 μL),10 mmol/L dNTPs Mix(0.4 μL),5 mmol/L Betaine(2 μL),10 pmol/μL外引物(F3 / B3)各0.1 μL,10 pmol/μL内引物(FIP / BIP)各0.6 μL,10 pmol/μL环引物(LF / LB)0.4 μL,128 U/mL Bst DNA Polymerase(0.4 μL),模板(2 μL),H2O补足至10 μL。扩增反应条件:63 ℃,60 min。
1.2.4产物电泳验证 取以类鼻疽伯克霍尔德菌核酸为模板的RealAmp扩增产物5 μL,与1 μL的10×loading buffer混合均匀,于2%琼脂糖凝胶进行电泳分析,观察阶梯状条带,证实是否发生了反应。
1.2.5RealAmp的特异性验证 依据基于类鼻疽伯克霍尔德菌filc基因建立的RealAmp技术,配制反应体系,将类鼻疽伯克霍尔德菌、土拉弗朗西斯氏菌、布鲁氏菌、鼠疫菌、副溶血弧菌、肠出血性大肠杆菌O157∶H7型、单核细胞增生李斯特氏菌、沙门氏杆菌、金黄色葡萄球菌、肺炎克雷伯菌、脆弱拟杆菌、双歧杆菌、乳酸杆菌以热裂解法提取细菌DNA为模板,于63 ℃进行RealAmp反应,验证该检测方法的特异性。
1.2.6 RealAmp的灵敏度实验
1.2.6.1细菌核酸检测灵敏度 采用热裂解法,提取过夜培养的类鼻疽伯克霍尔德菌菌液的DNA,用无菌水进行10倍倍比稀释至1×101CFU/mL~1×108CFU/mL,分别取2 μL作为反应模板,进行RealAmp扩增,检测方法的灵敏度。
1.2.6.2克隆质粒检测灵敏度 采用热裂解法,提取类鼻疽伯克霍尔德菌克隆株质粒,用无菌水进行10倍倍比稀释至1×101copies/μL~1×109copies/μL,分别取2 μL作为反应模板,进行RealAmp扩增。
1.2.7 普通LAMP的灵敏度实验
1.2.7.1普通LAMP反应体系 10×Thermopol buffer(1 μL),2 mmol/L MgSO4(0.2 μL),10 mmol/L dNTPs Mix(0.4 μL),5 mmol/L Betaine(2 μL),10 pmol/μL外引物(F3 / B3)各0.1 μL,10 pmol/μL内引物(FIP / BIP)各0.6 μL,10 pmol/μL环引物(LF/ LB)0.4 μL,128 U/mL Bst DNA Polymerase(0.4 μL),模板(2 μL),H2O补足至10 μL。扩增反应条件:63 ℃,60 min。
1.2.7.2细菌核酸检测灵敏度 采用热裂解法,提取过夜培养的类鼻疽伯克霍尔德菌菌液的DNA,用无菌水进行10倍倍比稀释至1×100CFU/mL~1×107CFU/mL,分别取2 μL作为反应模板,进行LAMP扩增,检测方法的灵敏度。
1.2.7.3克隆质粒检测灵敏度 采用热裂解法,提取类鼻疽伯克霍尔德菌克隆株质粒,用无菌水进行10倍倍比稀释至1×101copies/μL~1×109copies/μL,分别取2 μL作为反应模板,进行LAMP扩增。
1.2.8 人工污染土壤
1.2.8.1人工污染土壤模拟样本的制备 筛除大颗粒杂质的土壤,用蒸馏水制成悬浊液(0.25 g土壤加0.5 mL蒸馏水),取浓度为1×102CFU/mL~1×109CFU/mL类鼻疽伯克霍尔德菌克隆株菌悬液1 mL加入到9 mL的土壤悬液中,振荡混匀,4 ℃放置过夜,使细菌与土壤充分吸附,即为污染土壤。每个浓度污染3份标本,共制备污染土壤24份,同时制备只加灭菌蒸馏水的阴性对照。
1.2.8.2RealAmp检测人工污染土壤的灵敏度实验 以类鼻疽伯克霍尔德菌终浓度为4.4×10-1CFU/g~4.4×1010CFU/g CFU/g的土壤模拟样本,分别取2 μL作为反应模板,进行RealAmp扩增。
1.2.9人工污染土壤RealAmp与实时荧光定量PCR的对比检测 以类鼻疽伯克霍尔德菌终浓度为4.4×101CFU/g~4.4×108CFU/g的土壤模拟样本,通过RealAmp技术和荧光定量PCR对比检测,比较分析这两种方法的检出率和实际应用价值。
2 结 果
2.1RealAmp检测类鼻疽伯克霍尔德菌方法的建立 如图1所示,当反应进行至25个循环(1 min/循环)时,阳性对照管的荧光强度大幅度增加,荧光曲线斜率增加,当反应进行至40个循环,荧光信号增加强度逐渐变缓,直至反应结束,仪器判定为阳性结果,说明发生了扩增反应。阴性对照管荧光曲线一直处于平滑的状态,直到反应终止也没有曲线斜率的变化,仪器判定为阴性结果,说明没有发生扩增反应。
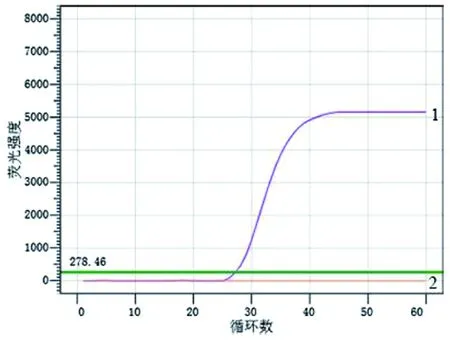
1:阳性对照 2:阴性对照
2.2产物的电泳结果分析 如图2所示,1泳道有阶梯状条带产生,说明阳性对照管发生了扩增反应,2泳道没有条带,说明没有发生扩增反应,检测结果与图1所示检测结果一致。
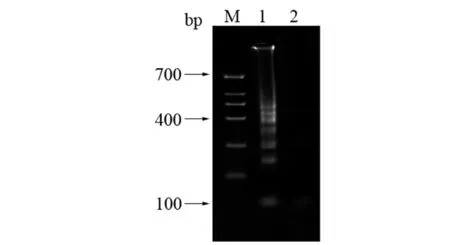
M:100 bp marker;1:阳性对照;2:阴性对照
2.3RealAmp检测类鼻疽伯克霍尔德菌方法的特异性 如图3所示,类鼻疽伯克霍尔德菌有明显的扩增出现,其他12株细菌和脾的DNA均未产生扩增峰,表明基于类鼻疽伯克霍尔德菌filc基因建立的RealAmp技术特异性强。

1:类鼻疽伯克霍尔德菌;2:土拉弗朗西斯氏菌;3:布鲁氏菌;4:鼠疫菌;5:副溶血弧菌;6:肠出血性大肠杆菌O157:H7型;7:单核细胞增生李斯特氏菌;8:沙门氏杆菌;9:金黄色葡萄球菌;10:乳酸杆菌;11:肺炎克雷伯菌;12:脆弱拟杆菌;13:双歧杆菌;14:蜱虫DNA;15:阴性对照
2.4RealAmp与普通LAMP检测类鼻疽伯克霍尔德菌方法灵敏度的比较
2.4.1普通LAMP检测类鼻疽伯克霍尔德菌方法的灵敏度 类鼻疽伯克霍尔德菌核酸的终浓度为1×107CFU/mL,10倍倍比稀释后,进行普通LAMP扩增,如图4(A)所示,1~5泳道出现明显的阶梯状条带,为阳性结果,即普通LAMP检测类鼻疽伯克霍尔德菌的灵敏度为1×103CFU/mL;类鼻疽伯克霍尔德菌质粒终浓度为1×108copies/μL,10倍倍比稀释后,进行普通LAMP扩增,如图5(B)所示,1~7泳道管出现明显的阶梯状条带,为阳性结果,即普通LAMP检测类鼻疽伯克霍尔德菌质粒的灵敏度为1×102copies/μL。
M:100 bp marker;A:普通LAMP检测类鼻疽伯克霍尔德菌核酸的灵敏度 1~8:类鼻疽伯克霍尔德菌核酸的终浓度依次为 1×107、1×106、1×105、1×104、1×103、1×102、1×101、 1×100 CFU/mL;9:阴性对照;B:普通LAMP检测类鼻疽伯克霍尔德菌质粒的灵敏度 1~10:类鼻疽伯克霍尔德菌质粒的终浓度依次为 1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100、1×10-1 copies/μL;11:阴性对照
2.4.2RealAmp检测类鼻疽伯克霍尔德菌方法的灵敏度 以2.4.1中的类鼻疽伯克霍尔德菌核酸,进行RealAmp扩增,如图5(A)所示,1~6号管出现明显的扩增峰,为阳性结果,即RealAmp检测类鼻疽伯克霍尔德菌的灵敏度为1×102CFU/mL;同样以2.4.1中的类鼻疽伯克霍尔德菌克隆质粒,进行RealAmp扩增,如图5(B)所示,1~8号管出现明显的扩增峰,为阳性结果,即RealAmp检测类鼻疽伯克霍尔德菌的灵敏度为1×101copies/μL。综上所述,RealAmp灵敏度是普通LAMP的10倍。

A:RealAmp检测类鼻疽伯克霍尔德菌核酸的灵敏度 1~8:类鼻疽伯克霍尔德菌核酸的终浓度依次为 1×107、1×106、1×105、1×104、1×103、1×102、1×101、 1×100 CFU/mL;9:阴性对照;B:RealAmp检测类鼻疽伯克霍尔德菌质粒的灵敏度 1~10:类鼻疽伯克霍尔德菌质粒的终浓度依次为 1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100、1×10-1 copies/μL;11:阴性对照
2.5RealAmp检测人工污染土壤的检出限 人工污染的土壤中类鼻疽伯克霍尔德菌核酸的终浓度为4.4×10-1CFU/g~4.4×1010CFU/g,分别以每个稀释度的核酸为模板,进行RealAmp扩增,结果见图6,1~10号管均出现了明显的扩增峰,为阳性结果,即RealAmp检测人工污染土壤中的类鼻疽伯克霍尔德菌的检出限为4.4×101CFU/g。

1~12:人工污染模拟土壤样本中类鼻疽伯克霍尔德菌核酸的终浓度依次为 4.4×1010、4.4×109、4.4×108、4.4×107、4.4×106、4.4×105、4.4×104、4.4×103、4.4×102、4.4×101、4.4×100、4.4×10-1 CFU/g;13:阴性对照
2.6RealAmp与实时荧光定量PCR的对比检测人工土壤中的类鼻疽伯克霍尔德菌 如图7(A)所示,实时荧光定量PCR检测24份灵敏度范围内的人工污染土壤模拟样本,出现了明显的扩增信号,为阳性结果,检出率为100%,但检出时间较长;如图7(B)
所示,以RealAmp技术检测相同的样本,也均出现了扩增信号,为阳性结果,检出率为100%,且在30 min左右即可查看检测结果。结果表明,RealAmp检测土壤模拟样本的检测结果与预期完全一致,与行业认可的标准方法实时荧光定量PCR的检测结果说明相吻合,且检测时间仅为荧光定量PCR检测时间的1/5,既节省了大量时间,又达到了荧光定量PCR的检测效果。
A:qPCR检测人工污染土壤模拟样本:人工污染模拟土壤样本中类鼻疽伯克霍尔德菌核酸的终浓度依次1~3:为4.4×108 CFU/g;4~6:4.4×107 CFU/g;7~9:4.4×106 CFU/g;10~12:4.4×105 CFU/g;13~15:4.4×104 CFU/g;16~18:4.4×103 CFU/g;19~21:4.4×102 CFU/g;22~24:4.4×101 CFU/g;25:阴性对照;B:Real Amp检测人工污染土壤模拟样本:人工污染模拟土壤样本中类鼻疽伯克霍尔德菌核酸的终浓度依次1~3:为4.4×108 CFU/g;4~6:4.4×107 CFU/g;7~9:4.4×106 CFU/g;10~12:4.4×105 CFU/g;13~15:4.4×104 CFU/g;16~18:4.4×103 CFU/g;19~21:4.4×102 CFU/g;22~24:4.4×101 CFU/g;25:阴性对照
3 讨 论
类鼻疽伯克霍尔德菌与土拉杆菌、炭疽芽孢杆菌皆具有强致病性,可引起高死亡率的类鼻疽。类鼻疽初期的症状与肺炎类似,合并菌血症、多器官损伤和和败血症的患者病死率可高90%,且发病范围广、传播途径多、临床治疗困难,从而导致类鼻疽已经成为亟待解决的公共卫生安全问题,类鼻疽伯克霍尔德菌也被视为经典的生物恐怖剂。
鞭毛蛋白(flagellin,FilC)作为类鼻疽伯克霍尔德菌表面主要抗原,其氨基酸序列高度保守,是引起免疫反应的重要抗原成分之一,由filc基因编码。本次研究针对类鼻疽伯克霍尔德菌filc基因设计一套环介导等温扩增引物,于反应体系中加入荧光染料EvaGreen,利用实时荧光监测仪进行核酸扩增,成功建立了快速检测类鼻疽伯克霍尔德菌的RealAmp技术。在研究过程中,采用建立后的RealAmp技术检测类鼻疽伯克霍尔德菌、布鲁氏菌等13忠细菌和蜱虫DNA,仅类鼻疽伯克霍尔德菌呈阳性结果,特异性强。灵敏度测试采用了类鼻疽伯克霍尔德菌核酸和克隆株质粒进行测试,从类鼻疽伯克霍尔德菌活菌中提取的类鼻疽伯克霍尔德菌核酸保证了实验的可靠性;为了避免活菌裂解不完全,影响灵敏度检测结果,采用构建质粒的方式进一步精确计算灵敏度。RealAmp检测类鼻疽伯克霍尔德菌的核酸和克隆株质粒灵敏度分为100 CFU/mL、10 copies/μL,达到文献报道[15]的实时荧光定量PCR检测类鼻疽伯克霍尔德菌的灵敏度10 copies/μL,且为普通LAMP技术检测类鼻疽伯克霍尔德菌灵敏度的10倍。土壤资源是生态基础中非常重要的部分,在进行类鼻疽伯克霍尔德菌自然疫源地进行调查时,该菌在水源和土壤中的数量与人的类鼻疽的发病率有一定的相关性[16];同时,土壤也是各种生物生存发展的基础,土壤环境中存在成千上万种微生物,环境复杂,进行类鼻疽伯克霍尔德菌的检测时,易受土壤环境中其他微生物和其他物质的干扰。优化后的RealAmp技术可直接对土壤中的类鼻疽伯克霍尔德菌进行检测,且检出限达44 CFU/g,与对照方法实时荧光定量PCR同时检测24份涵盖超低浓度和高浓度的样本,检出率均为100%,验证了RealAmp技术检测类鼻疽伯克霍尔德菌的实用价值。此外,该方法可直接读取反应结果,并在结果读取后可直接终止反应,节约了时间,同时避免了普通LAMP技术观察沉淀的不确定性和用电泳检测的繁琐;上机检测过程中,每管封闭式检测避免了反应过程中由于温度升高而易导致气溶胶污染的现象。
但由于RealAmp技术建立的时间不长,依然存在有不足之处:检测结果只有阳性与阴性两种,只能定性,不能准确定量;设计类鼻疽伯克霍尔德菌的环介导等温扩增引物时,采用了6条引物,虽在恒温条件下进行扩增,但引物之间仍可能形成互补而扩增出非特异性的条带,造成假阳性;RealAmp扩增效率极高,过于灵敏和产物量大,实验室一旦遭到扩增产物气溶胶污染,易出现假阳性,因此在操作的过程中应划分区域,阴性样本和阳性样本应在不同的密闭实验室进行添加,实验器材不能混用,试剂分装后再进行使用;RealAmp实验需要在反应体系中加入荧光染料EvaGreen,其浓度对反应影响很大,浓度过高会抑制反应的进行,浓度过低则会导致荧光信号不明显,不易被仪器搜集,因此荧光染料EvaGreen的添加浓度需要经过实验摸索后确定。
综上所述,此次研究针对类鼻疽伯克霍尔德菌filc基因建立的RealAmp技术具有特异性强、灵敏度高、简便高效等特点,为类鼻疽伯克霍尔德菌的快速检测提供了新的发展方向,有望成为常规的快速检测手段,具有良好的应用价值和发展前景。
