需优先发展防控手段的10种人兽共患病毒病
2019-04-11
2015年12月8日,WHO邀请了部分病毒学、微生物学、公共卫生和临床等领域权威专家,遵循大健康(one health)的原则,列出5至10种在诊断、药物和疫苗等应急应对方面优先研究和研发(R&D)的传染病,这些优先研发人兽共患病毒病不包括已成为全球公共卫生重要问题的HIV/AIDS、结核、疟疾等传染病。于是克里米亚刚果出血热(Crimean-Congo haemorrhagic fever,CCHF)、埃博拉病毒病(Ebola virus disease,EVD)、马尔堡病毒病(Marburg virus disease,MVD)、拉沙热(Lassa fever,LF)、中东呼吸综合征(Middle East Respiratory Syndrome,MERS)、严重呼吸综合征(Severe acute respiratory syndrome,SARS)、尼帕病毒病(Nipah virus diseases,NVD)、裂谷热(Rift valley fever,RVF)为优先研发病种[1]。 2018年2月6-7日,WHO第二次召集有关专家,采用德尔菲、问卷调查和多准则决策分析(Multi - Criteria Decision Analysis, MCDA)法等,再次评出需优先研发的传染病,CCHF、EVD、,MVD、LF、MERS、SARS、NVD、RVF仍在列,并增添了寨卡病毒病(Zika virus diseadse,ZVD)、亨德拉病毒病(Hendra virus diseases,HVD)和未知传染病(Disease X)。除未知传染病用X代表无法预测外,把同为丝状病毒病的SARS和MVD归为一类,合并主要在南亚和澳大利亚传播的NVD和HVD,使已流行的传染病增为8类10种[2]。在这些病原中,CCHF在我国新疆存在,此外2016年2月、9月,分别在我国的江西、广东和郑州等地发现由美洲传入的ZVD。基于我国是人口大国,这些传染病的传入也将危害我国人民的健康和引发社会经济的问题。因此本综述简介这些病毒病的主要临床特征、危害和疫苗研制概况,目的使相关机构和人员重视这些病,为防控做好基础准备。
1 10种人兽共患病毒病的危害及疫苗研制的主要方向
1.1 CCHF
1.1.1CCHF及其危害 CCHF是欧、亚、非三大洲都有分布的蜱媒自然疫源性病毒性疾病。人群普遍易感,感染发病以青壮年为主,但也有2.5~3岁婴幼儿被感染。潜伏期2~12 d。起病急骤,恶寒战栗,体温可上升至39~41℃。头痛剧烈,周身肌痛,四肢关节酸痛剧烈,甚至难以行走。病程早期颜面和颈项部皮肤潮红,眼结膜、口腔黏膜以及软腭均见明显充血。表面黏膜和皮肤在早期即可见到出血点或淤血斑。病程中期见有呕血,严重时连续大量呕血,同时发生血尿和血便。多有肝肿大,但脾肿大者少见。其临床表现与其他型出血热相似,惟肾脏的损伤较为轻微。患者入院时多呈重症,病死率高达50%。本病因在克里米亚和刚果相继发现而得名。该病在我国国内首先发现于新疆巴楚县,南疆地区多,北疆地区也有检出抗体,故在我国又称新疆出血热。从1956年有记载至今,全球已暴发37起疫情,主要病例发生在欧洲及中东地区[3-4]。
克里米亚-刚果出血热病毒(Crimean-Congo haemorrhagic fever virus, CCHFV)属于布尼亚病毒科的内罗毕病毒属。病毒颗粒呈圆形和椭圆形,直径约85~120 nm,外被包膜。CCHFV通过蜱虫叮咬或在屠宰动物过程中和屠宰后与病毒感染的组织接触而传播[4],其分布广,病死率高,无有效药物及防控手段。
CCHFV被列为一类高致病性病原体,操作须在生物安全级别最高的4级实验室(BSL-4)进行[5],历史上认为该病原有可能被恐怖分子改造为生物武器。
1.1.2CCHFV基因组及疫苗研制 CCHFV基因组为单股负链RNA,分大(L)、中(M)、小(S)3个片段,每个片段分别有单独的核衣壳包裹;且每个片段的3C(-AGAGUUUCU)和5C(-UCUCAAAGA)末端保守及互补,可形成环状或柄状结构,作为病毒复制子区。病毒基因组A+U含量〉G+C含量,L片段RNA约12 000 nts,编码L蛋白(〉200×103 kDa);S片段RNA约1760~2050nts,编码N蛋白(48 000~54 000 kDa),N蛋白是在感染细胞可以检测到的病毒主要蛋白;M片段RNA约41400~61300 nts,分别编码糖蛋白Gn(30 000~45 000 kDa)和Gc(72 000~84 000 kDa),Gn和Gc是产生中和抗体的主要抗原蛋白[6],目前主要用Gn和Gc为抗原发展各类疫苗。包括DNA疫苗、植物苗、安卡拉(Ankara)病毒载体疫苗及其修饰苗 (MVA)、腺病毒载体苗等,目前只有MVA苗2017年底受英国政府曾资助进入Ⅰ期临床试验。
由于该病危害大,因此苏联用乳鼠脑培养CCHFV,用58℃氯仿灭活,再用Al(OH)3吸附研制成灭活病毒疫苗。该苗1974年即被保加利亚批准用于CCHF流行严重地区的军事人员(包括医疗和农业人员)的预防接种。目前使用的疫苗株为V42/81,其原始株系1981年从一病人材料中分离的病毒株。据保加利亚卫生部报告,在使用了该疫苗后的22年间,CCHF 的病例有4倍减少(1953-1974: 1 105例; 1975-1996, 279例)[7]。这种简单分析引来很多批评意见,包括是否带毒蜱减少、病例减少原因等未与邻国进行比较。
1.2 EVD和MVD
1.2.1EVD及其危害 EVD病原埃博拉病毒(Ebola virus, EBV)于1976年在扎伊尔(现刚果民主共和国,DRC)分离发现。EVD主要临床表现为高热、体虚、全身关节疼痛和头痛等症状。到目前为止,EBV一共发现有扎伊尔(EBV-Z)、苏丹(EBV-S)、雷斯顿(EBV-R)、塔伊森林(EBV-T)及本迪布焦(EBV-B)5种亚型,除雷斯顿型在菲律宾发现,并只对非人灵长类(non-human primate,NHP)有致病性外[8];其他亚型均对人有毒力,以EBV-Z型感染性最强,病死率也最高。EVD从1976年发现至今一共流行27起(含2018在DRC 发生的两起,最后一起仍未结束流行。EVD在2014及2015年流行最为广泛、严重,涉及了6个非洲国家,疫情迁延至2016年才结束,确认病例28 646人,死亡11 323,其流行亚型为EBV-Z[9]。
EBV的传播途径主要是经密切接触,病毒浓度含量高的气溶胶亦可引起传播[10]。首先以家庭照护病例的密切接触者;其次是严重流行地区临床医生及护士的大批死亡,使患者躲避医疗机构的救治;再次是不安全的宗教信仰和死者的丧葬行为也造成致死性感染。其天然储存宿主及在自然界的循环方式尚未被确认,但目前偏向于蝙蝠、某些啮齿类动物或鸟类作为该病的自然宿主。
2018年4月初,在DRC西部靠近刚果共和国的疆界Equateur省的Bikoro区发生了EVD疫情,包括疑似病例在内的54例EVD病例,有33例死亡,病死率约为61.1%。虽然rVSVΔG-ZEBOV-GP疫苗[13]曾经过NHP临床前研究并曾在2015年在几内亚EVD流行末期使用过,但仍未获批,在疫情暴发时,鉴于该疫苗使用的良好记录,无国界医生组织和WHO仍然使用rVSVΔG-ZEBOV-GP疫苗[15],使得本次疫情得到控制。但在7月底,DRC距Bikoro区2 500 km的北Kiru省及周边地区又发现EVD可疑病列,经DRC卫生部授权的金莎萨国家研究所(the Institut National de Recherche Biomédicale ,INRB)正式报告确认了4例EVD病例,并从时间及间隔距离两个方面判断否认该疫情是Bikoro区EVD疫情的继续。为此DRC再次使用rVSVΔG-ZEBOV-GP疫苗并建立了191个疫苗接种环,为25 298名合格及知情同意者接种了疫苗;截至12月15日止,本次疫情已报告确认病例483例,可疑48例,已死亡313例。 在10月23-25日WHO召开的免疫接种专家组(SAGE)工作会上, 虽然这种环接种方式受到与会专家的肯定,但由于人口众多,疫苗未被批准而无法大量生产等因素,目前在DRC Kiru省的EVD疫情仍未结束。因该区与乌干达、卢旺达、南非等国交界,WHO已发出旅游及跨境贸易禁令。
EBV被列为一类高致病性病原体,病毒分离、鉴定等操作须在BSL-4实验室进行[5]。
1.2.2EBV基因组与疫苗研制 EBV是一种非分节段的RNA病毒,基因组长度约为18 900 nts。病毒属丝状病毒科(Filoviridae),大小平均为长约1000 nm,直径70-90 nm;有脂质包膜,包膜上有呈刷状排列的突起,主要有病毒糖蛋白(Glycoprotein,Gp) 组成,在病毒粒子中心结构的核壳蛋白由螺旋状缠绕的基因体RNA核壳蛋白质以及病毒蛋白VP35、VP30、L组成,其基因排列顺序为:3′-NP-VP35-VP40-GP-VP30-VP24-L-5′[10]。
EBV疫苗研制的种类繁多,到2014年止,有8种抗EBV疫苗研制出来[11],比较看好的疫苗主要有两种,一是黑猩猩3型腺病毒复制缺陷型为载体(ChAd3)的疫苗[12],二是复制型水泡性口炎病毒(VSV)为载体的疫苗[13],二者都插入EBV-Z或EBV-S的Gp,在NHP中都能产生100%抗EBV感染高滴度的中和抗体;但ChAd3疫苗产生的抗EBV中和抗体未能持久,接种数月后下降严重,需要增强接种才能恢复保护性免疫,诱导T细胞反应也被认为是保护性免疫的关键。在利比里亚进行了ChAd3-EBO-Z和rVSVΔG-ZEBOV-GP疫苗的Ⅱ期临床试验(NCT 02344407),证实这两种疫苗安全且具有免疫原性,在接种后1年内,79.5%的rVSVΔG-ZEBOV-GP和63.5%的ChAd3-EBOZ免疫对象保持了抗体应答[14]。rVSVΔG-ZEBOV-GP在利比里亚、几内亚和美国等地进行了约17000人的临床试验,并在2015年几内亚的EBV-Z流行中用环型接种(ring vaccination)策略获得成功,虽然在流行后期EVD感染病例大为减少,无法进行完整的临床研究,但该疫苗仍被美国FDA和Priority Medcines授于“突破性疗法”这一誉名(默克新闻稿,2016年7月25日)[15]。该苗由加拿大公共卫生局(BPSC 1001)开发,随后获得NewLink Genetics和默克夏普公司(Merck Sharp)的赞助。
1.3 MAD
1.3.1MAD及其危害 MAD病原为马尔堡病毒(Marburg virus,MAV),其命名源自1967年欧洲实验室的感染事故。当时在前联邦德国马尔堡、法兰克福和前南斯拉夫首都贝尔格莱德的几所医学实验室的工作人员出现一种类似出血热的疫情,先后有31人感染,死亡25例,流行病学调查证实患者都曾接触过从非洲输入、用于实验研究的长尾绿猴,从死者组织和急性期病人中分离出病毒,因马尔堡病例最多,因此称为MAD。MAD的潜伏期一般为3~9天,病人突然发热、畏寒、头痛、全身疲乏、大量出汗、肌肉酸痛、咽痛、咳嗽、胸痛;最初的症状很像流感,但随后病人会出现恶心、呕吐、腹泻、腹痛、全身皮疹,最后出现口鼻出血、尿血、阴道出血和消化道出血,严重者可发生休克,约有1/4的患者死亡。到目前为止,大小疫情一共报告14起,除马尔堡外,10人以上病例的疫情主要发生在DRC、安哥拉和乌干达,病死率21%~88%不等[16-17]。
感染病毒的NPH和病人是主要传染源。通常先由被感染的NHP (如绿猴) 将病毒传染给人,然后再由病人传染给其他健康人。马尔堡病毒的传染性极强,症状越重的患者传染性越强,潜伏期患者的传染性弱。MAV在自然界中的储存宿主尚不清楚,主要经密切接触传播,即接触病死动物和病人的尸体,以及感染动物和病人的血液、分泌物、排泄物、呕吐物、飞沫等,经粘膜和破损的皮肤传播。在非洲疫区,因葬礼时接触病人尸体,曾多次发生本病暴发流行;此外,通过使用被污染的注射器等可造成医源性传播。有报道,病人在临床康复3月内,仍可在精液中检出马尔堡病毒,因此,存在性传播的可能性。通过含本病毒的气溶胶感染实验动物也有报道[16],因此,其生物安全级别和EBV 一样,其病原必须在BSL-4实验室里操作[5]。
1.3.2MAD基因组与疫苗研制 MAV与EBV一样均属于丝状病毒科。基因组为单股负链RNA,长约19 000nts,编码7种病毒蛋白,包括核蛋白 (nucleoprotein,NP)、病毒蛋白35 (VP35)、VP30、VP24、VP40、糖蛋白4(GP4)、RNA依赖的RNA聚合酶主要成分GP7[16]。
由于MAD的死亡率很高,因此疫苗研制的多种平台都曾有人试过。如DNA疫苗、腺病毒载体、病毒样疫苗颗粒平台等[18-19];但因MAV与EBV-Z同类,且EBV-Z用VSV为载体的疫苗效果较好,因此MAV在研发中也更多偏向使用VSV 作为病毒载体。与构建EBV疫苗一样,Mire等[20]用MAV的GPs代替VSV GPs 构建重组VSV(rVSV)为载体的候选苗rVSV-Marv-GP。用rVSV-Marv-GP单次接种6只食蟹猴后约14个月,所有实验组猴均产生了抗MAV-GP IgG中和抗体;用MAV攻击后,实验组动物中没有一只出现任何临床疾病或病毒血症的迹象,证实所有实验组动物都受到保护;而两只未接种候选疫苗的对照猴表现出与MAV感染相一致的迹象,并均死于MAV的攻击。该研究不仅证实rVSV Marv-GP单苗100%的免疫效果,并证实该效果具有持久性。
1.4 LF
1.4.1LF及其危害LF是由拉沙病毒(Lassa virus, LV)引起的,主要经啮齿动物(多乳鼠属)传播的急性病毒性出血热。临床主要表现为发热、化脓性咽炎、胸骨后疼痛和蛋白尿,重症患者经常发生眼底血压高、出血。该病在上世纪50年代首次发现,1969年从尼日利亚拉沙镇2位病死的美国教会医院护士体内分离出病毒,由此得名[21]。流行地区主要为中非共和国、几内亚、利比里亚、塞拉利昂和尼日利亚等国家,发病率较高,病死率可达15%~22%。自1969年以来,德国、荷兰、英国、日本和美国等国家都出现过输入性LF病例。
LV属于沙粒病毒科(Arenaviridae),该科只有一个属,在西非大部分地区流行。主要宿主为多乳头鼠属,该鼠属携带病源率高;LV在该鼠内多呈慢性持续无症状感染。传染源包括其他啮齿动物,也可以是病人和隐性感染者。主要有三种传播途径:气溶胶传播、密切接触传播、垂直传播。其潜伏期约6~21 d,妊娠3个月的孕妇和胎儿病死率较高。
LV也属一类病原体,感染LV可引起高致死率,因此病毒也需在BSL-4级实验室操作[5]。
1.4.2基因组与疫苗研制 LV基因组由两个单股负链RNA片段组成,一个小片段(S)和一个大片段(L)。S片段编码糖蛋白前体(GPC),GPC在病毒的包膜上以三聚体的形式表达,S片段还编码反方向的核蛋白(NP),从而包裹病毒基因组;L 片段编码病毒基质蛋白(Z)和病毒RNA依赖的RNA聚合酶。
LF因宿主的地域性原因,主要在非洲流行。近期病例达数千例,尤以尼日利亚为多。候选疫苗的研究也是多方面的,1987年起有用LV 的NP或GP1、GP2连接疫苗病毒载体对豚鼠及NHP进行试验;还有用ML29或YFV17D为载体的候选疫苗。虽然2004年就启用VSV为载体的候选疫苗株对小鼠、2005年对NHP(食蟹猴)进行了试验,但因为所选的毒株有地域性差别 无法覆盖所有型别分离株的攻击;2013年Safronetz等[22]用塞拉利昂分离株(Josiah) GPC构建的VSV-LASV-GPC候选疫苗株可抗利比里亚、马里和尼日利亚等国家的分离株,所用NHP(恒河猴)实验动物组抗LV的感染为100%。
1.5 MERS
1.5.1MERS及其危害 2012年在沙特阿拉伯发生一种类似SARS 冠状病毒病,称之为新冠状病毒病,后来发现该病多发生在中东地区,因此改称为中东呼吸综合征(Middle east respiratory syndrome,MERS),其病原为MERS-CoV[23]。截至2018年10月份,WHO接到27个国家的2256例该病例确认报告,病死803例, 病死率35.5%。 约90%报告的病例发生在6个阿拉伯国家(巴林、科威特、卡塔尔、沙特阿拉伯、阿曼和阿拉伯联合酋长国)。2015年3月,一韩国人到阿拉伯半岛旅游感染了MERS-CoV,回国后发病,致使韩国首尔出现了3代病例,本次疫情总计16 000密切接触者被隔离,186人发病,38人死亡[24];2018年9月初,又一韩国人在科威特旅游时感染了,但所幸诊断、报告和隔离及时,未造成进一步的感染扩散。
MERS-CoV是致人疾病的第6种冠状病毒,根据种系发生学区分,MERS-CoV与两株蝙蝠分离来的冠状病毒聚类[23],因此推测MERS-CoV的自然宿主是蝙蝠,中间宿主是单峰骆驼,但目前为止均无实据证明这种传播模式,WHO也只建议在中东旅行时,不喝生驼奶,不吃未煮熟的驼肉。
根据[5]的规定,参照SARS的安全级别,2012年经我国专家组确定MERS-CoV为二类病原体,其分离、培养等病毒操作应在BSL-3进行,灭活材料可在BSL-2操作。
1.5.2基因组与疫苗研制 MERS-Cov病毒基因组为单股正链RNA,大小约为31 000nts,其中5′末端3/4处编码大复制酶,其开放阅读框为ORF1a和ORF1b,这些基因被基因组中mRNA翻译成多聚蛋白及附属15~16个非结构蛋白(NSPs);ORF1b编码S蛋白、E蛋白、M蛋白和 NP蛋白。这些结构蛋白的基因,由病毒亚基因组(Sg)mRNAs翻译而成,形成5′和3′共同末端,并与病毒基因组嵌套在一起,sg mRNAs由基因组其他1/4的可变部分组成,不同种的冠状病毒主要区别在基因组3′端[25]。
MERS是一种高致死性传染病,疫苗靶点为可进入细胞且可产生中和反应的S蛋白。但目前研制的疫苗除了小鼠试验有效外,还没有一种商业化人用疫苗研制出来;有的认为单峰骆驼是直接或间接的传染源,只要简单的研制兽用疫苗阻断MERS-CoV的传播就行。 至2016年止,只有DNA疫苗已进行Ⅰ期临床试验,其他4类(减毒、亚单位及重组载体疫苗)约12种候选疫苗均处于临床前研究阶段;目前则认为用改造的MVA病毒载体及黑猩猩腺病毒载体用于MERS疫苗的研制较为合适。
1.6 尼帕和亨德拉病毒病(Nipah and henipaviral diseases,NHVD)
1.6.1尼帕病毒病(Nipah virus disease,NVD)
1.6.1.1NVD及其危害 1998年9月至次年的5月,马来西亚和新加坡在猪中暴发病毒病,继后引发猪养殖场和屠宰工作人员的死亡。约有116万头猪被捕杀,276人发生严重的呼吸及或脑炎综合症,107人病死,病死率高达38.8%。从患者体内分离到尼帕病毒(Nipah virus ,NiV)。其后在孟加拉、印度和菲律宾等国也发生疫情,特别是在孟加拉国农村某些地区,每年均有定期疫情,而且传播方式大多为人传人,最高病死率可达88%。到2016年为止,已发生过12次NVD疫情,但多在南亚[26-27]。
NiV属于副粘病毒科(Paramyxoviridae)亨德拉尼帕病毒属(Henipavirus)的一个种。检测多种动物,发现中和抗体只在狐蝠属Pteropus的两种果蝠(飞狐)P. vampyrus 和 P. hypomelanus和大多数猪、少数马血液中存在;在多种家畜和野生动物如狗、猫、山羊、野猪和啮齿动物血液中则未见NiV中和抗体。研究认为是果蝠尿液或吃剩的野果感染了猪,果蝠是NiV的天然宿主,猪只是作为NiV传染源的放大器,养猪人和屠宰者是由感染猪的呼吸道的气溶胶和密切接触引起感染,人与人的传播方式类似动物传至人[26-27]。
1.6.1.2基因组与疫苗研制 NiV为单股负链不分节段RNA病毒,与亨德拉病毒密切相关。基因组长18 246nts,其转录和终止信号高度保守,5′和3′末端也高度保守,分别为3′UCCUUGGUUCU5′和3′AAUUCUUUUU5′。基因组共编码6个结构蛋白,从基因组3′始依次为NP蛋白、磷酸化蛋白(P)、基质蛋白(M)、融合蛋白(F)、GP蛋白和大蛋白(L),L蛋白在NV中含量虽少,但其具有RNA聚合酶活性,在病毒的复制和转录过程中发挥重要作用[28]。
NVD疫苗的研制也使用多种平台。但以副粘病毒科的麻疹疫苗载体用于表达NiV糖蛋白亚单位疫苗预期较好。该候选疫苗采用了基础-增强的免疫策略,以Allhydrogel 和 CpG寡核苷酸为佐剂,在单苗接种NHPs 2个星期后,腹腔再接种该苗一次,其后用致死量的NiV攻击,试验证明实验组动物用该苗免疫有效,具有不被NiV感染的能力。Prescott等[28]研制NiV s蛋白+ VSV的候选苗,用单苗接种策略对非洲绿猴抗尼帕病毒的效果进行观察。发现每只用107PFU候选苗接种3只非洲绿猴29 d后,均能产生CD4/CD8细胞免疫和体液免疫应答,经105(TCID50) 马来西亚NiV株气管插管感染,试验组3只绿猴均能经受这种感染攻击;而未接种该候选苗的另3只绿猴中1只死亡,另2只发生严重的疾病过程。试验证实该候选苗单苗接种策略有效,但还未进行临床研究。
NiV生物安全级别高,需在BSL-4级实验室中操作[5]。
1.6.2 亨德拉病毒病(Hendra virus diseas, HVD)
1.6.2.1HVD及其危害 1994年9月,在澳大利亚东岸昆士兰省首府布里斯班近郊的亨德拉镇,一个赛马场发生了一种导致赛马急性呼吸道综合症的疾病。这种疾病的典型特征是严重的呼吸困难和高死亡率,还表现为人接触性感染,当时有14匹赛马和1人死亡[29]。病原体被分离鉴定,证明是副粘病毒科家族中的一员,最初被命名为马麻疹病毒,后被命名为亨德拉病毒(Hendra virus,HeV)。到2016年止,已报告14起疫情,70多匹马死亡,7人发病,其中4人病死[30]。
在发现HeV后,澳大利亚对当地5000多只家养动物进行了抗体检测,未发现有抗HeV的抗体。后来,调查的目标转到了能在发病地区之间活动的野生动物,发现黑狐蝠、灰头狐蝠、小红狐蝠、眼圈狐蝠等四种狐蝠体内具有抗HeV的抗体。此后,又在一只怀孕的灰头狐蝠生殖道内分离到亨德拉病毒。此外,对昆士兰的1043个狐蝠样本进行血清学检测,发现47%的样本呈HeV抗体阳性反应。抗体监测发现狐蝠体内的抗体水平与疾病的地方流行性相一致,预示狐蝠处于感染的亚临床状态。除澳大利亚外,在非洲的Eidolon果蝠中,也发现抗HeV抗体,这证明HeV也曾在非洲流行[31]。虽然没有发现病毒从狐蝠直接传播给马的证据,但实验室模拟感染证实这种方式是可能的,最可能的传播途径就是马食用了被携带病毒的狐蝠胎儿组织或胎水污染的牧草所致;其次,马由于食用狐蝠吃剩的果实而感染也是发病的原因之一;另外病毒在马群中的传播也可能是通过感染狐蝠的尿液或鼻腔分泌物,人由于与病马接触而感染,死亡率约为30%~60%[29]。
HeV生物安全级别与NiV一致,也须在BSL-4实验室操作病毒[5]。
1.6.2.2基因组及疫苗研制 HeV与NiV类似,基因组为单股负链不分节段RNA,长18 234 nts,比NiD小12 nts。基因组表达6个结构蛋白,即NP蛋白、P蛋白、M蛋白、F蛋白、GP蛋白和L蛋白。L蛋白在HeV中含量虽少,但其具有RNA聚合酶活性,在病毒的复制和转录过程中发挥重要作用;对GP 和F而言,不同感染对象(人或马)的功能略有区别,但其他4个结构蛋白功能变化不大。
基于狐幅为HeV的天然宿主、马为中间宿主这样一个传播模式,提出只给马进行免疫接种的理论。目前用Hela细胞培养液提取的可溶性HeV G蛋白为抗原,辅以CpG佐剂作为亚单位疫苗HeVsG,在犬和雪貂中进行了试验[33-34];此后,用4只马(因试验必须在生物安全4级实验室进行)进行了试验(3只接种后攻击,1只为对照),证实经免疫接种的马可抗HeV致死性感染,认为用HeVsG亚单位疫苗接种有效[35]。
1.7 SARS
1.7.1SARS及其危害 SARS又称非典型肺炎(atypical pneumonia),是由新的SARS冠状病毒(SARS-CoV)引起的新发传染病,具有传播快、病情发展迅速、病死率高等特点。从2002年底至2003年7月11日止,从中国大陆传至全球31个国家和地区,总计发病8 462例,死亡829例,病死率为9.8%。SARS临床表现较为复杂,多以急性发热为首发症状,大多伴有头疼、全身酸痛、食欲不振、腹泻和呕吐等症状,并多无流涕、鼻塞等上呼吸道卡他症状;严重者可出现呼吸急促、困难、胸闷,少数患者可发展为急性呼吸窘迫综合征,继而发生心动过缓、血压下降,甚至休克死亡[36-37]。
SARS传播途径主要以呼吸道传播为主。目前自然界确定的病原物种多,但偏向于蝙蝠为自然宿主,中间宿主为果子狸,终末传至人这样一种可能的传播模式[38-39]。
SARS-CoV属二类高致病性病原体,须在BSL-3级实验室中操作[5]。
1.7.2基因组和疫苗研制 SARS-CoV为球形、有包膜,大小约为80~140 nm。其基因组为单股正链RNA,全长约为29 700nts。基因组两侧分别为5′甲基化帽子和3′poly(A)+尾巴结构,有14个ORFs,但主要为5个,分别为编码复制酶蛋白(relicatase, R)、S蛋白、E蛋白、M蛋白及NP蛋白,部分病毒株还可见血凝素脂酶蛋白(haemagglutinin-esterase,HE)。在这些蛋白中,因S蛋白直接与病毒进入细胞及产生中和抗体有关,所以特别重要。其他病毒蛋白与冠状病毒的顺序、大小没有太大区别。
早在发现SARS-CoV 的上世纪60 年代,人们就已发现了HCoV-229E 和 HCoV-OC43这两种冠状病毒,除了婴幼儿、老年人和免疫缺陷者外,它们只引起轻微的感冒样症状。2003年发生SARS-CoV大流行,2012年的6和9月又分别发现两例MERS死亡病例,这就引起人们对冠状病毒的严重关注。种系发生学分析证实SARS-CoV属于β冠状病毒的C系株,而MERS-CoV则属于β冠状病毒的B系株。其种系发生学不同,进入细胞所用的受体也不一样,MERS-CoV用二肽基肽酶4(dipeptidyl peptidase 4 ,DPP4),而 SARS-CoV则是用血管紧张素转换酶(angiotensin-converting enzyme 2,ACE2)为受体[40-41]。
感染SARS-CoV引起高发病率和致死率,已有多个团队对疫苗进行研制,目前已有6类候选苗:一是用灭活疫苗,用化学方法如甲醛、β-丙内脂或辐射灭活SARS-CoV病毒;二是用减毒活疫苗,如将SARS-CoV MA15株编码外核苷酸酶去除而成为细胞内可复制的减毒株SARS-CoV MAΔExoN;三是用病毒疫苗载体,如委内瑞拉马脑炎病毒(VEE)、痘病毒(poxvirus)、副流感病毒(parainfluenzavirus)、狂犬病毒(rabies virus)和水泡性口膜炎病毒(vesicular stomatitis virus)等疫苗株为载体,主要以 SARS-CoV S蛋白为抗原,也有个别苗用NP为抗原;四是只以SARS-CoV S或NP为抗原的亚单位疫苗;五是以SARS-CoV S的DNA疫苗;六是混合疫苗,即是用灭活疫苗与SARS-CoV S为抗原的DNA疫苗混合。上述这些疫苗,除了VEE制备的以SARS-CoV NP蛋白为抗原病毒颗粒疫苗无保护作用外,其他各类苗均可产生保护性中和抗体和细胞免疫,遗憾的是,决大多数动物保护试验使用的是小鼠,只有个别报道使用不尽规范的NHP进行临床前试验,而该疫情亦未再发生,所以也没有任何疫苗被批准使用[42]。
1.8 RVF
1.8.1RVF及其危害 RVF 是由裂谷热病毒(Rift valley feverv virus,RVFV)引起的一种虫媒传播的人兽共患病,主要危及反刍类家畜(牛、羊、骆驼等),造成巨大的经济损失.临床表现为被感染的怀孕母畜大规模流产、新生幼畜约100%、成年家畜10~20%死亡。人感染者主要为家畜养殖人员、屠宰者、近家畜居住者和疫区布署的军人等,一般表现为自限性流感样症状,但部分病例会发展成严重疾病,包括急性肝炎或肝坏死、脑膜炎、出血热或视网膜炎等[43-45]。
RVFV主要由蚊子传播,首先由伊蚊、其后由库蚊作次级放大传播;疫区分为低流行区和高流行区两类,1915年,肯尼亚就报告了动物中可能的RVF疫情,1931年,在肯尼亚的大裂谷地区首次分离到病毒,因此称为裂谷热病毒。由于病毒可经蚊卵传递传播,因此一旦暴发疫情,该地就永为疫区。RVF过去只发生在非洲国家,2000年后该病跨越红海流行至亚洲阿拉伯半岛,目前有34个国家有疫情报告。
RVFV虽经蚊媒传播流行,但其属于二类病原体,实验操作须在BSL-3级实验室进行[5]。
1.8.2基因组和疫苗研制 RVFV属于布尼亚病毒科白岭病毒属,RVFV只有一个种一个血清型,但至少有7个基因型。RVFV是有包膜的RNA病毒,大小约90~110 nm,包膜由脂质双层构成,表面由糖蛋白Gn和Gc组成异源二聚体覆盖,形成约122个颗粒组成的规则二十面体网络状病毒结构。基因组由3个单股负链部分双义的RNA节段(L、M和S)组成(见图1),每个RNA节段具有相同的3′和5′端可互补的序列,可形成共价闭合环状的RNA病毒粒子[46]。

左侧图示模拟的含有S、M和L 3个RNA片段的病毒粒子,并示Gn和GC结合到膜脂双层中;右图示RNA片段和编码策略。L=L蛋白;NSm=非结构蛋白;Gn和GC=糖蛋白;N=核蛋白;NSs=非结构蛋白。
RVFV主要在家畜中传播,再传给人类。因此很早以来人们就把该病对家畜的防控摆在首位,疫苗的研发和使用也主要针对家畜。现已使用或在研的疫苗:第一类是常规使用的疫苗,包括灭活疫苗和活减毒疫苗;第二类是新研发的疫苗,主要有3个类型:1.用重组核酸生产的抗原(重组蛋白等4种疫苗);2.通过缺失编码的毒力因子及病毒复制不必要的基因的遗传减毒苗(基因减毒活疫苗);3. 病毒载体苗(含黑猩猩腺病毒等5种疫苗载体)。特别应指出的是,在第一类常规使用的疫苗中,MP12活减毒疫苗的效果最好。其研制主要在含5-氟尿嘧啶培养液中培养的MRC-5细胞中传了12代,造成在3个节段的RNA中发生不同程度的基因重复突变;用恒何猴经鼻腔或用气溶胶经粘膜接种均产生了可保护强毒株攻击、效价为1:40的中和抗体,其后有100多名志愿者参与的临床研究证实该苗具有很好的免疫耐受性和免疫原性[47-50]。
1.9 ZVD
1.9.1ZVD及其危害 ZIKV是ZVD的病原,一种由埃及伊蚊(Aedes aegypti)携带的非洲黄病毒,于1947年从乌干达寨卡森林的一只发热的恒河猴身上发现。过去人类一直认为ZVD是一种以皮疹、发烧、结膜炎、关节痛和关节炎为特征的自限性轻度疾病,因此ZVD的疫情很少有记录、报告,但血清学检测表明人类曾广泛暴露给ZIKV[51]。
2007年在西太平洋的密克罗尼西亚南部邦联州Yap岛上暴发第一次ZVD 的流行,受影响人口约为该岛的3/4;2013年在法属波利尼西亚群岛发生第二次暴发;这两次暴发期间,在东南亚的菲律宾、柬埔寨等地也发生了ZVD的流行传播[52-58]。波利尼西亚群岛暴发的发病率很高,而且证明ZIKV感染与格林巴利(Guillain-Barré)综合征的发展有关[59]。此后,ZIKV一直在太平洋多个岛屿上传播,并传入南美洲[60]。2016年夏天,西半球40多个国家报告了ZIKV的当地感染。引起人们注意的是,除了格利巴利综合征外,美洲的ZVD流行还与孕妇感染的婴儿的神经发育缺陷有关,包括小头畸形症[61]。流行病学证据和从胎儿脑中分离出病毒证实了ZIKV感染与小头畸形之间的因果关系,这种病理生物学的一些重要特征在小鼠模型中被揭示[62-64]。性传播和在眼睛、睾丸等特殊部位上复制的能力也是ZIKV的特有性质,这也使得该感染控制和治疗趋于复杂化[65-67]。
该病原按国家卫计委的标准,定为三类病原微生物,可在BSL-2操作,但在运输上应类同于二类病原[68]。
1.9.2基因组和疫苗研制 ZIKV基因组由单股正链的RNA构成(如图2所示),大小约为10 749nts。有一单一多聚蛋白ORF,这个多聚蛋白可裂解为C蛋白、膜蛋白前体(prM)、E蛋白和7个非结构蛋白。E蛋白位于病毒表面,可使病毒附着在细胞上,是产生中和抗体主要的靶抗原;prME可形成亚病毒颗粒(subviral particles,SVPs),这种SVP与野生型病毒一样具有膜融合和产生中和抗体等特征。NS3是非常重要的非结构蛋白,具有蛋白酶作用,可从C末端裂解prM并和NS2B结合形成NS2B3,NS2B3可形成一个抗原性很强的亚单位蛋白苗;此外,NS3可与干扰素一样产生抗病毒分子[69]。
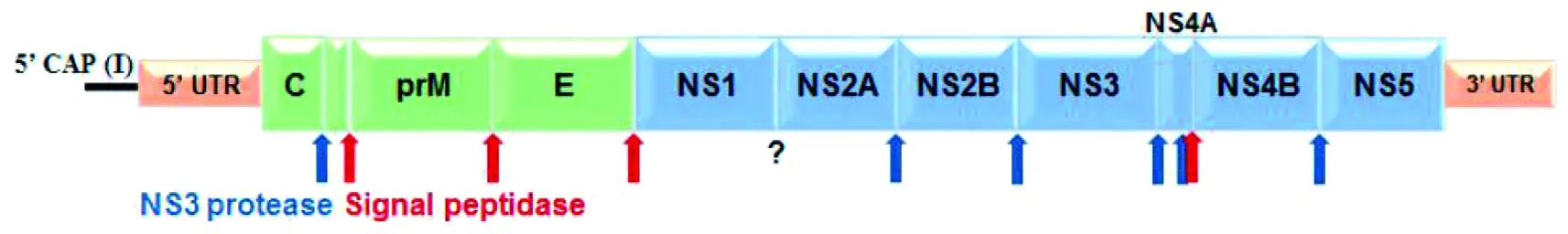
基因组的N端编码病毒形成所必需的结构蛋白(C-prM-E),非结构蛋白NS1-NS5在病毒复制、多蛋白处理、细胞介导的免疫应答以及免疫逃避等方面起着重要作用。
由于2018年ZVD疫情的回落,WHO不再把ZVD视为国际关注的公共卫生事件(PHEIC)[70],但因为该病引起格林巴利综合征及婴儿神经发育缺陷的小头畸形症,因此预防该病疫情的再起仍为各国所关注,研制疫苗自然也就成为防控的重要目标。目前已有多种在研的疫苗,已进行临床试验的疫苗有4类15种,主要是DNA和纯化灭活两类疫苗,占受试苗的80%。 前者为5种,以prME为抗原,主要研制单位为美国变态和传染病研究所(NIAID)和美国Inovio Pharmaceuticals and GeneOne Life Sciences公司,其中有一研究已进入Ⅱ期临床试验,最快在2020年出结果;后者7种均为美国Walter Reed Army Institute of Research and NIAID联合研制的灭活苗产品,抗原均为纯化的病毒颗粒,目前有的已完成Ⅰ期临床试验,有的正在进行Ⅰ期临床试验。Larocca等(2016)[71]用波多黎各株经Vero细胞制备的灭活病毒颗粒辅以铝佐剂形成的疫苗接种恒河猴,两剂次(0~4周)接种后可抗巴西及波多黎各株的攻击,一年后测定其在恒河猴中产生的中和抗体效价高于用DNA苗所免疫的动物;其他减毒活疫苗及mRNA等苗也可产生中和抗体,但都未进入Ⅱ期临床试验。
2 对优先研发10种传染病防控的探讨
2.1应对这些病进行监测 前已述及,WHO要求优先研究和发展的这10种病毒病对人类的总疫情要比艾滋病、结核病、疟疾等重要传染病疫情少很多,但这些疾病有其特点:第一,它们都是人兽共患病,有特定流行年份、季节,其流行方式将给人类生命健康造成重大威胁;其次,作为人兽共患病,其病原在自然界某些动物中无症状或亚临床症状循环,在适当的时候,它们仍会从动物传至人,如SARS和目前仍在民主刚果流行的EVD,因此人类往往难以预测其发生大流行的时间、地点;第三,这10种病一般呈地域性流行,由于其对人有传染性,容易引起地域内人类大规模的流行;第四,这些病的病原大多为高致病性病原微生物,对其分离、鉴定等操作均需在BSL-4或 BSL-3实验室进行, 只有嗜神经性的ZIKV,才可能在较低生物安全的BSL-2实验室操作,这些特点也阻碍了对它们的研究和发展。因此,需要从地域性方面,对这些疾病进行监测。
2.2从大健康角度出发,控制人兽共患病 目前国际上提倡并推行大健康的策略,这10种病毒病均可引起动物死亡或者人的神经性损伤发生,如 NiV和 RVF等。动物传染病的流行不仅造成严重的社会经济损失,影响社会的发展,同时也影响了人类的健康。因此,实行动物健康,严格按照我国和各地制定的管理条例对染病动物进行处理、限制流通、加强对动物的监测、疫苗接种预防等综合措施防控家畜传染病,强化环境卫生和人类健康这三位一体的行动,不仅关乎社会的进步发展,而且也预防传染病在人类的发生,这种大健康的理念,也是促成优先研发这10种病毒病的原因。
2.3要加强和重视国境检疫 这10种病虽然存在着敏感动物的地域性因素,也就是除SARS流行过、新疆存在CCHF外,其它8种还未在我国流行过。但社会的进步发展,交通的便利、快速,这些因素很容易造成传染病的大范围传播;SARS的流行传播已明显提示了这一点。已有报道ZIKV曾输入我国境内,该病今年也曾在邻国印度暴发流行。我国沿海地区的生态环境、蚊虫种类及人口密度完全适合ZIKV的流行,因此,这种可引起人类发生格林巴利综合征及小头畸形症的蚊媒传染病侵入我国是迟早的事,应引起我们的警惕,除要进行经常性的灭蚊降低伊蚊密度外,要加强和重视国境检疫的把关作用。
2.4疫苗是预防疫情发生的重要环节 对于疾病的防控,除保护动物健康做好环境卫生和个人卫生外,还必须从其流行环节和因素严格防控。首先要加强应急培训和检测技术的掌握,对疑似病例的隔离和医疗机构的隔离防护治疗要到位,此即传染源的控制;其次要切断人-人的传播的途径;第三,就是对敏感人群的保护。不论是直接或是间接的传播,从流行病学干预考虑,其最有效最直接最经济的防护就是使用安全有效的疫苗,而疫苗是要进入人体的物质,因此研制安全有效的疫苗是保护敏感人群的关键;多种疫苗的研制并非使用一种平台就能解决,这要视病原和传播途径而定。对于现代疫苗的研制,还必须了解病原体的基因组结构,这是疫苗研制的准则;也是对WHO优先研究和发展的10种传染病防控的最好准备。
