野生水鸟感染霍乱弧菌和沙门菌等病原菌的分离和鉴定
2019-04-11,,,,,,,,,
, , , , , , , ,,
野生动物被认为是“病原的天然储存库”,许多烈性的人类传染病如SARS和埃博拉等,其感染和传播的源头都指向野生动物。近些年来,迁徙鸟类传播禽流感的风险也引起全社会的广泛关注[1-2]。实际上,迁徙的野生鸟类还可能携带和传播各类主要经肠道感染的病原细菌[3],一方面可能对水源环境和水产养殖造成污染,另外也可能直接或间接的导致人类感染疾病[4],由此产生的生物安全和公共卫生问题也值得关注。但是,野生鸟类感染和传播人兽共患病原细菌的报道,特别是来自国内的报道非常少。2017年8月,内蒙古自治区某湿地自然保护区内发现大量的野生鸟类死亡,本单位采集部分死亡鸟类的组织标本,分离和初步鉴定出霍乱弧菌和沙门菌等多种肠道感染相关的病原菌,本研究可为迁徙野生鸟类携带人兽共患病原菌的科学和疾病防控研究提供参考数据。
1 材料与方法
1.1 材料
1.1.1仪器设备 细菌鉴定使用美国BD公司Phoenix100型全自动微生物鉴定仪,其它为细菌学试验用常规仪器。
1.1.2菌株 都柏林沙门菌参考菌株和O1型霍乱弧菌分离株为本室保存的菌株。
1.1.3培养基及试剂 细菌培养基和厌氧产气包购自青岛海博生物公司;Trizol试剂为Invitrogen公司产品;PrimeScriptTMRT reagent Kit、PCR Master Mix和DNA Maker等为TaKaRa公司产品;引物合成和测序由吉林省库美生物公司完成。
1.2 方法
1.2.1标本采集和运输 采集的死亡鸟类推断死亡时间均在1 d以内,个体保存完整,观察体表无明显的溃烂和伤口;解剖观察各脏器没有明显的出血和坏死病灶,仅肠道有充血或轻微出血的病变。无菌采集心、肝、脾和肺等组织标本,并剪取一段病变部位的肠段,放在无菌采样管中,然后放入采样箱中加冰袋运送到实验室。
1.2.2细菌分离培养 组织标本在脑心浸液琼脂和胰胨-亚硫酸盐-环丝氨酸(TSC)琼脂平板上划线接种,分别在需氧和厌氧的条件下培养。
1.2.3细菌鉴定 需氧分离培养的典型单菌落首先进行革兰氏染色、镜检观察,然后选择对应的细菌鉴定卡使用Phoenix100微生物鉴定仪进行鉴定;厌氧分离培养的细菌挑取黑色的单菌落;所有获得的菌株同时使用通用引物测定16s rRNA序列,利用GenBank数据库进行BLAST比对,鉴定细菌种属。
1.2.4细菌毒力基因的PCR鉴定 霍乱弧菌和沙门菌相关毒力基因的PCR鉴定引物如表1所示,参考相关文献合成[5-10]。产气荚膜梭菌参考相关文献[11]合成4种主要毒素基因(α、β、ε和ι毒素)的鉴定引物,基于PCR鉴定的结果确定毒素型。
1.2.5病毒核酸检测 组织标本匀浆后使用Trizol试剂提取总RNA,参照国家标准《禽流感病毒RT-PCR检测方法 NY/T 772-2013》和《新城疫诊断技术 GB/T 16550-2008》规定的RT-PCR方法检测禽流感和新城疫病毒的核酸。
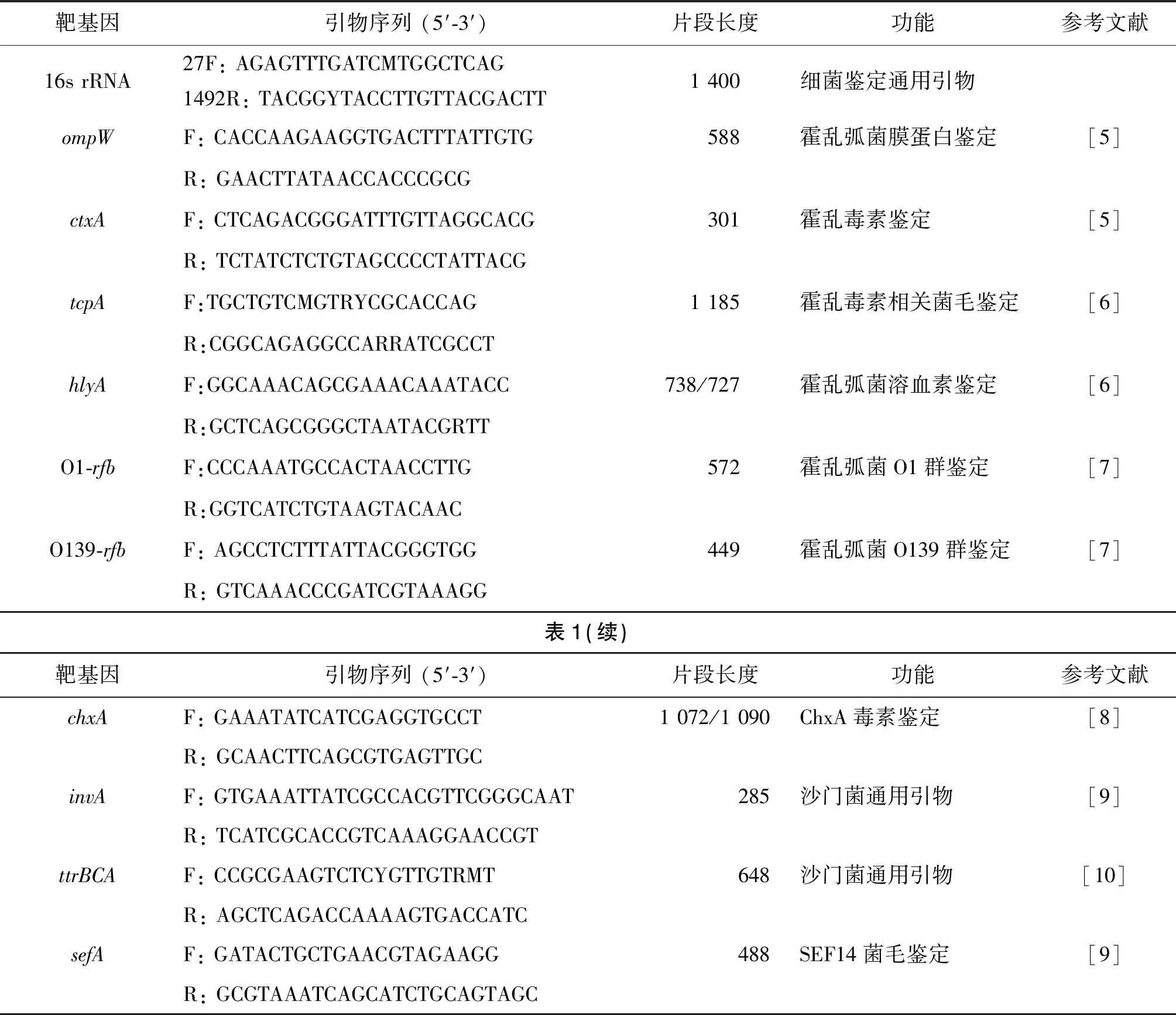
表1 霍乱弧菌和沙门菌PCR鉴定引物Tab.1 Primers used for identification of Vibrio cholerae and Salmonella sp.
2 结 果
2.1细菌分离鉴定结果 共采集4只死亡野鸟的病料组织标本,细菌分离鉴定的结果如表2所示。其中有1只死亡的赤颈潜鸭在本研究培养条件下未分离到任何的病原细菌,有2只野鸟(鸬鹚和骨顶鸡)分离到霍乱弧菌,2只野鸟(红嘴鸥和骨顶鸡)分离到沙门菌,其它分离到的致病菌和条件致病菌还包括产气荚膜梭菌、温和气单胞菌和类志贺邻单胞菌等。

表2 野鸟的病料组织标本细菌分离鉴定结果Tab.2 Isolation and identification of pathogenetic bacteria from diseased tissue of wild birds
2.2产气荚膜梭菌毒素分型结果 经PCR鉴定,所有分离菌株仅α毒素基因鉴定为阳性,其它3种毒素鉴定均为阴性,说明本次分离的产气荚膜梭菌均为毒素A型。
2.3霍乱弧菌毒力基因的鉴定结果 PCR鉴定的结果如表3所示,本次分离的菌株检测霍乱弧菌特异性膜蛋白ompW和溶血素hlyA基因为阳性,而检测O1和O139血清群的特异性rfb基因以及霍乱毒素ctxA基因、霍乱毒素相关的菌毛和ChxA毒素基因均为阴性。说明本次分离的霍乱弧菌不属于O1和O139血清群,也不携带霍乱毒素。

表3 霍乱弧菌毒力基因的PCR鉴定结果Tab.3 PCR result of Vibrio cholerae virulence genes
2.4沙门菌毒力基因的鉴定结果 经PCR鉴定,本次分离的菌株检测沙门菌侵袭基因invA和四氢叶酸还原酶结构蛋白基因ttrBCA均为阳性,检测sefA菌毛基因为阴性,而都柏林沙门菌参考菌株检测3种基因均为阳性。
2.5病毒核酸检测结果 经RT-PCR鉴定,所有标本检测禽流感和新城疫病毒的核酸均为阴性。
3 讨 论
从本次死亡野鸟的病料标本中分离到多种的病原细菌,其中类志贺邻单胞菌和温和气单胞菌等是人或动物临床常见的条件致病菌和继发感染的细菌;产气荚膜梭菌也是环境和动物肠道内的常在菌,在特殊条件下可能异常的聚积、增殖并产生毒素,导致动物急性发病死亡[12],也可能导致人类的食物中毒性疾病。而在传统意义上,霍乱弧菌和沙门菌都是能够引起原发性肠道感染的病原菌。
霍乱弧菌较多分布在河流入海口等有一定盐度的水生态环境中[6-7],其O1和O139血清群携带霍乱毒素,能够激活肠上皮细胞的腺苷酸环化酶,引起cl-离子的分泌和Na+离子的吸收障碍,水伴随着离子进入肠腔,引起严重的水样腹泻。而其它非O1/O139血清群菌株也可能携带其它的毒力因子,导致腹泻或者其它的感染疾病。例如,近些年新鉴定的cholix毒素(ChxA)[13],是一种真核细胞延伸因子2(eEF2)特异的ADP核糖基转移酶,可阻止细胞的蛋白合成,表现强烈的细胞毒性。本次分离的菌株非O1/O139血清群,没有霍乱毒素和cholix毒素,可能并非高致病性的菌株。但是这些低致病性的菌株分布在水环境中,并且可能被迁徙的候鸟携带进行更广泛的传播,也会在霍乱弧菌毒力菌株的进化中发挥重要的作用。
沙门菌是世界范围内最常见的食源性疾病的病原菌,分为不同的血清型。本研究中鉴定的3种毒力相关基因,invA和ttrBCA存在于所有血清型的菌株中,也是沙门菌属最常用的特异性鉴定基因[9-10]。而sefA是沙门菌SEF14菌毛的编码基因,该菌毛主要存在于肠炎沙门菌(S.Enteritidis)和禽病相关血清型等O抗原D1群的菌株中[14]。本次分离的菌株都不携带该菌毛的编码基因,初步判定并非肠炎沙门菌和引起鸡白痢和禽伤寒的S.Pullorum和S.Gallinarum等主要禽病相关的血清型。下一步的工作中,拟使用沙门菌属的诊断血清试剂盒鉴定本次分离菌株的血清型,并评估其感染致病的风险。
本次的野生水鸟死亡事件,经实验室检查排除禽流感等高风险的病毒性感染,分离到霍乱弧菌和沙门菌等可导致人类肠道感染的病原细菌。具体的病因还有待商榷,因为并不是所有的鸟类都分离到统一的病原菌,病死鸟解剖也没有观察到典型的禽类沙门菌病或产气荚膜梭菌感染导致的多脏器的炎症、坏死和出血等病变。推测病因可能是环境应激或者食物匮乏等因素导致的鸟类自身抵抗力下降并伴有病原菌的入侵等综合因素。但是通过本次事件,迁徙的鸟类携带的病原细菌对水源环境和水产养殖可能造成的污染,继而导致的生物安全和公共卫生问题值得关注。本次发现的骨顶鸡、鸬鹚和红嘴鸥等死亡鸟类都是北方常见的夏候鸟,一些抵抗力弱的鸟类死亡可能污染当地水质,而其它候鸟随着迁徙季节到来还可能将这些病原细菌扩散到更大的范围。因此,对迁徙鸟类及其主要栖息地的水质等进行持续的监测是保护生态环境重要的环节。
