猪孤雌激活胚胎和卵母细胞体外成熟过程中的甲基化检测
2019-04-11宋尚桥曾素先马围围王睿敏孙翠翠黎宗强
宋尚桥,曾素先,马围围,王睿敏,严 瑾, 孙翠翠,李 鑫,黎宗强*
(1. 广西大学动物科学技术学院,广西 南宁 530004;2. 南宁市江南区沙井街道办事处水产畜牧兽医站,广西 南宁 530045)
【研究意义】DNA甲基化是调节核重编程的众多重要因素之一,其与一系列生命过程不可分割,例如基因激活、细胞分化与发育、以及衰老等等。因此,对于DNA甲基化的探索成为近年来的热点的研究话题。在近些年的研究报道中发现DNA甲基化异常现象存在于很多种动物的体细胞克隆胚中[1-3]。开展猪孤雌激活胚胎甲基化水平的研究,有助于了解早期胚胎的基因组甲基化的进程和发展,对于胚胎发育具体的机制的研究以及深度探讨胚胎发育失败的原因具有深远的影响和重要的意义。【前人研究进展】DNA甲基化异常现象存在于很多种动物的体细胞克隆胚中[1-3]。若想要将克隆有效的进行下去,对于甲基化被反转而又能重新被建立这方面是不可或缺的[4],然而,对于甲基化的再一次形成以及去甲基化的具体机制尚不明确。有关报道表明,在发育成熟后的卵母细胞以及精细胞中存在多个CpG位点被甲基化,这个阶段的甲基化水平虽然低于精子的甲基化成熟,但是,就总体而言,受精前配子的甲基化呈现出一个较高的水平[5]。而大范围的脱甲基化是在胚胎植入前期进行。如果在卵子成熟期,卵子的甲基化水平低或者是不正常,会引起受精卵的甲基化异常,进而导致胚胎的发育异常。目前普遍认为为了使核再程序化进行得更完全,MⅡ期卵母细胞质是适宜的受体,而处于G0期或G1期的体细胞核是合适的核供体,检测卵母细胞发育的情况为核移植,克隆等技术打下坚实的基础,提高核移植和克隆等技术的效率。精子和卵子甲基化程度的差异被认为是配子“印记”的可能机制。然而,超数排卵母猪的胚胎在合子时期,父本基因组在受精后迅速的发生去甲基化,而母本的基因组保持的高度的甲基化水平[6]。在兔子和羊的合子中用同样的染色方法,却没有发现类似的变化[7]。Kono KT等人[8]研究发现,父方的基因印记对于孤雌生殖的影响可能是主要的影响因素,而父方的染色体基因印机对后代的发育密切相关的这个严谨设计的实验对单亲哺乳动物后代不能发育的定论是一个极大的冲击,与此同时也说明了哺乳动物的发育与基因组保持正常的印记状态之间是密不可分的。【本研究切入点】目前,有关于孤雌胚胎印迹基因、卵母细胞成熟过程的基因组甲基化、胚胎细胞的凋亡、甲基化、端粒长度的改变等方面的研究性报道较多,但是在卵母细胞的成熟以及孤雌激活胚胎方面还未见报道。【拟解决的关键问题】根据对猪孤雌激活胚胎培养过程和猪卵母细胞体外成熟前后的DNA甲基化水平及其变化的检测,为更好的探讨猪孤雌激活胚胎和卵母细胞的发育提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 从广西南宁市附近的屠宰场收集猪卵巢,并置于25 ℃的0.9 %生理盐水中运回实验室,用0.9 %生理盐水冲洗3次。
1.1.2 主要试剂 所用化学试剂除特别指明外均购自Sigma公司,如:离子霉素,6DMP;洗卵液(CCM);胚胎培养液(NCSU)。培养用TCM-199购自Gibco公司,鼠源抗5-甲基胞嘧啶单克隆抗体、FITC标记的羊抗鼠二抗购自calbiochem公司,一次性塑料皿为NUNC公司产品。FSH和L H均为中国科学院动物研究所生产。
1.2 试验方法
1.2.1 成熟卵母细胞的收集 用注射器(带针头)在卵巢表面上抽取直径为2~6 mm卵泡的卵母细胞,在显微镜的观察下用玻璃吸管吸取胞质呈均匀分布和2层卵丘细胞以上的卵母细胞选择具有完整卵丘细胞层及均匀细胞质的卵母细胞用CCM洗净。
将卵母细胞以30~60枚为1组转移至玻璃平皿(30 mm×10 mm)中,这个玻璃平皿含有1.5 mL成熟培养液,并将玻璃平皿放入培养箱中进行体外成熟培养,培养箱的条件设定为38.5 ℃、5 % CO2和最大饱和湿度。
试验将细胞分为7组:未成熟卵母细胞甲基化检测;体外成熟12 h卵母细胞甲基化检测;体外成熟24 h卵母细胞甲基化检测;体外成熟36 h卵母细胞甲基化检测;体外成熟36 h有极体卵母细胞甲基化检测;体外成熟48 h有极体卵母细胞甲基化检测;体外成熟48无极体卵母细胞甲基化检测。
1.2.2 猪卵母细胞的体外成熟培养 将卵母细胞以30~60枚为1组转移至玻璃平皿(30 mm×10 mm)中,这个玻璃平皿含有1.5 mL成熟培养液,并将玻璃平皿放入培养箱中进行体外成熟培养,培养箱的条件设定为38.5 ℃、5 % CO2和最大饱和湿度。
1.2.3 猪卵母细胞的孤雌激活 将猪卵母细胞进行体外成熟培养,经过44~48 h后放入含0.1 %透明质酸酶的洗卵液中,用200 μl的枪头轻轻吹打震荡并随之将卵丘细胞清除,在40倍的体视显微镜下用肉眼观察是否有卵母细胞排出第一极体,以排出第一极体作为卵母细胞核成熟的标志,将核成熟卵母细胞挑选出来。在用2.5 mmol/L二甲氨基嘌呤处理4 h之前,先用5 μmol/L离子霉素处理5 min,最后再移到每滴100 μl的胚胎培养基中培养168 h。培养在含5 % CO2的空气、最大饱和湿度的39 ℃培养箱。
1.2.4 激光共聚焦显微镜荧光半定量检测[7]
(1)用0.3 %~0.5 %的链蛋白酶去除透明带。
(2)4 %多聚甲醛室温30 min。
(3)PBS液洗涤1~2次,0.5 % TritonX-100室温处理20 min以增加细胞膜通透性。
(4)加入4M盐酸处30 min使DNA变性。
(5)用100 mM Tris-HCl缓冲液(pH 8.5)中10 min。
(6)PBS液洗涤3遍(每次静置5 min),在2 % BSA的PBS液中室温封闭1 h以封闭抗体的非特异结合位点。
(7)分2组:一组为样品阴性对照(直接加羊抗鼠FITC二抗孵育,避光,室温,1 h),剩余进行以下免疫结合。
(8)200倍浓度的鼠源抗5-甲基胞嘧啶单克隆抗体中孵育,4 ℃冰箱中过夜保存。
(9)PBS液洗涤1~2次(每次静置5 min),加100倍浓度的羊抗鼠FITC二抗孵育,避光,室温,1 h。
(10)PBS洗涤1~2次(每次静置5 min),封片;封片步骤:①将放在酒精中的载玻片和盖玻片取出,用丝绸擦拭干净;②在载玻片左侧,与盖玻片面积相当大小4个角落,涂上4滴石蜡油以起到支撑作用,防止细胞被盖玻片压碎;③在4个石蜡油滴中央涂上20 μl封片剂;④取出洗净的胚胎,每片10~15枚胚胎放入封片剂中央;⑤顺时针拨动位于封片剂的胚胎,使之均匀分布在4个石蜡油滴的中央区域;⑥待水分蒸发少许,轻轻盖上盖玻片,对角线轻压盖玻片,使细胞与盖玻片、载玻片均有接触,不要太用力,防止把细胞压碎。
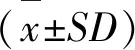
1.3 统计分析
所得实验结果均用SPSS 11.0软件进行统计分析,计量资料分析用t检验,P≤0.05差异有统计学意义。随后的图像处理使用Photoshop 7.0 软件[7]。
2 结果与分析
2.1 对卵母细胞体外成熟过程中的甲基化检测
用免疫荧光组织化学法对7组卵母细胞进行染色,发现不同时期各发育阶段卵母细胞的荧光强度均有差异,说明在各个不同的时期以及不同的发育阶段卵母细胞的核全基因组的DNA甲基化水平呈现出不同的差异(图1)。
对上述免疫荧光组织化学法染色的卵母细胞进行激光共聚焦显微镜荧光半定量检测,发现猪卵母细胞体外成熟阶段的甲基化水平整体甲基化水平较高,这样高的甲基化水平正是满足猪卵母细胞在受精前所必备的条件。猪卵母细胞体外成熟阶段的甲基化水平在整体水平上是一个逐渐上升的趋势,但在36 h的卵母细胞体外成熟阶段的甲基化水平达到一个峰值(表1)。
2.2 对孤雌激活胚胎体外培养过程中的甲基化检测
用抗5-甲基胞嘧啶(5MeC)抗体免疫荧光染色法对附植前的猪PA胚胎二细胞期、四细胞期、八细胞期、桑葚胚期和囊胚期进行免疫荧光染色,发现不同细胞期的荧光强度不一样,表明不同时期各发育阶段卵母细胞的核全基因组DNA的甲基化平均水平不同。从八细胞期、桑葚胚期和囊胚期可以明显观察到在同一枚胚胎中,不同卵裂球的染色强度不同(图2)。

图1 猪卵母细胞体外成熟前后的DNA甲基化模式Fig.1 The DNA methylation pattern in pig before and after maturation oocyte
表1猪卵母细胞体外成熟前后发育过程中的单细胞核全基因组DNA甲基化变化
Table 1 Individual nuclei DNA methylation changes of the pig oocytes before and after maturation
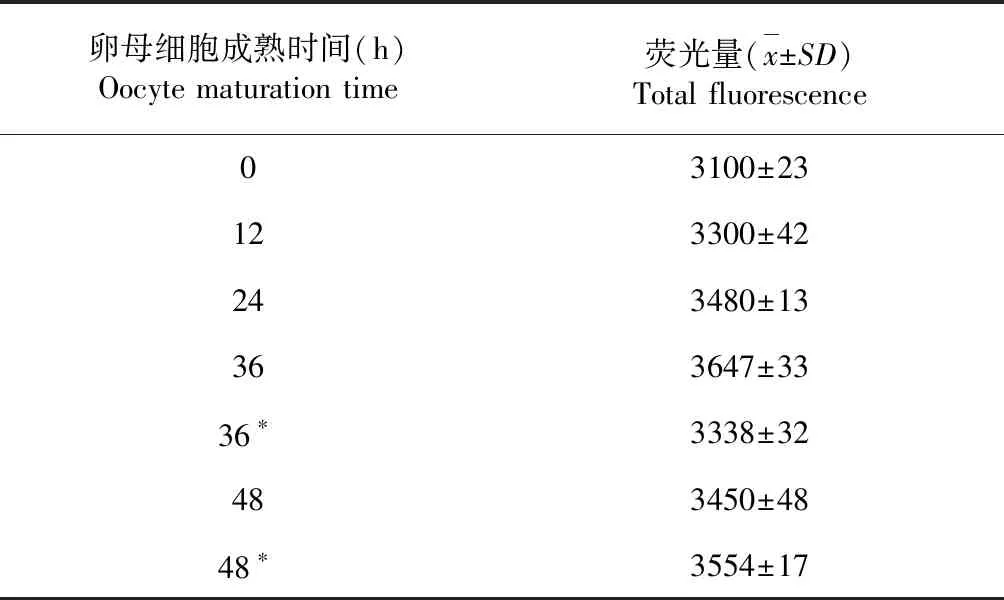
卵母细胞成熟时间(h)Oocyte maturation time荧光量(x±SD)Total fluorescence03100±23123300±42243480±13363647±3336∗3338±32483450±4848∗3554±17
注:*为有极体。
Note:*means polar body.
对上述抗5-甲基胞嘧啶(5MeC)抗体免疫荧光染色法染色的猪PA早期胚胎二细胞期、四细胞期、八细胞期、桑葚胚期和囊胚期进行激光共聚焦显微镜荧光半定量检测,发现猪PA早期胚胎单细胞核全基因组DNA呈现出高度的甲基化。但从二细胞到囊胚期过程中,猪PA早期胚胎DNA甲基化水平由高到低,然后再升高的这样一个波动的变化,并在桑葚胚期出现一个谷值(表2)。
3 讨 论
有研究结果表明,超排、体外受精以及培养条件的不同等的非自然操作会使得2-细胞胚胎的甲基化缺陷[12]。除此之外,从8-细胞到桑椹胚这个时间段的卵裂球细胞之间的甲基化水平的不同与发育至囊胚细胞谱系分化(即内细胞团和滋养层细胞)的相关性尚不明确,需要进行深度的解析和探讨。猪卵母细胞的体外成熟模拟卵母细胞在体内的发育机制,营造一个和体内相似的环境,使其在体外发育成熟,为胚胎移植、孤雌激活和体外受精等方面提供了一定的理论基础和研究思路。

表2 猪PA早期胚胎单细胞核全基因组DNA甲基化变化
本研究使用免疫荧光染色的方法对猪卵母细胞体外受精胚胎的全基因组甲基化模式进行分析,发现成熟前后的猪卵母基因组甲基化情况变化很大,分析可能是体外成熟的结果,即:卵母细胞从卵泡抽出来,进入人工模拟的卵泡环境,导致甲基化水平升高。纵观整个的猪卵母细胞体外成熟阶段的甲基化水平,整体的高的,和文献报道的结果相类似[13],这样高的甲基化水平正是猪卵母细胞在受精前必备的条件。如果低的甲基化,或者是其他的非正常情况,可能会引起胚胎的发育不全或者是缺陷[14]。也只有接近于供体核的甲基化水平,才能担当作为受体的的重任。可见,猪卵母细胞的体外培养模式已经趋于成熟。
将猪PA和牛IVF早期胚胎单细胞核全基因组DNA甲基化变化进行比较,发现在孤雌激活胚胎的二细胞、四细胞、八细胞的细胞核都呈高度的甲基化,到桑葚胚(约有25个卵裂球)时期,总体的甲基化水平均呈现下降趋势[7]。这种趋势和猪体内的早期胚胎基因组甲基化水平的变化是一致的[6]。和牛以及小鼠的相比较,也是大体一致的[7, 10]。这个去甲基化状态是逐步的,被动的和DNA复制依赖性的,与发生第1次DNA复制和细胞分裂后,细胞核中维持DNA水平的酶Dnmtl缺失的结果[11],主要发生在第2、3卵裂周期;当发育到前原肠胚这个阶段会出现一个关于重新甲基化的强烈的反应,这会使得甲基化的水平慢慢的恢复。在此过程之中,除了CpG岛的管家基因没有参与这个过程之外,其余的全部基因都参与到了这个反应的过程中。
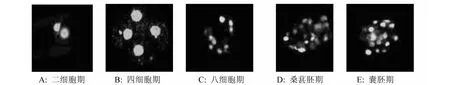
图2 附植前的猪PA胚胎的DNA甲基化模式Fig.2 The DNA methylation pattern in preimplantation pig PA embryos
目前,体外成熟[9]和体外培养[7, 15]等体外操作技术对于不同的配子或者是不同的胚胎都会有可能造成胚胎不同程度的甲基化的缺陷,其他的研究者对于检测的牛IVF早期胚胎和猪PA胚胎均是由卵母细胞体外成熟(IVM)、孤雌激活(PA)、体外受精(IVF)和受精卵体外培养(IVC)的方式获得。激光共聚焦显微镜的灵敏度不够高,不能发现单个基因和序列的甲基化变化情况,另外,亚硫酸盐处理就可以精确到一个基因或者序列。但是,这些结果并不必然和全基因组的甲基化情况相符合[6]。
4 结 论
IVM/PA/IVC对猪卵母细胞及早期胚胎的甲基化模式有一定影响以及猪卵母细胞体外培养过程中,猪卵母细胞核基因组的甲基化水平接近于正常体内的卵母细胞。
