青霉素类抗生素广谱性酶联免疫分析方法的建立
2019-04-10刘伟怡刘凤银江海超王宇刘佳邹红丽穆洪涛
刘伟怡,刘凤银,江海超,王宇,刘佳,邹红丽,穆洪涛*
(1.广东第二师范学院生物与食品工程学院广东广州 5103032; 2.广州市食品检验所广东广州 511400)
青霉素类抗生素药物属于窄谱杀菌性抗生素,可通过抑制革兰氏阳性菌胞壁的形成,使细菌胞壁破损、胞内渗透压下降,菌体涨裂而死亡,从而起到杀菌作用,具有高效、低毒的特点[1]。非治疗目的用药、执行休药期规定不严格、非法人为掺杂、饲养管理不当、抗生素滥用等都会导致青霉素类抗生素在畜产品中残留[2]。青霉素类抗生素残留不仅可能会导致产生耐药菌株[3],免疫抑制、体内蓄积、破坏人体微生态平衡、破坏环境,而且可能会引发过敏反应,其引起的过敏性休克,可严重影响人体健康安全[4]。
目前,国内外文献报道的青霉素类抗生素残留检测方法主要有微生物检测法(MIT)[5]、高效液相色谱法(HPLC)[6]、荧光免疫测定法[7]、青霉素生物传感器检测[8]、光谱法[9]等。微生物测定法前处理简单、成本低,但其易出现假阳性结果;免疫分析法简便快速、灵敏度高和特异性强,但程序复杂且易受到其他因素影响;理化分析法具有高灵敏度和高精确度,但对操作人员和仪器要求较高。
青霉素酶联免疫检测方法一般采用多克隆抗体的方法,其特异性不够强,筛选工作量大,即使运用了标记的方法,也会造成不易区分、工作繁重等问题。并且免疫法现存的问题(广谱性不够高),其试剂盒只能单独检测某一种抗生素残留,在实际应用是多种抗生素联用,需要用上多种试剂盒[10]。本研究通过制备获得广谱性识别青霉素类抗生素的抗体,建立针对牛奶中青霉素类抗生素残留的广谱性酶联免疫分析方法。通过此种方法可以一次性筛查全部青霉素类抗生素,从而为青霉素类抗生素的监控和管理提供有力的检测方法。
1 材料
1.1 实验动物
重2 kg左右的健康雌性新西兰大白兔,由广东省医学实验动物中心提供。
1.2 试剂与材料
青霉素类抗生素、牛血清白蛋白、卵清蛋白、N-羟基琥珀酰亚胺、弗氏完全佐剂、弗氏不完全佐剂、其他化学试剂均为分析纯;均购于广州市齐云生物技术有限公司。实验用水为超纯水。酶标板购于厦门怡佳美实验器材有限公司。
1.3 主要仪器
SP-Max2300A光吸收型全波长酶标仪(上海闪谱生物科技有限公司)、全自动洗板机(深圳雷社生命科学股份有限公司)、电子天平(上海越平科学仪器有限公司生产)、UV755B紫外可见分光光度计(上海佑科仪器仪表有限公司)。
2 方法
2.1 人工抗原的制备及鉴定
采用活泼酯法将青霉素G制备人工抗原PENBSA、PEN-OVA,并通过紫外光谱确证偶联是否成功。
2.2 PEN多克隆抗体的制备
将免疫原PEN-OVA对新西兰大白兔进行免疫,采用背部皮下多点注射,第六次免疫4~6天后心脏采血收集全部血清,分离血清后加上具有防腐作用的0.02%NaN3,用间接ELISA方法测定血清效价。
2.3 间接ELISA方法的建立
用已确定的抗原包被浓度稀释抗原,1 μg/mL包被酶标板,100 μL/孔,37 ℃孵育过夜,洗板两次,加入封闭液120 μL/孔,37 ℃孵育3小时,甩干,37 ℃烘干1h;每孔加阳性血清100 μL,37 ℃孵育40 min,洗板5次;加入HRP标记的羊抗鼠IgG,100 μL/孔,37 ℃孵育40 min,洗板5次;加入显色液100 μL/孔,37 ℃孵育10 min,最后加入50 μL 2 mol/L H2SO4终止反应,测定A450。
3 结果与讨论
3.1 偶联产物鉴定
紫外分光光度法是利用物质对光的吸收与其浓度呈比例关系的原理分别测定被偶联的两种分子浓度,结果见图1,两种分子PEN-BSA、PEN-OVA均有各自不同的紫外扫描光谱,并表现出光谱图迭加的性质,初步鉴定人工抗原偶联成功。
3.2 新西兰大白兔血清效价的测定
抗体效价是评价抗体性能的一个重要指标,通过间接ELISA法测定两只兔抗血清效价都高达10-5,说明抗体在很低的浓度范围内,仍能与抗原反应,二者之间有很强的结合力。此外,免疫分析中使用高效价的抗体可提高检测的灵敏度。
3.3 同源与异源ELISA方法的选择
首先活泼酯法分别将半抗原(氯唑西林钠(CLO)、苯唑西林钠(OXA)、羧苄西林钠(CAR)、磺苄西林钠(SUL)、青霉素V(PENV)、氨苄西林(AMP)、阿莫西林(AMO)、6-氨基青霉烷酸(6-APA)与OVA偶联成8种包被原,经紫外扫描鉴定包被原偶联成功。采用间接ELISA法,进行青霉素类抗生素异源包被选择,以提高灵敏度。由图2结果可知,以CAR-OVA为异源包被原检测最高效价为9000,PENV-OVA作为包被原时效价为4000;且CAROVA的抑制率高于其他异源包被原,因此,选择羧苄青霉素钠与OVA偶联而成的人工抗原(CAR-OVA)作为异源包被原。

图1 PEN-BSA、PEN-OVA偶联物组合图
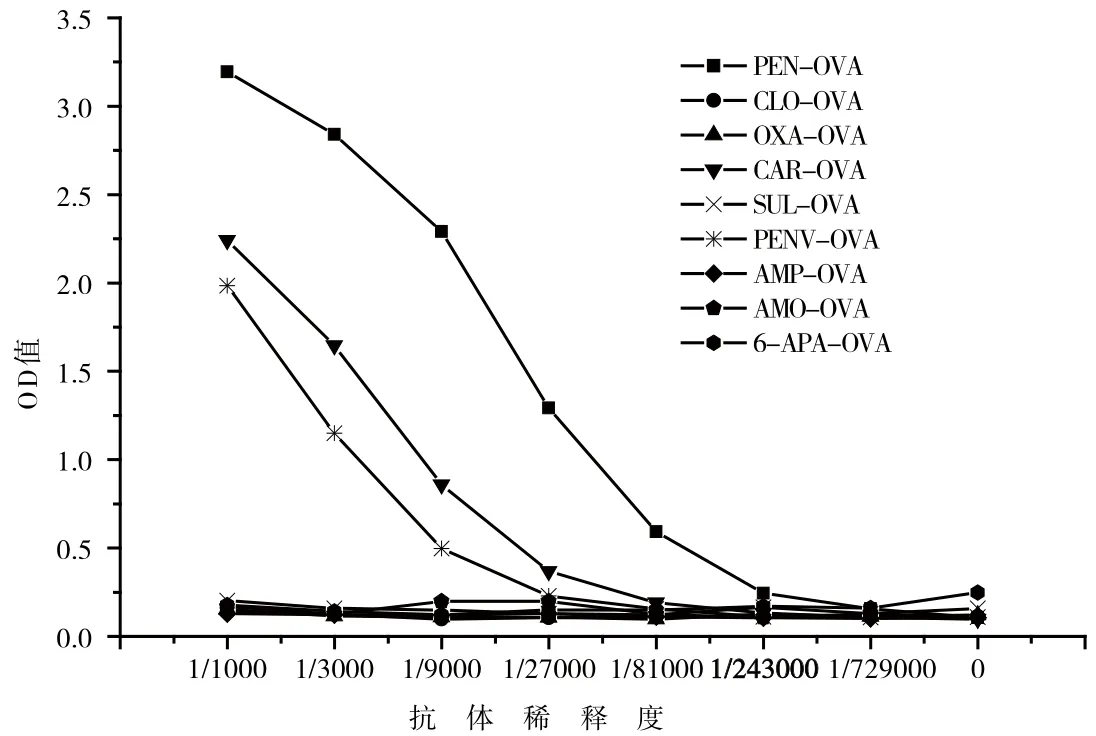
图2 同源与异源血清效价检测曲线
3.4 包被抗原和抗体最佳工作浓度试验结果
选取同源PEN-OVA,异源CAR-OVA作为包被原,采用间接ELISA方法、方阵滴定法确定抗原和抗体最佳的工作浓度。根据表1结果,当选择CAROVA作为包被原时方法的灵敏度最高,其IC50最小,因此选用异源包被原CAR-OVA的最佳工作浓度1 μg/mL,2号兔抗血清最佳稀释倍数为1∶8000。
3.5 ELISA方法的优化
采取控制单因素条件的方法,逐步优化各个条件,按照间接竞争ELISA法的程序,以CAR-OVA最佳工作浓度包被,对比不同条件下的Amax和IC50,综合考虑IC50/Amax值较小且曲线拟合度较好。由表2结果可知,实验选择37 ℃过夜包被、封板30 min、竞争反应和二抗反应40 min、显色反应10 min,其IC50、IC50/Amax值最小。
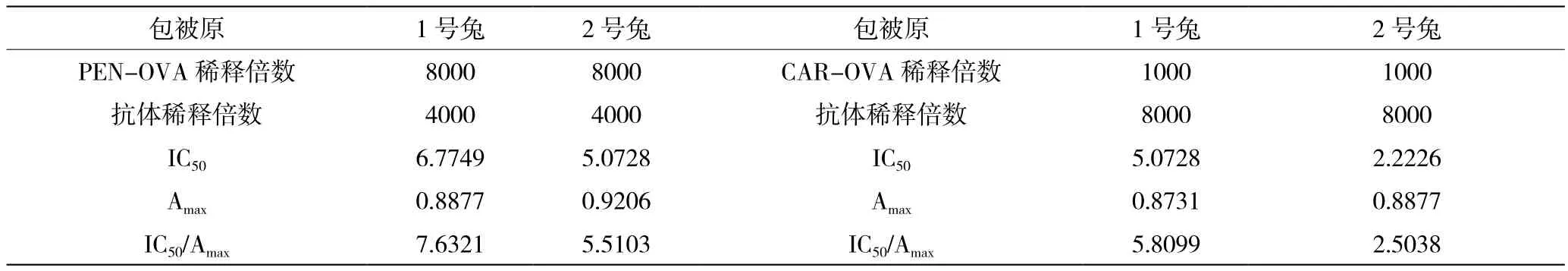
表1 在不同包被原和抗体最佳浓度下的IC50
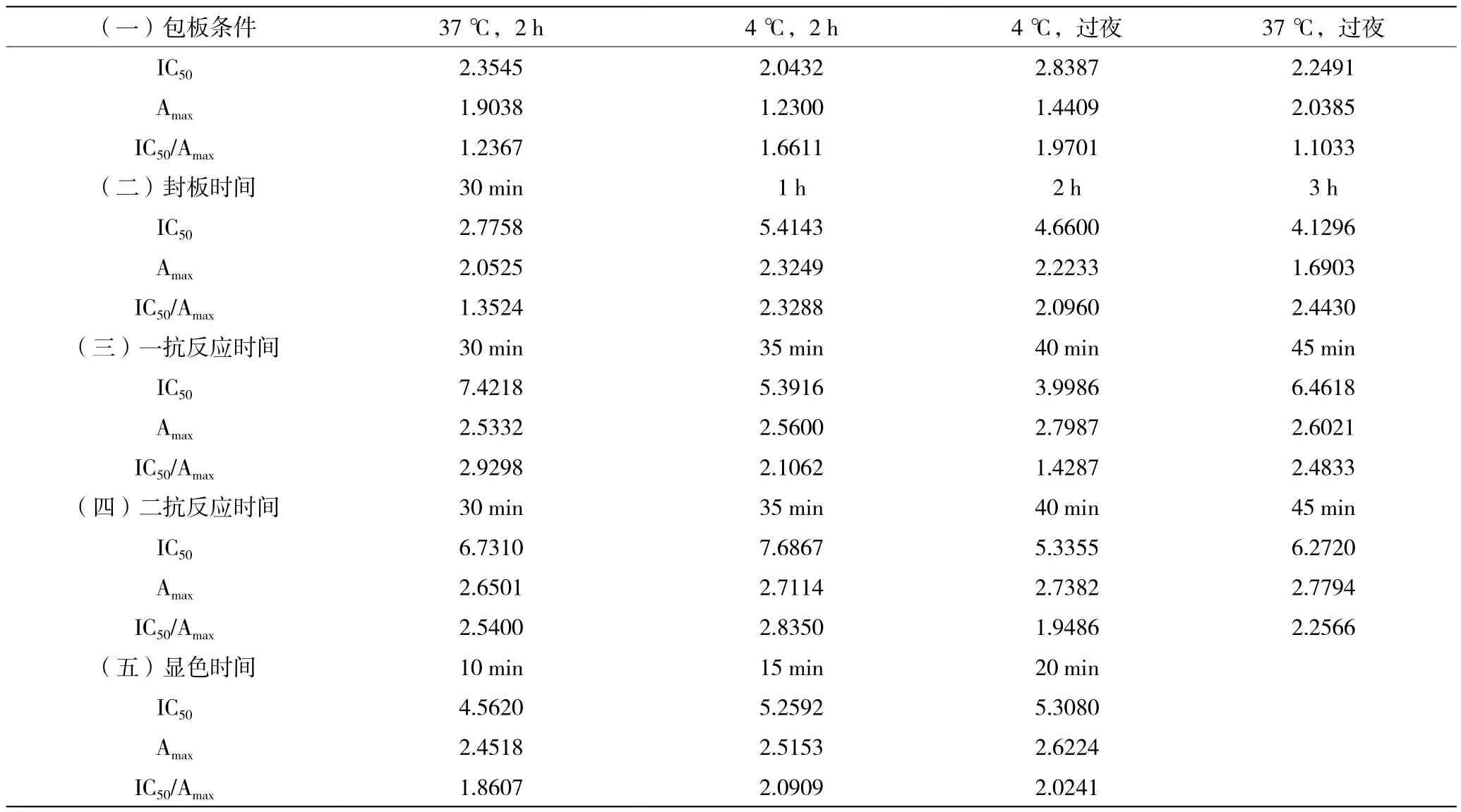
表2 ELISA方法的优化
3.6 特异性的测定
结构类似的青霉素类药物引起的交叉反应大小可以用来表示抗体的特异性,也可以描述分析方法的特异性。间接ELISA法测定交叉反应结果见表3。以PEN多克隆抗体与PEN特异反应率为100%,抗体与青霉素V特异反应率为0.1%,其他8种青霉素类药物与之交叉反应率很低,结果表明本研究制备的PEN多克隆抗体是高特异性的。
这主要是由于多克隆抗体识别青霉素G的侧链结构,青霉素G和青霉素V侧链结构相似,青霉素G的侧链基团为苯乙酰氨基,青霉素V的侧链基团为苯氧乙酰氨基,而其他青霉素类抗生素的结构与青霉素G存在较大的差异,抗体不能识别,因此交叉反应率低。

表3 PEN多克隆抗体与其他青霉素类药物的交叉反应
3.7 标准曲线的建立
所有优化条件确定后,将青霉素G标准品配成浓度为0 ,0.064,0.32,8,40,200,1000 μg/mL系列浓度,用ELISA法建立标准曲线见图3,计算曲线的线性回归方程为y=-0.2025x+0.7625,相关系数0.9691,其中线性范围介于0.064~200μg/mL,抑制率为50 %时,最低可检测浓度为2.22 μg/mL,检测限为0.14 μg/mL。

图3 青霉素G的间接ELISA标准曲线
3.8 准确性的测定(添加回收率)
在早餐奶、舒化奶、高钙奶和纯牛奶中添加PEN标准溶液(1、10、100 μg/mL),每份样品的提取液做3个平行重复。其回收率和变异系数测定结果如表4。四种牛奶中,样品回收率范围在74.0%~106.3%,变异系数小于0.21%,达到兽药残留分析要求。
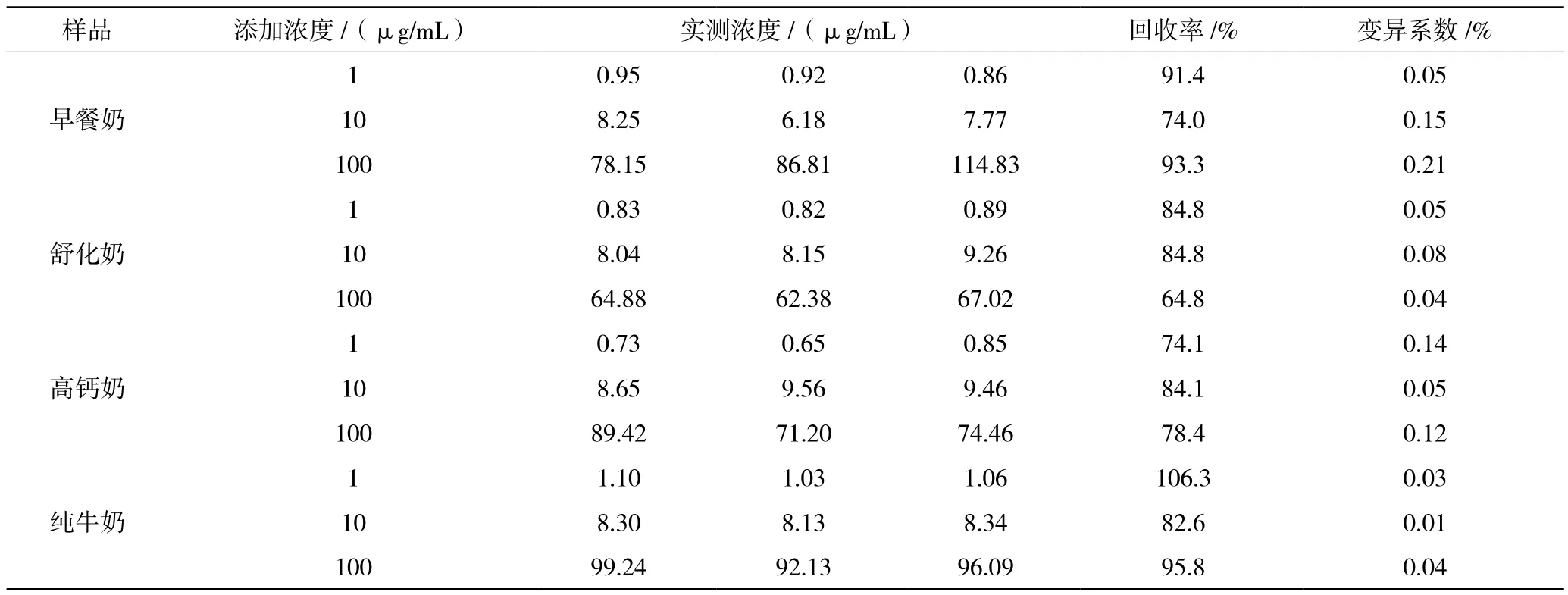
表4 PEN回收率的测定(n=3)
4 结论
本文利用青霉素G所获得的PEN多克隆抗体,效价高于1:105,与其他8种青霉素类药物交叉反应很低。通过优化一系列条件,CAR-OVA为最佳的异源包被原以提高灵敏度,建立了PEN标准曲线,最低可检测浓度为2.22 μg/mL,检测限为0.14 μg/mL。添加回收率的范围为74.0%~106.3%,变异系数小于0.21%。综上所述,获得的青霉素G多克隆抗体特异性强、亲和力高,为青霉素G多组分残留快速免疫分析奠定理论基础。
