基于海泡石制备的含镁纳米复合材料对Cr(Ⅲ)去除的研究
2019-04-10于生慧姜铭峰王倩琳赵天磊
于生慧, 姜铭峰, 王倩琳, 赵天磊, 杨 成
(1.陕西科技大学 环境科学与工程学院, 陕西 西安 710021; 2.中国科学技术大学 地球和空间科学学院 中科院壳幔物质与环境重点实验室, 安徽 合肥 230026)
0 引言
铬是环境污染中常见的有毒重金属[1],铬矿开采、冶炼、电镀、金属加工、制革、木材防腐、印染等工业都会有大量含铬废料排出[2].微量的Cr(Ⅲ)是人体所必需的,但过量摄入就会对人体产生危害,并有致癌作用[3-5].铬在水溶液中主要有两种存在形式:Cr(Ⅲ)和Cr(VI).三价铬盐是制革工业中的主要鞣剂,在铬鞣废水中,Cr(Ⅲ)的浓度能达到3 000~4 000 mg/L,同时在综合废水中,Cr(Ⅲ)的浓度也达到 10~70 mg/L[6].此外,Cr(Ⅲ)的毒性虽然比Cr(VI)小,但是其在自然界中可向Cr(VI)转化[7],并且容易被环境中的胶体所吸附,从而可以从水体转移到土壤中[8-10].因而,研究去除水体中的Cr(Ⅲ)有重要意义.
目前,去除废水中的Cr(Ⅲ)的方法主要包括吸附[11]、离子交换[12]、膜分离[13]、电化学处理[14]等.吸附法由于其操作简单、高效率、低能耗、无二次污染等优点被广泛利用[15-17].随着纳米技术的兴起与发展,各种纳米材料、纳米技术被广泛地应用于环境净化领域.在水体重金属处理方面,纳米材料具有大的比表面积和多的表面活性位点,被认为是处理重金属的良好试剂,尤其是在处理低浓度μg/L到mg/L级别的重金属离子有着独特的优势.
粘土作为一种具有比表面积大、存在广泛和价格低廉等优点的微米/纳米材料,被广泛地用来去除水体中的重金属[18-21].一般而言,粘土是通过离子的交换或者重金属自身与颗粒表面的硅氧基团和铝氧基团形成配合物的方式来去除水体中重金属的[22,23].同时,用作吸附重金属的粘土矿物存在的局限例如低的金属选择性、结合常数较小以及载荷能力低下等限制了其的发展[24].通过向粘土矿物中加入新的官能团来增强其对重金属的选择能力和结合能力的改性方法被研究,可是这种方式目前对粘土去除重金属能力的提高并不显著,如Mercier和Detellier在麦羟硅钠石和斜水矽钠石层间嫁接巯基后并没有显著提高该粘土对重金属的去除性能[24,25].Celis用巯基对蒙脱石和海泡石进行改性后,其对Hg2+具有较高的去除性能,却使其对Pb(Ⅱ)与Zn(Ⅱ)的去除性能降低[19,26].同时进行粘土的有机改性时一般都需要有机试剂的作用,并且过程相对繁杂.因此,对粘土矿物进行改性来提高其对重金属的去除性能是当务之急.
海泡石是一种天然粘土矿物,其具有比表面积大、多孔结构以及稳定性等特点,令海泡石在各个领域都有着广泛的应用[27-29].酸处理粘土可以增加其表面积,并获得更多的孔结构和活性位点,因此酸化是粘土改性的常用方法.通过酸化处理海泡石,能够使其中的Mg被不同程度地去除,如果酸的浓度足够,其中的Mg能够被完全转化为离子态,并产生非晶态的二氧化硅凝胶[30].
本研究首先用酸改性手段浸出海泡石中结构中的镁,再通过碱处理制备出含镁的纳米复合材料.利用扫描电镜(SEM)、透射电镜(TEM)、X射线衍射(XRD)等手段对其结构与表面特性进行表征,并系统地性研究了该材料对水中Cr(Ⅲ)的去除性能.
1 实验部分
1.1 试剂与仪器
所用的实验药品都为分析纯,使用前未经过进一步的提纯和处理.海泡石购于西格玛公司,盐酸、氨水、乙醇购于上海沃凯生物技术有限公司.
1.2 不同酸性条件对结构中镁的浸出能力
分别取50 mL浓度为0.12 mol/L (体积浓度1%)、0.6 mol/L (体积浓度5%)、1.2 mol/L (体积浓度10%)和2.4 mol/L (体积浓度20%)盐酸溶液于100 mL烧杯中,然后向各烧杯中加入0.5 g海泡石,在室温和60 ℃的条件下搅拌反应一定时间.将产物离心分离后取上清液通过电感耦合等离子体原子发射光谱(ICP-AES,optima 7300 DV)测定Mg2+浓度,将反应后的产物干燥后进行物相分析,分析不同酸化条件下对海泡石结构中镁的浸出能力.
1.3 材料制备
称取2.0 g海泡石加入到装有50 mL 0.6 mol/L盐酸溶液的烧杯中,在60 ℃的温度下搅拌12 h,然后向其中逐滴加入NH3·H2O直至pH为10左右,再搅拌2 h.将搅拌后的产物离心、超纯水和酒精洗涤几次,直至pH为7~8,然后将固体沉淀放入烘箱中烘干,研磨、备用.
1.4 表征
样品经喷金处理后,通过场发射扫描电镜(SEM)观察材料的尺寸和结构(JEOL JSM-6700F);通过透射电子显微镜(TEM)观察材料的结构,并进行能谱分析(JEM 2010);通过X射线衍射仪对产物进行物相分析(Philips);通过比表面积仪分析并计算出材料的比表面积和孔体积(Micromertics 2010).
1.5 吸附实验
1.5.1 pH对吸附的影响
称取50 mg SiO2-Mg(OH)2复合材料,加入50 mL含Cr(Ⅲ)浓度为10 mmol /L 的溶液,使用0.1 mol/L的HCl和0.1 mol/L NaOH溶液将反应体系pH依次调节为2.5、3.0、3.5、4.0,在25 ℃条件下搅拌10 h,反应完成后离心分离,取上清液通过ICP-AES测量Cr浓度并计算去除量.所有的吸附实验都重复三次,取平均值.Cr(Ⅲ)在平衡时的去除量qe(mg/g),吸附百分比U%,可以通过以下公式计算获得:
(1)
(2)
式(1)~(2)中:Co、Ct和Ce分别为Cr(Ⅲ)在溶液中初始时间、任意时间和平衡时间时的浓度,mg/L;V是溶液的体积,mL;W是吸附剂的添加量,mg.
1.5.2 接触时间对吸附的影响
将50 mg SiO2-Mg(OH)2复合材料分别加入50 mL含Cr(Ⅲ)浓度为2 mmol/L和10 mmol/L 的溶液中,在25 ℃条件下搅拌,将pH调节为4,在时间为10 min、30 min、60 min、90 min、120 min、240 min时分别取7~8 mL溶液过滤,取过滤液于离心管中通过ICP-AES测量Cr浓度并计算去除量.
1.5.3 吸附等温线
称取50 mg SiO2-Mg(OH)2复合材料,分别加入到50 mL含Cr(Ⅲ)浓度为2 mmol/L、4 mmol/L、6 mmol/L、8 mmol/L、10 mmol/L的溶液中,在25 ℃条件下搅拌12 h,将pH调节为4,反应完成后离心分离,取上清液通过ICP-AES测量Cr(Ⅲ)浓度并计算去除量.
1.6 吸附动力学模拟和吸附热力学模拟
本研究中采用准一级模型(3)和准二级模型(4)分别分析吸附动力学行为,吸附热力学行为使用Freundlich模型(5)和Langmuir模型(6)分析,其线性方程如下:
ln(qe-qt)=lnqe-k1t
(3)
(4)
lnqe=lnKF+(1/n)lnCe
(5)
(6)

2 结果与讨论
2.1 不同酸性条件对海泡石结构中镁的浸出能力及其物相分析
图1是海泡石在室温和60 ℃下不同浓度盐酸对海泡石处理12 h后,海泡石结构中镁的浸出率.由图1可以直观的看到海泡石在不同酸性条件和温度下镁离子的变化差异.经过测定,本实验所采用的海泡石中镁离子所占的比例约为15%,即150 mg/g.在相同温度的条件下,镁浸出率随着酸的浓度的升高而增大;在酸度相同的条件下,镁浸出率随着温度的升高而增大.当处理温度为60 ℃,盐酸的体积浓度为1%时(即浓盐酸稀释100倍获得,盐酸浓度约为0.12 mol/L),海泡石结构中镁离子浸出率约为62.5%;而在室温 (25 ℃) 条件下,海泡石经1%体积浓度盐酸处理12 h后,镁离子浸出率仅为18.3%.当盐酸浓度提高为5% (即盐酸浓度约为0.60 mol/L),海泡石结构中镁的浸出率在处理温度为60 ℃即可达到99.84%,海泡石结构中镁近乎是完全浸出;而在室温条件下,盐酸的体积浓度升高到20%(盐酸浓度约为2.40 mol/L)时,海泡石氧镁八面体结构中镁才近乎完全浸出.

图1 不同酸性条件下海泡石中镁的浸出率
图2中a曲线为海泡石原样XRD图.海泡石原样表现出海泡石粘土的典型结构(JCPDF:13-0595), (110)面间距为 12.0 Å,与海泡石特殊的层间距相一致[29].
图2中b曲线和c曲线为海泡石在5%盐酸,温度分别为室温和60 ℃的条件下酸化处理后的XRD图.图2中b曲线显示,经5%体积浓度盐酸在室温处理12 h后,海泡石的特征峰明显弱化,说明海泡石结构发生一定变化.海泡石在经5%体积浓度盐酸在60 ℃处理相同时间后,样品中海泡石的特征峰完全消失,图谱主要表现出一种非晶的驼峰 (图2中c曲线),证明海泡石晶体结构被破坏,所得产物为非晶 SiO2,其中少量尖锐衍射峰可归为海泡石本身存在的石英,说明海泡石结构中的氧镁八面体被破坏,镁离子被浸出,所得结果与图2中a曲线的结果相一致.

图2 海泡石经不同条件酸处理后样品的XRD图
图2中d曲线和e曲线分别为海泡石在酸性条件为20%体积浓度盐酸在室温和10%体积浓度盐酸在60 ℃下酸化后样品的XRD图.从此图中可以看到样品的XRD峰谱图与海泡石经5%体积浓度盐酸在在60 ℃处理12 h后的样品谱图(即图2中c曲线)近乎相同,说明海泡石结构中的镁离子完全酸浸出来.因而,在复合材料的制备过程中,为确保海泡石结构中镁的完全浸出,并兼顾实验效率,海泡石的酸处理过程为:10 %的体积浓度的盐酸(盐酸浓度约为1.20 mol/L)在60 ℃下搅拌处理12 h.
2.2 复合材料的表征
海泡石原样和对海泡石原样进行改性后的复合材料的形貌通过扫描电镜和透射电镜观察.从图3(a)、(b)可以看出,海泡石原样的结构为纳米棒状,长1~2μm,宽约50 nm.通过能谱分析可知其中含有Mg、Si、O三种元素.
图3(c)是海泡石原样通过10%的盐酸与氨水处理后得到的材料的扫描图,可知相比于海泡石原样,复合材料依然为棒状结构,但分散性降低,团聚现象出现,且表面变得粗糙,孔隙增多,表明海泡石原样的晶体结构被酸破坏,SiO2作为更加稳定的结构出现,浸出的镁离子和氨水反应在其表面形成了新的物质.通过能谱分析发现复合材料中依然有镁的存在,且酸浸后的材料的XRD图中没有出现含镁化合物的峰,说明镁离子和碱反应被负载在原材料表面,形成了一种新的纳米含镁复合材料.

(a)海泡石原样的SEM图
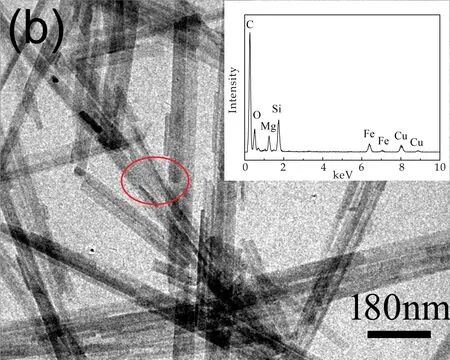
(b)海泡石原样的TEM图及能谱图

(c)酸-碱处理海泡石所得样品的SEM图
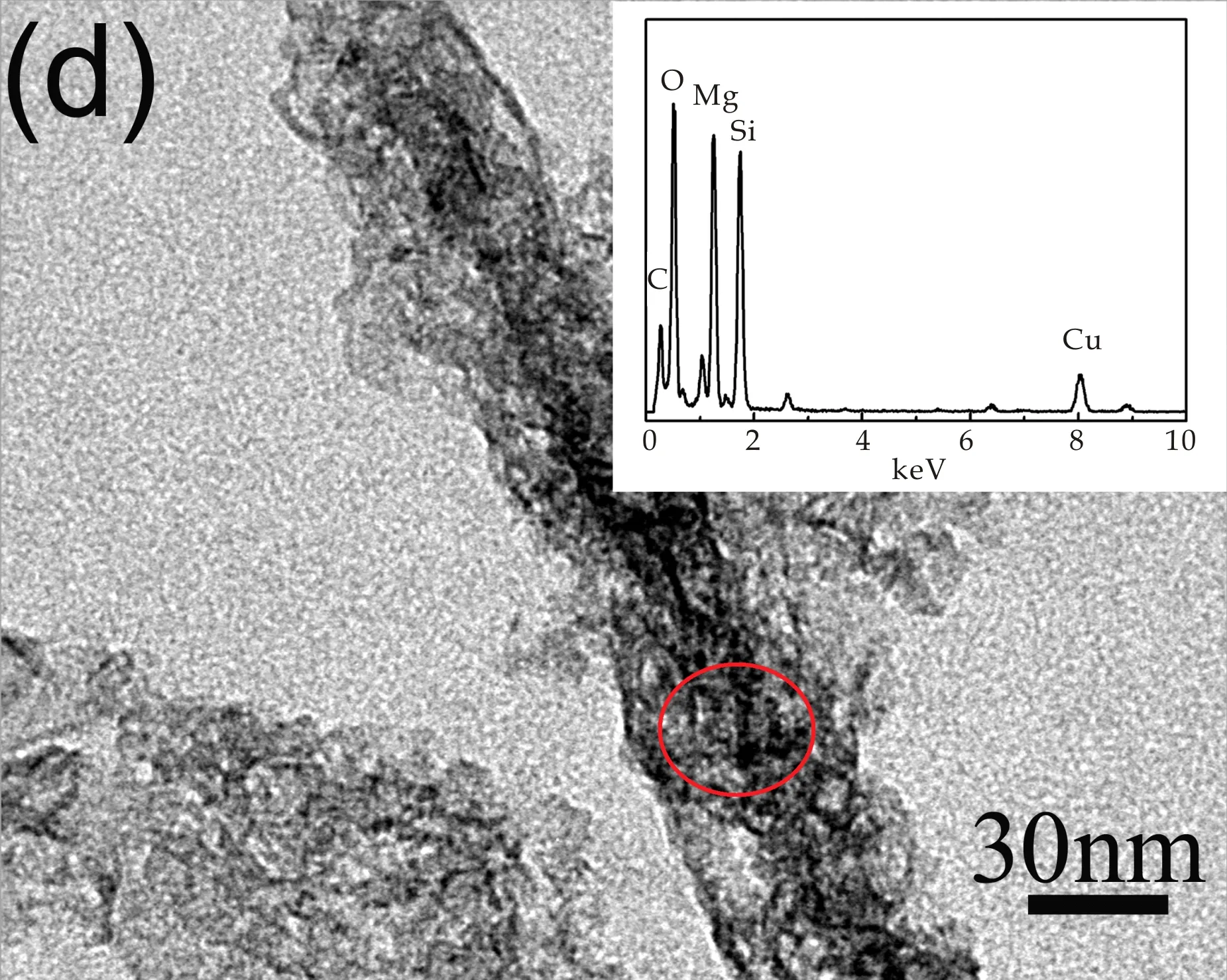
(d)酸-碱处理海泡石所得样品的TEM图及能谱图图3 海泡石原样和酸-碱处理海泡石 所得样品SEM和TEM分析图
海泡石原样、完全酸化的海泡石和所得的复合材料的氮气吸附等温线如图4所示.由图4可以看出,这三个材料都表现为IV类吸附型,说明样品中存在介孔.其BET比表面积分别为263.4 m2/g、459.7 m2/g 和364.3 m2/g,孔容积分别为0.44 cm3/g、0.79 cm3/g、0.96 cm3/g.

(a)海泡石的氮气吸附等温线及孔径分布
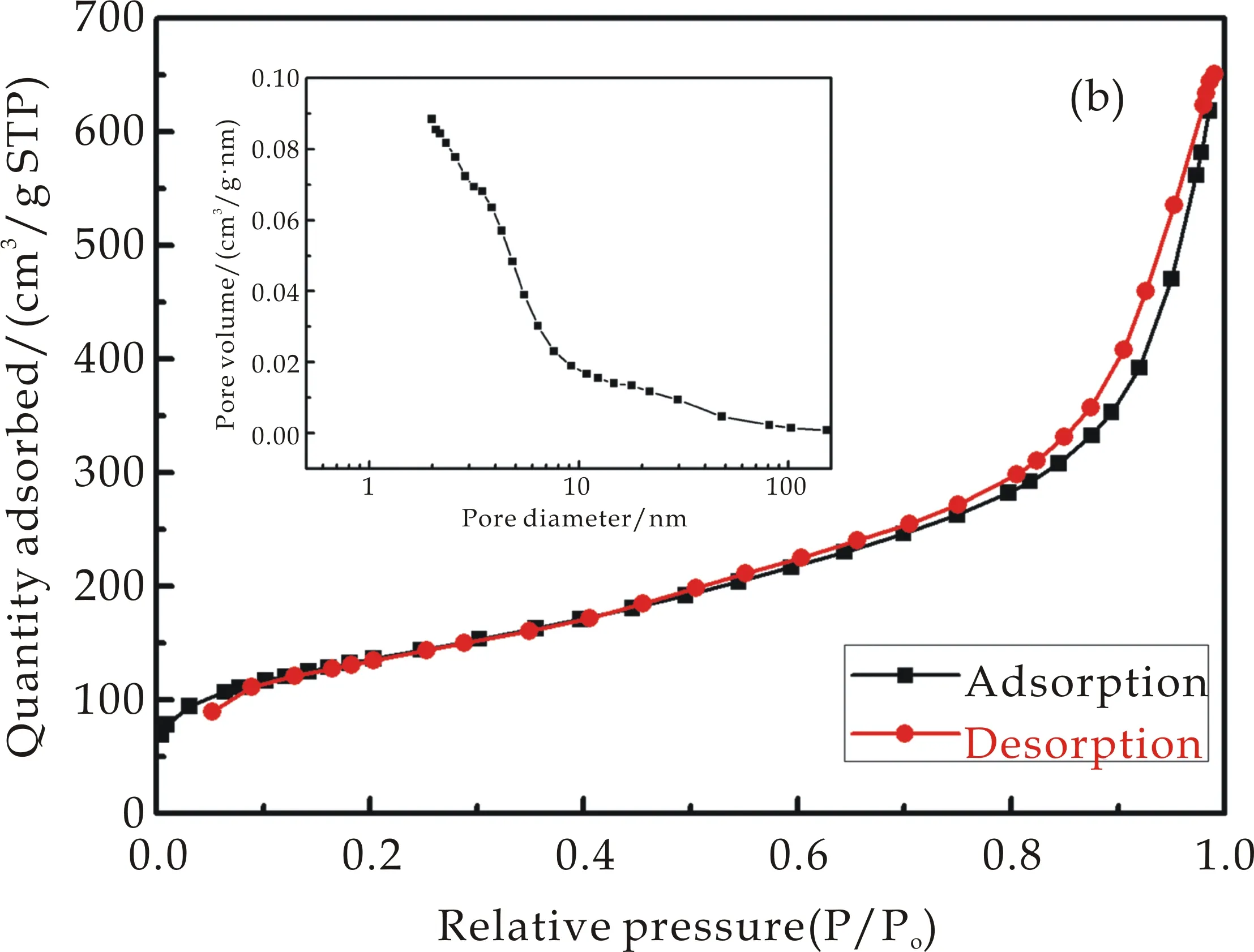
(b)完全酸化的海泡石的氮气吸附等温线及孔径分布

(c)含镁纳米复合材料的氮气吸附等温线及孔径分布图4 海泡石、完全酸化的海泡石和含镁纳米 复合材料的氮气吸附等温线及孔径分布
2.3 含镁复合材料对Cr(Ⅲ)的去除
通过Cr(OH)3的Ksp值(6.3×10-31)计算得知该浓度溶液pH为4.6时,溶液会有Cr(OH)3沉淀产生,所以溶液pH需小于4.6,本实验采用的pH范围为2.5~4.称取50 mg复合材料,加入50 mL含Cr(Ⅲ)浓度为10 mmol /L (ca.514.2 mg/L) 的溶液,将反应体系pH依次调节为2.5、3.0、3.5、4.0,在室温 (25 ℃) 条件下搅拌600 min,反应完成后离心分离,取上清液通过ICP-AES测量Cr(Ⅲ)浓度,并计算去除量.
图5是pH对复合材料吸附Cr(Ⅲ)的影响图.由图5可知,可以看到随着溶液pH的升高,Cr(Ⅲ)的去除率也在不断升高,pH为4时去除率最高,为79.95%.这是由于随着pH升高,吸附剂表面的负电荷逐渐增加,使Cr(Ⅲ)与吸附剂之间的静电吸引力增大,促进了吸附.以上结果说明,溶液的pH值对复合材料的吸附效果有很大的影响,pH为4时,复合材料对Cr(Ⅲ)的去除效果最好.

图5 pH对复合材料去除Cr(Ⅲ)的影响
为了进一步研究接触时间对Cr(Ⅲ)的去除影响,将50 mg复合材料分别加入50 mL含Cr(Ⅲ)浓度为2 mmol/L (ca.112.2 mg/L)和10 mmol/L(ca.514.2 mg/L)的溶液中,将pH调节为4,在室温条件下搅拌,在时间为10 min、30 min、60 min、90 min、120 min、240 min、360 min、600 min时分别取样分析.
图6是接触时间对复合材料吸附Cr(Ⅲ)的影响图.由图6可以看出,在2 mmol/L浓度下,吸附剂对Cr(Ⅲ)有很快的吸附速率,10 min吸附率即可达到99%,接触时间在240 min后,溶液浓度低于0.02 mg/L,吸附率接近100%.实验结果显示,在2 mmol/L浓度下,经基于海泡石制备的含镁纳米复合材料处理后,Cr的残留浓度远低于美国环保局(EPA)饮用水标准(EPA饮用水对Cr的限值为0.1 mg/L),说明实验所制备的纳米复合材料对低浓度Cr有着优异的去除效果;在10 mmol/L浓度下,接触时间为60 min时即可达到45%的吸附率,并在600 min时达到79.95%.
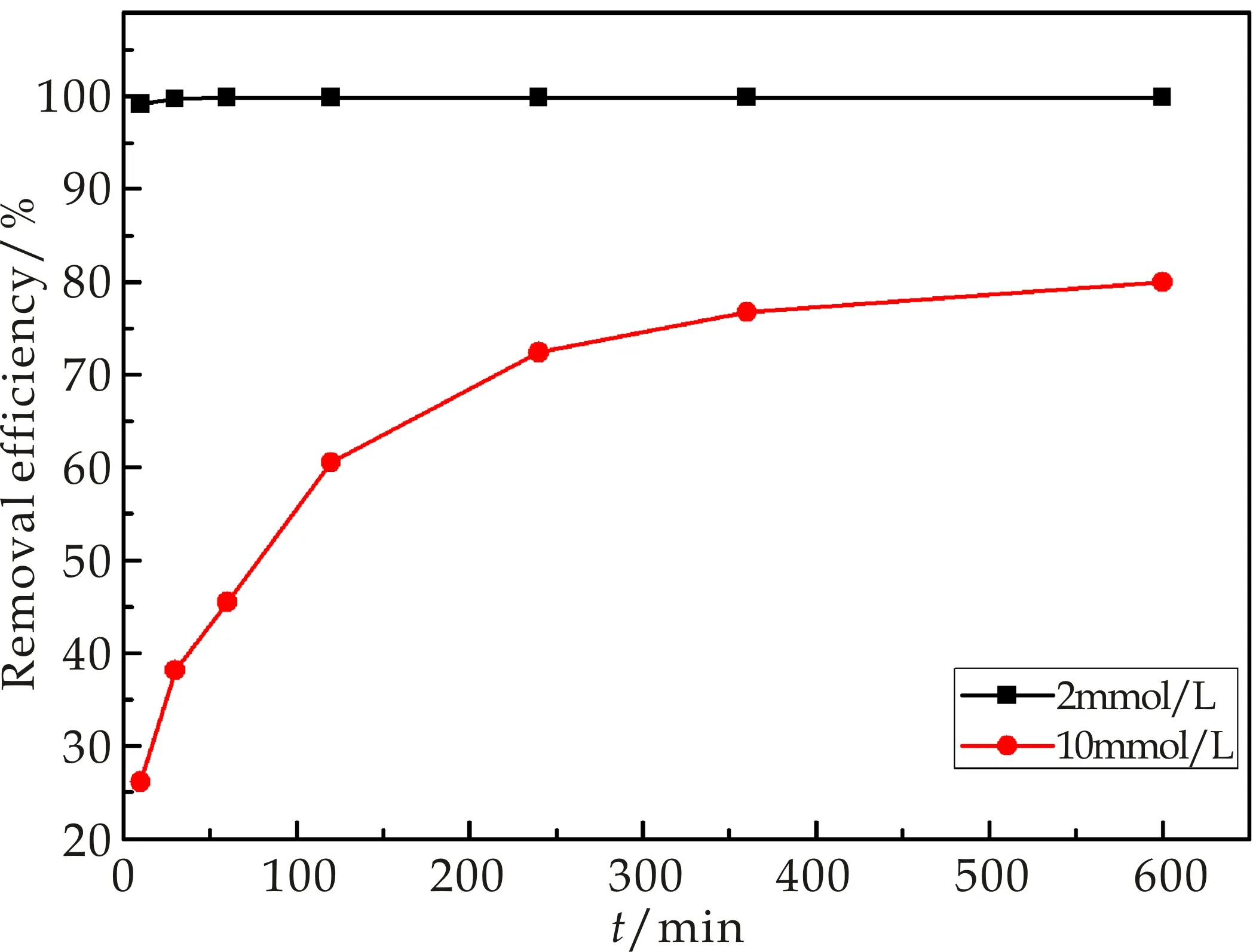
图6 接触时间对复合材料吸附 Cr(Ⅲ)的影响
图7是初始浓度对复合材料和海泡石去除Cr(Ⅲ)的影响图,Cr(Ⅲ)的初始浓度分别为2 mmol/L(ca.112.2 mg/L)、4 mmol /L (ca.211.6 mg/L)、6 mmol /L (ca.309.8 mg/L)、8 mmol/L(ca.419.9 mg/L)、10 mmol/L (ca.514.2 mg/L)的溶液中,固液比为50 mg/50 mL,体系pH为4.0.由图7可知,当浓度为10 mmol/L时,去复合材料的去除容量达到最大,最大去除容量为411.1 mg/g.同时在浓度低于2 mmol/L时,去除后Cr(Ⅲ)的残留浓度低于0.02 mg/L,远低于美国环保局 (EPA) 饮用水标准.而海泡石的最大去除容量仅有2.8 mg/g.结果表明,通过对海泡石进行酸碱化处理,极大地提高了对Cr(Ⅲ)的处理能力,对海泡石改性后Cr(Ⅲ)的处理能力提高了约140倍.

图7 初始浓度对复合材料和 海泡石去除Cr(Ⅲ)的影响
基于海泡石制备的含镁纳米复合材料对三价铬去除能力的提升主要可归结于海泡石结构中镁的形态的转变,在复合材料中镁以Mg(OH)2或/和吸附态镁的形式存在,一方面镁离子可更容易与三价铬进行离子交换;另一方面,Mg(OH)2在水中显弱碱性,可提高体系的pH,更有利于复合材料对阳离子的吸附.同时,海泡石改性后所形成的复合材料具有较大的比表面积,也在一定程度上提升了对重金属阳离子的去除能力[31].
2.4 吸附动力学
为了更好地分析Cr(Ⅲ)在复合材料上的吸附动力学过程,分别用准一级动力学、准二级动力学方程对其吸附动力学数据进行拟合,见图8和图9.根据图8和图9中的拟合效果和相关系数R2(表1),可判断出准一级模型更能准确模拟基于海泡石制备的含镁复合材料对三价铬的吸附行为.

表1 复合材料对Cr(Ⅲ)吸附的 准一级、准二级拟合参数
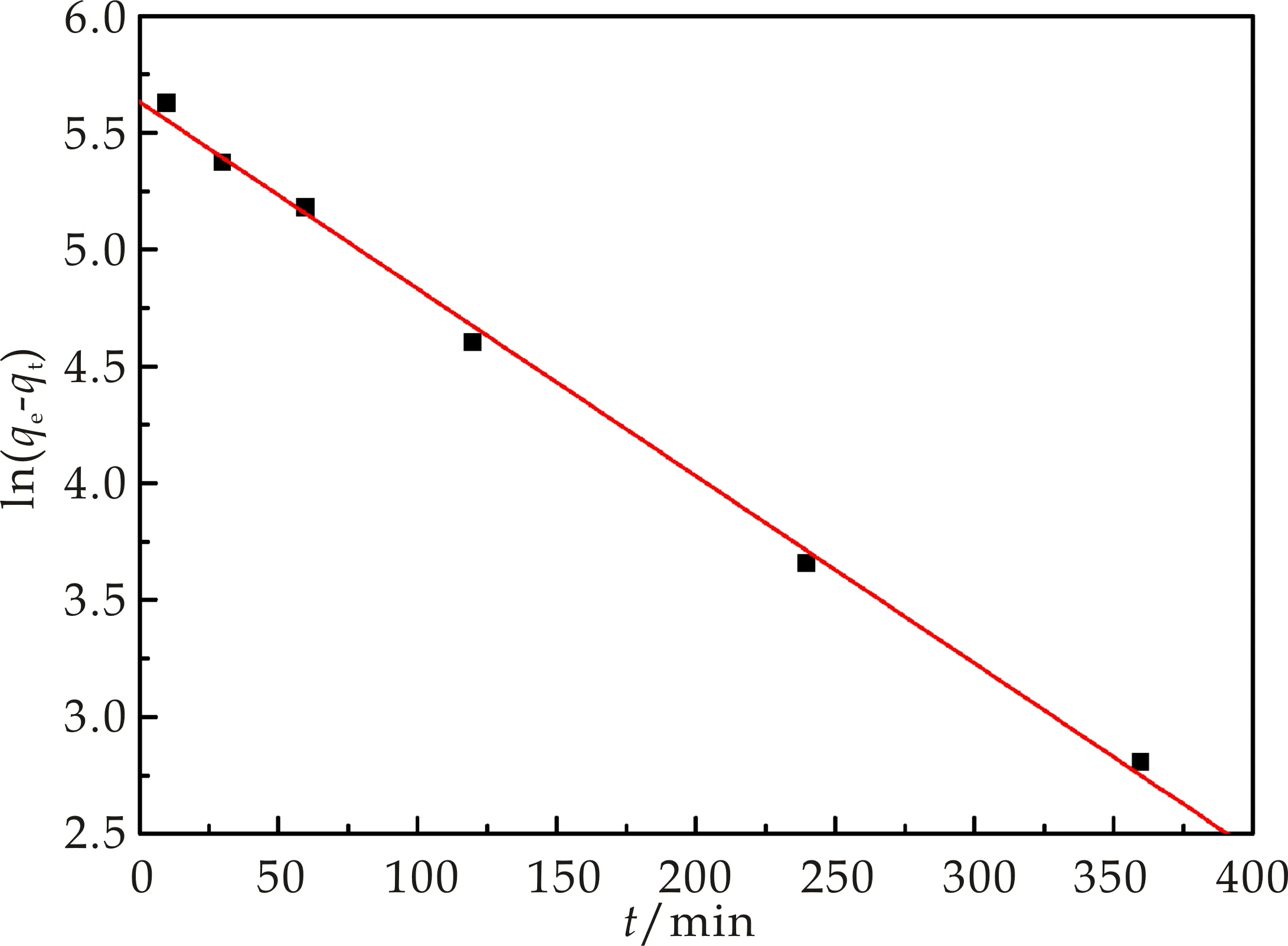
图8 复合材料对Cr(Ⅲ)吸附的准一级 模拟线性拟合图
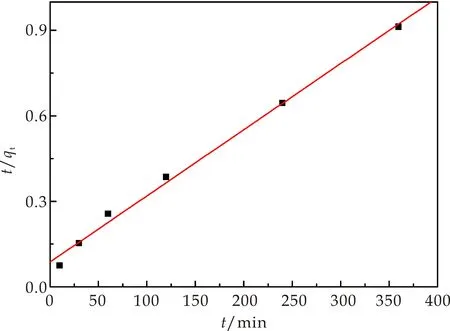
图9 复合材料对Cr(Ⅲ)吸附的准二级 模拟线性拟合图
2.5 吸附热力学
将相关数据代入Freundlich吸附等温方程和Langmuir吸附等温方程进行拟合,见图10和图11.根据图中的拟合效果和相关系数R2(表2),可判断出Freundlich模型更能准确模拟基于海泡石制备的含镁复合材料对三价铬的吸附行为.
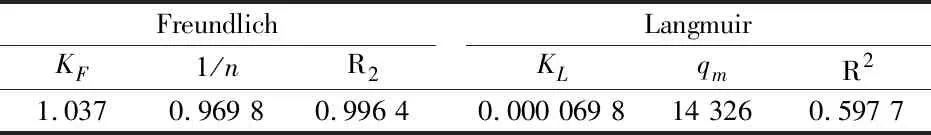
表2 Freundlich和Langmuir拟合参数
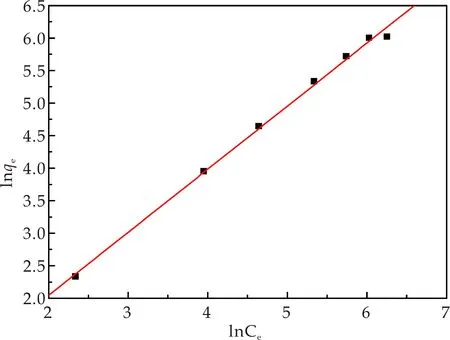
图10 Freundlich拟合曲线

图11 Langmuir拟合曲线
3 结论
本实验研究了不同酸性条件对海泡石结构中的镁的浸出能力,并以海泡石为基础材料通过酸碱连续处理,制备出具有大比表面积的含镁纳米复合材料.结果表明:
(1)海泡石在60 ℃下,经10%体积浓度的盐酸处理12 h后,海泡石氧镁八面体结构中的镁被完全浸出,形成非晶SiO2,通过连续的碱化处理后,浸出的镁离子以吸附态或/和非晶Mg(OH)2中的形式与非晶二氧化硅结合,从而制备出含镁纳米复合材料.
(2)对Cr(Ⅲ)的去除实验表明,基于海泡石为原料制备的含镁纳米复合材料对Cr(Ⅲ)的去除性能极大提升,最大吸附量为411.1 mg/g,与海泡石相比,去除容量提升了约147倍,同时,对低浓度Cr(Ⅲ)处理后,Cr的残留浓度远低于美国环保局饮用水标准.
(3)纳米复合材料对Cr(Ⅲ)的去除吸附动力学符合拟一级动力学,热力学符合Freundlich吸附模型.
(4)基于海泡石制备的纳米复合材料对阳离子重金属Cr(Ⅲ)表现出极佳的去除性能,并且改性手段的简捷、原材料来源丰富,所制备的含镁纳米复合材料在重金属处理领域将有着较大的应用前景.
