白念珠菌唑类药物耐药机制研究进展
2019-04-10纪凌云周爱萍谭光坤吴文娟
纪凌云, 周爱萍, 马 俊, 金 宁, 谭光坤, 吴文娟
作者单位:同济大学附属东方医院医学检验科,上海 200123。
近年来,随着广谱抗菌药物、糖皮质激素、免疫抑制剂的广泛应用,以及各种介入诊疗、器官移植的大量开展,念珠菌病的发病率逐渐升高。据相关统计,发生侵袭性念珠菌感染的患者达25万例/年,死亡病例超过5万例,年发病率在(2~14)/100 000[1-2]。白念珠菌是一种定植在正常人群口腔黏膜、上呼吸道、肠道及阴道等部位的酵母样真菌,为条件致病性真菌。近十年来,越来越多的其他念珠菌种被发现或成为重要的病原菌,使得菌种分布发生了变化,但白念珠菌占比达50%,仍占主要地位[3]。唑类药物是目前治疗白念珠菌感染的首选药物,随着长期广泛大量使用,对其耐药导致治疗失败的病例逐渐增多。本文就白念珠菌耐药相关机制的研究进展进行综述,并探讨非整倍体事件、适应性、生物膜形成与耐药形成的联系,为抗真菌药物的研制提供新的作用靶位。
1 麦角固醇合成相关基因
麦角固醇是维持白念珠菌细胞膜完整性和流动性的重要组成部分,CYP51是其生物合成的靶酶,可催化羊毛甾醇去甲基化形成麦角固醇,且该反应离不开氧和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH,还原型辅酶Ⅱ)。唑类药物抗真菌的作用靶点即去甲基化酶CYP51,其通过易化扩散进入真菌细胞,并通过唑环中的无阻氮原子与位于CYP51蛋白活性位点血红素的铁原子结合,从而抑制麦角甾醇的生物合成而发挥抗真菌作用[4]。细胞色素P450是一个包含2 500多个成员的超家族,按功能可大致将其分为两类,第一类主要参与有害物质的代谢,而第二类通常参与关键的生物合成过程,如甾醇类[5]。CYP51是细胞色素P450家族中最古老的,它是该家族中唯一一个在动物、植物、细菌以及病毒中均存在的蛋白,尽管在不同生物中,CYP51蛋白序列一致性为22%~33%,发挥效用的晶体结构却有许多相似之处,而白念珠菌和其他真菌在结构上最显著的特征是在氨基酸428和459之间有一个附加的外环[4]。编码CYP51的基因主要是ERG1~27,其中与耐药相关的基因主要是ERG11,此外ERG3、ERG4、ERG5、ERG6与耐药的相关性也有所报道[6-9]。
1.1 ERG11基因突变与过表达
ERG11基因突变可使唑类药物抗真菌的作用靶点去甲基化酶CYP51的血红素表面结合位点发生变化,从而使唑类药物无法与真菌有效结合而致耐药。据报道超过140个错义突变存在于ERG11基因,表明其编码产物去甲基化酶CYP51在结构上具有高度的可变性[10]。此外,只有部分错义突变被明确证实与耐药有关,且大部分已发现的耐药株均含有多个错义突变。早在1999年,这些错义突变已被证实并非随机分布在整个编码区,多数集中在不同的“热点”区,表现在蛋白质水平为:氨基酸突变位点区域105-165、266-287、405-488[6]。与唑类耐药相关的ERG11突变位点见表1[4,6-7,10-11]。此外,ERG11基因突变位点具有地域相关性,特定区域具有相同的突变位点,未发生突变的分离株对于唑类药物具有较低的最低抑菌浓度(MIC)值,总之,ERG11基因点突变在白念珠菌唑类耐药中发挥重要作用[12]。值得注意的是,一些位点的ERG11基因突变在唑类敏感株和耐药株中均可发生,故这些突变不影响其对唑类耐 药。
ERG11基因过表达会导致去甲基化酶CYP51增多,白念珠菌胞内的唑类药物不能够阻止过多的去甲基化酶CYP51与羊毛甾醇结合,无法影响麦角固醇的合成,从而导致白念珠菌耐药[6,11]。ERG11基因过表达在白念珠菌临床分离株中普遍存在,白念株菌唑类药物耐药机制中,ERG11基因过表达作用是最小的,或者与其他抗性突变机制联合,使得菌株产生耐药,因此难以评估这种过表达对耐药表型的直接影响,且这种过表达往往涉及锌簇转录因子Upc2p,该转录因子在麦角固醇耗竭基础上诱导产生[6]。文献报道,UPC2基因的功能获得性(gain-of-function,GOF)突变能够改变其转录活性,导致ERG11基因的过表达,该研究结果显示,在没有药物影响下,野生型与UPC2基因敲除株表现出相同的生长情况,在2 μg/ mL氟康唑作用下,UPC2基因敲除株生长与野生型相比受到严重损害[13]。UPC2基因的GOF突变可导致白念珠菌对唑类药物耐药,据报道转录因子UPC2中的A643V、G648D、G648S和Y642F位点的氨基酸置换与ERG11基因的过表达有关,而且UPC2基因的GOF突变在临床分离的耐药株中普遍存在[14]。此外,也有报道称,ERG11基因过表达仅发生在少数近平滑念珠菌临床耐药株中,且过表达不依赖UPC2基因突变。在光滑念珠菌的唑类耐药机制中,ERG11过表达并不起重要作用,该机制在克柔念珠菌的唑类耐药中的作用也尚不清楚[6]。因此,随着研究的深入,UPC2基因更多新的GOF突变位点有待发现,对ERG11基因过表达的调控机制也会有更多全新认识。
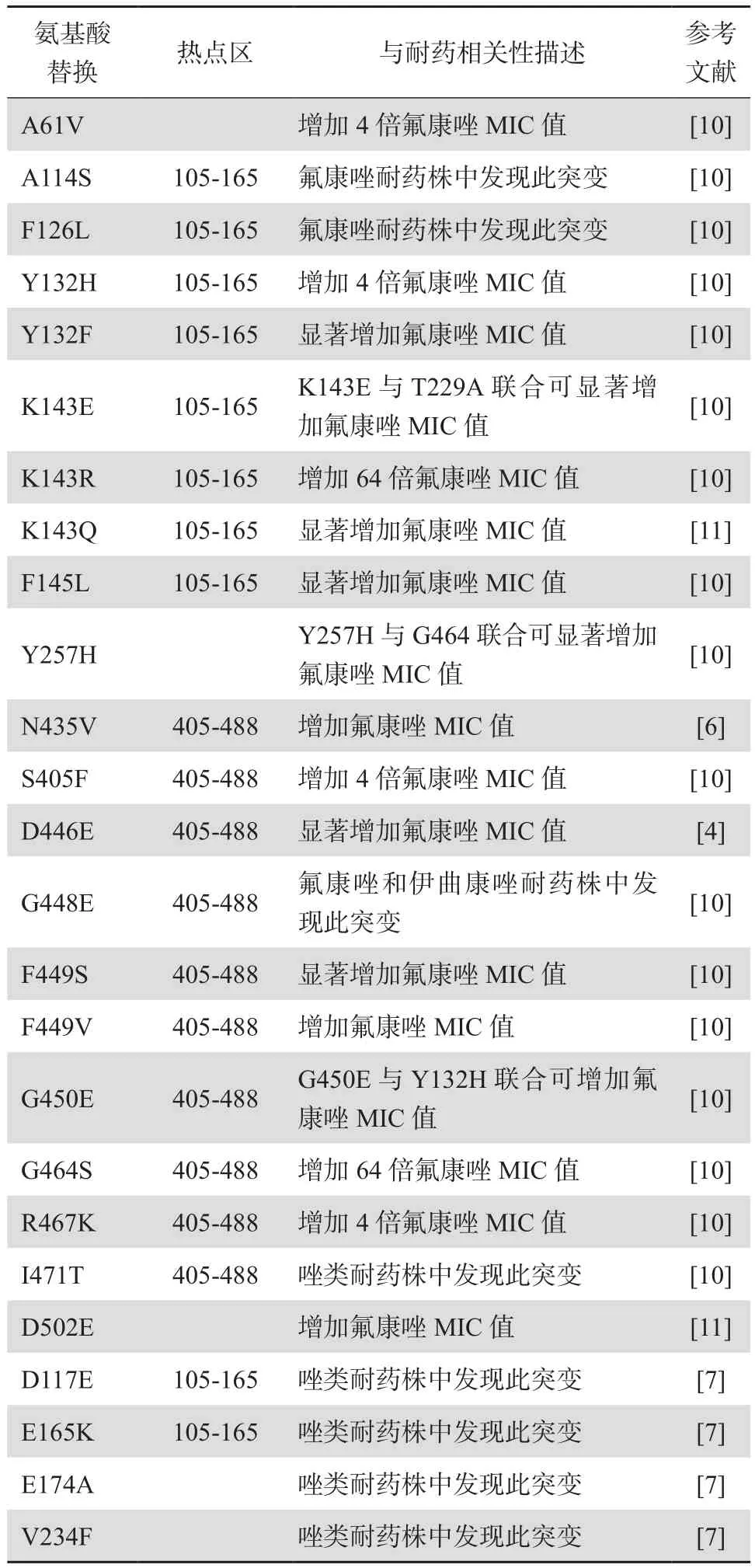
表1 白念珠菌唑类耐药相关的ERG11突变位点
1.2 其他ERG耐药相关基因
ERG3基因位于ERG11基因上游,与甾醇生物合成的旁路途径有关,引起氟康唑耐药现象发生。该基因的功能缺失突变导致菌体不能生成有活性的甾醇△5,6-去饱和酶,菌体内毒性麦角甾醇类物质聚集,并且能够维持菌株的正常生长,从而减弱唑类药物对细胞壁的作用,该耐药机制较罕见,已在实验室诱导发生,并在临床株中观察到此现象[6]。ERG4基因编码甾醇C-24(28)还原酶,在酿酒酵母中过表达可升高麦角甾醇含量。据报道,ERG4及ERG11基因突变及过表达发生在唑类耐药株中,且ERG4在唑类耐药株中存在2个沉默突变(C711T和C435T),但不能确定此突变与耐药相关[7]。此外,也有报道表明ERG5与唑类的耐药性相关[9],艾里莫芬倍半萜(eudesmane sesquiterpenes)能够作用于ERG6及ERG11从而发挥抗真菌作用[8]。
2 外排泵相关耐药基因
白念珠菌细胞膜上的外排泵活力增强是白念珠菌对唑类药物耐药的主要机制之一,主要有2类外排泵蛋白:拥有ATP结合盒结构(ATP-binding cassette,ABC)的转运蛋白超家族和主要易化载体超家族(major facilitator superfamily,MFS)。
ABC转运蛋白超家族依赖ATP水解的能量,具有广泛的底物特异性,在预测的28种ABC转运蛋白中,只有Cdr1p和Cdr2p与唑类药物的耐药相关,CDR1和CDR2基因的过表达使外排泵泵出药物能力增强,从而导致白念珠菌对唑类药物耐药,此外,许多氟康唑耐药株过表达CDR1和CDR2,其中1个或2个基因的缺失会导致分离株耐药性下降[15-16]。CDR1和CDR2基因的过表达与基因转录水平调控有关,由TAC1基因编码的CDR基因转录激活因子l(transcriptional activator ofCDRgene l,Tac1)介导CDR1和CDR2基因过表达,从而使外排泵活性增强导致耐药。TAC1基因具有高度多态性,目前已发现19个GOF突变位点,随着研究的深入,更多GOF突变将被证实。这些GOF突变都拥有促使外排泵活性增强的调控机制,从而导致白念珠菌产生耐药[17-18]。
与ABC转运蛋白家族相比,MFS类具有较窄的底物特异性,依赖电化学质子动力。在白念珠菌基因组预测的约95种MFS转运蛋白中,只有Mdr1p与氟康唑耐药相关;许多氟康唑耐药株过表达MDR1,该基因的缺失会导致分离株耐药性下降。Mdr1p表达由转录因子mrr1p调控,该因子点突变可诱导MDR1过表达,目前已发现15种不同GOF突变位点[6]。
3 潜在的耐药相关基因
3.1 SRB1
SRB1编码的甘露糖焦磷酸化酶(GDP-mannose pyrophosphorylase)是参与细胞壁甘露聚糖合成的关键催化酶,催化甘露糖-1-磷酸和GTP生成GDP甘露糖从而稳定细胞形态,还可通过糖基修饰影响细胞整体功能。Warits等[19]对酿酒酵母SRB1进行了克隆及测序,这是对念珠菌SRB1首次系统性描述,该基因在调节白念珠菌细胞周期中发挥重要作用,且该基因在2种念珠菌的分子克隆水平具有同源性。随后,Warits等[20]首先指出该编码基因受启动子CAMET3的调控,且编码产物与白念珠菌细胞分离和/或胞质分裂、出芽生长、菌丝形态转换等有关,并对多种抗真菌药物和细胞壁抑制剂敏感,这表明casrb1可能是抗真菌药物治疗靶位。直到2008年,Warits等[21]发现新型隐球菌SRB1cDNA被克隆并证明能够产生甘露糖焦磷酸化酶,因此推测该编码基因可用于新的抗隐球菌化合物的筛选。高来强等[22]在最近的研究首次提出SRB1与白念珠菌氟康唑耐药密切相关,然而,通过检索文献发现,对于白念珠菌SRB1在氟康唑敏感株与耐药株的表达差异并无系统研究,因此,这对白念珠菌新耐药机制的研究提供了新思 路。
3.2 CSC1
CSC1即VPS4/END13,编码48 kDa的AAA-型ATP酶(AAA-type ATPases),参与细胞膜运输,与内吞作用等活动相关[23]。早期研究发现CSC1-1等位基因是在AAA-type ATPases家族中高度保守的CSC1开放阅读框发生错义突变,从而导致自噬,同时在野生型中不会引发自噬,提示CSC1开放阅读框的获得性功能突变与自噬相关,这为缩短葡萄酒发酵时间提供了新思路[24]。在最近的研究中发现,白念珠菌CaCSC1缺失株对酮康唑敏感,因此CSC1可能与白念珠菌酮康唑耐药相关,且白念珠菌临床耐药株CaCSC1基因是否有高表达值得研究[25]。
3.3 凝集素样序列(ALS)家族
早在1995年首次被发现,随后在2001年完成ALS家族中8个基因测序(ALS1-ALS7和ALS9)。大多数Alsp具有附着功能,特别是Als3p,能够附着到内皮细胞或者表皮细胞,在黏附宿主细胞、生物膜形成、入侵宿主细胞、铁获取等多个附着进程中发挥重要作用[26]。此外,调节ALS3的转录因子很多,包括Efg1p、Cph1p、Tec1p、Bcr1p、Nrg1p、Rfg1p和Tup1p等[26]。虽然已对白念珠菌ALS家族生物学方面进行了研究,且槲皮素已被证实能够抵抗白念珠菌生物膜,从而对临床阴道念珠菌病抗真菌药提供思路,但我们仍可以推测,到目前为止仍存在未知的宿主细胞作用位点,这将有助于揭示白念珠菌附着、生物膜形成等机制,从而开发预防及治疗白念珠菌病的药物[27]。
3.4 耐药相关ORF
众所周知,白念珠菌的基因组包含28个ABC转运蛋白,最常见的转运蛋白由CDR基因家族编码[28]。CDR1、CDR2与白念珠菌临床株耐药相关,而CDR3和CDR4具有磷脂翻转酶功能[29]。开放阅读框orf19.4531编码一种ABC假定转运蛋白,导致念珠菌对唑类药物耐药,而对2种多烯类抗真菌药物(两性霉素B和制霉菌素)以及麦角甾醇合成通路抑制剂无抵抗作用。开放阅读框orf19.4531与液泡膜相关,转录因子Tac1可同步上调其与CDR1、CDR2,据报道该基因已在4株唑类耐药株发挥作用[30]。开放阅读框orf19.7119编码TFIIH复合群中的一个组成部分Rad3解旋酶,在转录及核苷酸切除修复(nucleotide excision repair ,NER)中发挥重要作用,从而维持基因组的完整性及多样性[31]。此外,白念珠菌开放阅读框orf19.3727,与植酸酶活性、菌丝形成、上皮细胞黏附等相关,在真菌致病过程发挥关键作用,为研究抗真菌药物提供了新思路[32]。
4 杂合性缺失(loss-of-heterozygosity,LOH)
LOH位于一对同源染色体上的相同基因座位2个等位基因中的1个(或其中部分核苷酸片段)发生缺失,与之配对的染色体上仍然存在。据报道,LOH与白念珠菌氟康唑耐药具有相关性,高复发的LOH发生在白念珠菌3号染色体的右臂,5号染色体的左臂,其中,在3号染色体上,存在编码外排泵的相关基因CDR1、CDR2及调节MDR1家族的转录因子Mrr1。5号染色体上存在编码唑类药物作用靶点的相关基因ERG11,此外,还有调节CDR1、CDR2表达的转录因子Tac1[33]。可见,LOH白念珠菌耐药现象存在联系,并再一次证明已知耐药基因的作用。
5 适应性
Ford等[33]研究报道,无药物存在时,MIC与适应性呈负相关,当有药物存在时,与MIC一致,临床菌株可表现出相对增强的适应性,表明在没有选择压力(即不存在药物)时,白念珠菌获得性功能突变诸如MRR1、TAC1、UPC2等,与适应性降低有关。Ford等[33]找到了240个可能与适应性相关的多态性基因,并根据不同的功能分为5大集群:集群1富集细胞壁和细胞表面基因,集群2是与细胞周期和压力有关的基因,集群3参与药物反应的基因,集群5与碳水化合物结合有关。此外,ERG11某些特定位点的基因突变在引起唑类耐药同时,也与适应性及酶的催化活性有关[34-35]。因此有必要进一步探讨ERG11基因突变如何影响白念珠菌的适应性。
6 生物膜的形成
白念珠菌生物膜的形成经过表面黏附、成丝、成熟、最终分散等一系列过程,可导致白念珠菌在体外药物敏感试验中敏感但体内治疗无效的结果。白念珠菌生物膜耐药机制复杂,目前相关耐药基因也陆续被发现。Nobile等[36]最早证实菌丝壁蛋白1(hyphal wall protein l,Hwp1)是白念珠菌体内生物膜形成所必须的物质,该基因的表达受到锌簇转录因子Bcr1的调控。黏附是白念珠菌生物膜形成的关键步骤,该过程有望揭示新的白念珠菌耐药机制从而防止白念珠菌对人类健康造成威胁。有研究表明,钙调神经磷酸酶抑制剂环孢菌素A(CsA)和FK506通过抑制白念珠菌生物膜的形成,并抑制其黏附、菌丝形成等相关基因的表达,降低细胞表面疏水性、增加细胞内钙浓度及药物转运,从而增强临床上产生生物膜的白念珠菌对氟康唑的敏感性。该机制涉及的黏附相关基因ALS3、菌丝相关基因HWP1、ABC转运蛋白耐药基因CDR1和MDR1以及FLC靶向作用基因ERG11[37]。
综上所述,白念珠菌唑类耐药现象的产生并非由于单一机制的调控,而是多种机制引起,随着时间的推移逐步产生高水平的耐药性。随着更多耐药基因的发现与研究,众多耐药机制联合起来可以让我们更深刻地认识白念珠菌,同时有望找到新的药物治疗靶点。
