岩陀DNA提取方法研究
2019-04-09方强强
方强强,王 燕
岩陀DNA提取方法研究
方强强,*王 燕
(大理大学药学与化学学院,云南,大理 671000)
以岩陀植物嫩叶为材料,用不同方法对岩陀叶片DNA进行提取,比较提取的质量差异,寻找适合岩陀叶片总DNA的提取方法,以满足多基原民族药岩陀DNA条形码识别系统构建的研究需要。采用十六烷基三甲基溴化铵(CTAB)法、改良的CTAB法、十二烷基硫酸钠(SDS)法及碱裂解法提取岩陀叶片总DNA,利用琼脂糖凝胶电泳、紫外分光光度法及PCR扩增效果检查DNA提取的质量。结果显示四种方法均能从岩陀植物叶片中提取到基因组DNA,改良CTAB法提取的DNA纯度和完整性明显好于其他方法,且采用此法进行PCR扩增获得的目标条带明亮单一,扩增效率达到100%。改良的CTAB法是岩陀叶片总DNA的提取中最为合适的提取方法,能够满足后续DNA条形码的研究需要。
岩陀;DNA提取;十六烷基三甲基溴化氨法;十二烷基硫酸钠法,碱裂解法
岩陀药材来源于西南鬼灯檠(Hemsl.)、羽叶鬼灯檠(Hemsl.)或七叶鬼灯檠(Hemsl.)的干燥根茎,属多年生直立草本植物,系虎耳草科鬼灯檠属,为白族、傈僳族等民族习用药材。在《全国中草药汇编》第二、三版及《中华本草》第十卷等中药材书籍中均有收载。该药材具有清热解毒、收敛、消炎、祛风、除湿等功效,可用于肠炎、菌痢、风湿骨痛、外伤出血、老年性支气管炎等常见疾病有较好疗效。岩陀以根茎入药,是我国西南地区常用民族药材,主要分布于我国云南、贵州、四川等高海拔地区,尤其以云南省资源最为丰富[1-4]。一方面,三种鬼灯檠(七叶鬼灯檠、西南鬼灯檠和羽叶鬼灯檠)的花、叶等主要器官形态相近,根的外部形态和内部构造相似性极高,显微鉴别、理化鉴别等传统鉴别方法很难把三者有效地区分开来。长期以来,岩陀品种问题一直存在争议,各种文献表述不一,致使来源于三种鬼灯檠的岩陀药材均在流通并混淆使用,用药的安全有效稳定性难以保证;另一方面,岩陀根茎的主要成分是岩白菜素,我国西南地区的制药企业生产岩白菜素主要依靠采挖野生植物资源,岩陀及其近缘种多生长于高海拔地区,长期过度采挖导致野生资源急剧下降。
DNA条形码是利用基因组中一段标准的短片段进行物种鉴定的新技术,在中药基原鉴别、中药资源生物多样性的保护及开发利用等诸多方面发挥着重要作用。进行DNA条形码的研究,获得高质量的植物基因组DNA为其先决条件,因此本试验采用不同方法(十六烷基三甲基溴化铵(CTAB)法、改良的CTAB法、十二烷基硫酸钠(SDS)法及碱裂解法)对岩陀植物DNA提取结果进行比较研究,以期寻找最佳的DNA提取方法。同时,该研究结果也为其它药用植物在种属鉴别研究中总DNA提取方法的优化选择提供参考。
1 材料与方法
1.1 植物材料
实验所用岩陀植物于2018年7月采自云南省大理苍山蝴蝶泉,由大理大学药学与化学学院生药教研室张德全博士鉴定为羽叶鬼灯檠(Hemsl.),植物标本存放于大理大学药学与化学学院王燕课题组。
1.2 植物基因组总DNA的提取方法
1.2.1 CTAB法[5]
取经95%乙醇擦洗干净的新鲜岩陀植物叶片约100 mg,放置预冷干净的研钵中加入10%的PVP-40后加液氮迅速研磨成均匀细粉。将细粉转移至1.5 mL离心管中,加600 µL 60℃预热的CTAB提取缓冲液(2%CTAB,100 mmol/L Tris-HCl,20 mmol/L EDTA,1.4 mol/LNaCl,2%β-巯基乙醇)迅速混匀;将离心管嵌入泡沫浮板放置60 ℃水浴裂解1.5 h,其间上下颠倒数次,使其裂解均匀;水浴之后取出放至室温加等体积的氯仿-异戊醇(24:1),轻缓颠倒混匀,室温下12000 rpm离心10 min,将上清液转移至新的离心管中;向离心管中加入1/10体积的10%CTAB溶液(10%CTAB,0.7 mol/L NaCl),重复上一步操作;将上清液转移至新的离心管中加入等体积的沉淀缓冲液(1%CTAB,50mmol/L Tris-HCl,10 mmol/L EDTA,1%β-巯基乙醇)缓慢颠倒混匀,室温放置30 min;沉淀完全后8000 rpm离心10 min,弃上清;沉淀用70%乙醇,无水乙醇各洗涤1次,8000 rpm离心3 min,弃上清,将离心管倒置洁净滤纸上,室温挥干残留乙醇,加入80 µLTE Buffer溶解即得DNA样品溶液。
1.2.2 改良CTAB[6]
取经95%乙醇擦洗干净的新鲜岩陀植物叶片约100 mg,放置预冷干净的研钵中加入10%的PVP-40后加液氮迅速研磨成均匀细粉。将细粉转移至1.5 mL的离心管中,加入65 ℃预热的CTAB提取缓冲液600 µL(4%CTAB,100 mmol/L Tris,20 mmol/L EDTA,1.4 mol/L NaCl)充分震荡混匀;将离心管嵌入泡沫浮板放置65℃水浴中裂解2 h,其间上下颠倒数次,使其裂解均匀;水浴后取出放至室温加等体积的苯酚-氯仿-异戊醇(25:24:1),轻缓颠倒混匀,12000 rpm离心10 min,转移上清液至新的离心管中,加入1/10体积4 ℃预冷的3 mol/L的乙酸钠,混匀后再加入等体积的4 ℃预冷的异丙醇,-20 ℃放置30 min以便充分沉淀核酸;沉淀完全后8000 rpm离心5 min,弃上清,加入等体积的2.5 mol/LNaCl溶解沉淀,再加入2 µL的10 mg/mLRnase A去除RNA,缓慢颠倒混匀,37℃水浴保温5 min;水浴之后加入等体积的氯仿-异戊醇(24:1)萃取8000 rpm离心10 min;转移上清液至新的离心管中,加入等体积的4 ℃预冷的异丙醇,-20 ℃放置30 min充分沉淀核酸;8000 rpm离心10 min,弃上清,沉淀用70%的乙醇洗涤2次,将离心管倒置洁净滤纸上,室温干燥,80 µLTE Buffer溶解即得DNA样品溶液。
1.2.3 SDS法[7]
取经95 %乙醇擦洗干净的新鲜岩陀植物叶片约100 mg,放置预冷干净的研钵中加入10 %的PVP-40后加液氮迅速研磨成均匀细粉。将细粉转移至2 mL预冷的离心管中,分别加入 800 µL 65 ℃预热的SDS提取液(10%SDS,100 mmol/L Tris,50 mmol/L EDTA,0.5 mol/L NaCl),10 µLβ-巯基乙醇和2 µLRNase (10 mg/mL)充分摇匀,将离心管嵌入泡沫浮板放置65 ℃水浴2 h,其间上下颠倒数次,使其裂解均匀;水浴后取出放至室温,加入等体积苯酚-氯仿-异戊醇(25:24:1)萃取,12000 rpm离心10 min;取上清液加入等体积氯仿-异戊醇(24︰1),充分混匀,12000 rpm离心10 min;取上清液转移至新的离心管中,加入2/3体积4 ℃预冷的异丙醇,上下颠倒混匀,室温放置30 min,8000 rpm离心5 min,弃上清,沉淀用70%乙醇洗涤2次,将离心管倒置洁净滤纸上,室温干燥,80 µL TE Buffer溶解即得DNA样品溶液。
1.2.4 碱裂解[8]
取经95 %乙醇擦洗干净的新鲜岩陀植物叶片约100 mg,放置预冷干净的研钵中加入10%的PVP-40后加液氮迅速研磨成均匀细粉,转入预冷10 mL的离心管中,加入1.0 mL裂解液Ⅰ (20mmol/L Tris-HCl(PH8.0)、10 mmol/L EDTA)充分混匀,加入2 mL裂解液Ⅱ(1% SDS、0.2 mol/L NaOH),充分震荡混匀,将离心管嵌入泡沫浮板放置65℃水浴中裂解1 h,水浴后取出放至室温,加入等体积的氯仿-异戊醇(24:1)充分混匀,12000 rpm离心5 min,将上清液分别转移至1.5 mL离心管(1/3V)中,再加入2/3体积的预冷异丙醇,混匀,室温放置30 min,12000 rpm离心5 min,弃上清,沉淀用70%乙醇洗涤2次,将离心管倒置洁净滤纸上,室温干燥,80 µL TE Buffer溶解即得DNA样品溶液。
1.3 DNA质量检测
取10 µL DNA样品稀释至50 µL,核酸蛋白检测仪读取其在260、280 nm波长下的吸光值,根据A260/A280判断样品纯度。采用0.8 %的琼脂糖凝胶,0.5×TBE Buffer,溴化乙锭染色,恒压(5 V/cm),电泳45 min,凝胶成像系统观察并拍照。通过DNA电泳条带分析DNA bp数及完整性。
1.4 PCR扩增检测
取1 µL DNA样品稀释至10 µL,将稀释后的DNA溶液取1 µL作为PCR扩增模板,ITS2引物序列[9]S2F:5’-ATGCGATACTTGGTGTGAAT-3’;S3R:5’-GACGCTTCTCCAGACTACAAT-3’进行PCR扩增。PCR反应体系:25 µL(12.5 µL 2×Taq PCR Master Mix(red dye),1 µL模板,正反向引物(10 mmol/L)各1 uL,9.5 µL ddH2O)。PCR反应程序:[94℃ 4 min;(35cycles:94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s);72 ℃ 10 min;4 ℃ ∞],PCR产物采用1.0%琼脂糖凝胶进行检测,0.5×TBE Beffer,溴化乙锭染色,恒压(4 V/cm),电泳时间35 min,凝胶成像系统观察并拍照。
2 结果与分析
2.1 紫外检测
分别采用常规CTAB法、改良CTAB法、SDS法及碱裂解法对岩陀叶片总DNA进行提取,核酸蛋白紫外检测结果见表1。改良CTAB法提取的DNA A260/A280值在1.775~1.867,说明该方法提取的DNA中RNA、酚类、多糖和蛋白质等杂质较少,提取的DNA较为纯净;CTAB法DNAA260/A280值均大于1.9,说明该方法提取的DNA中含有RNA。碱裂解和SDS法提取的DNAA260/A280值均小于1.5,说明这两种方法提取的DNA含有蛋白质等杂质。 CTAB、碱裂解和SDS法提取的DNA浓度普遍偏高,远大于改良的CTAB法提取的DNA浓度值,可能的原因为此三种方法提取的DNA中存在RNA、蛋白质和糖类等杂质,样品DNA纯度受到很大影响。
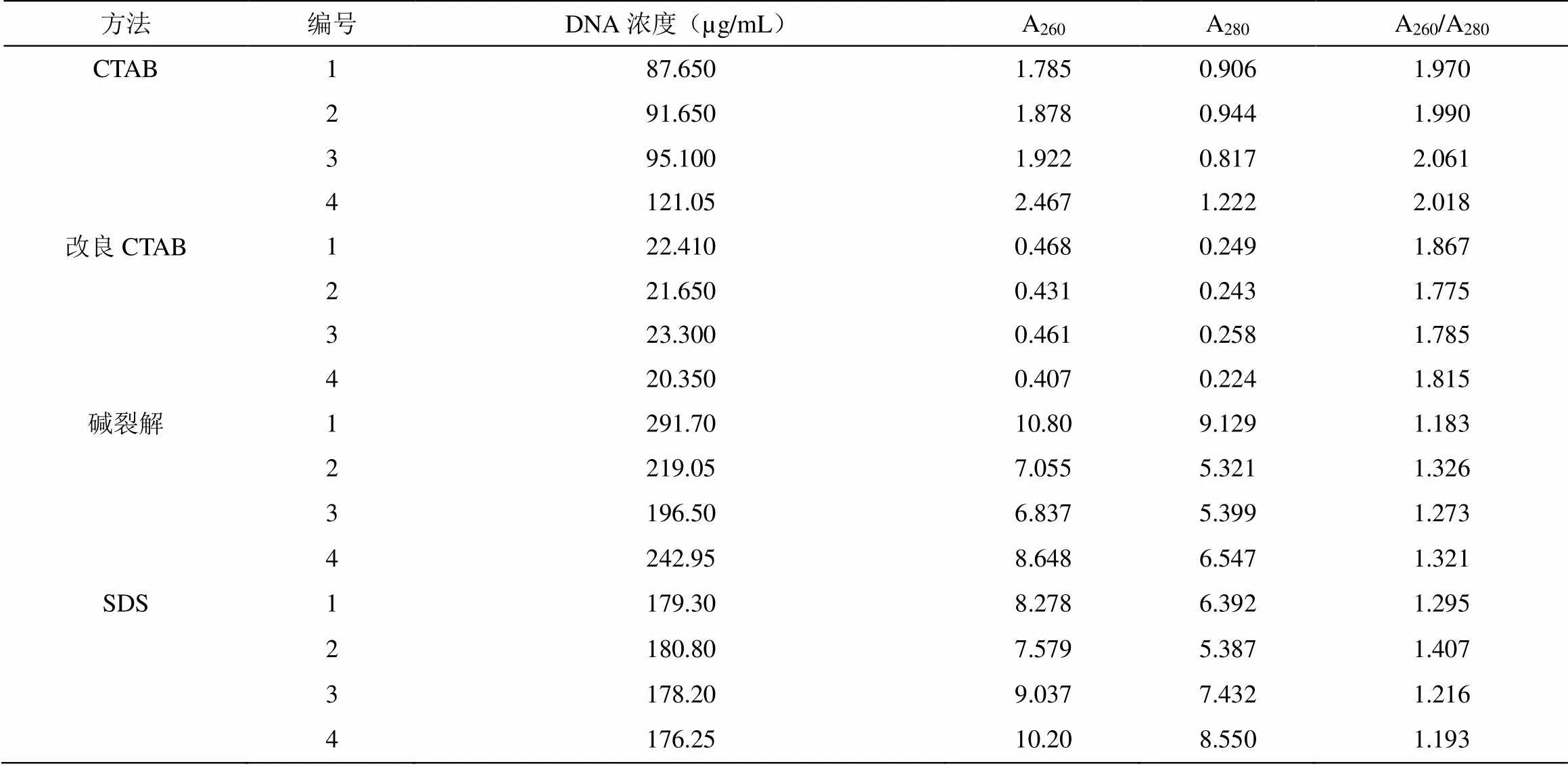
表1 不同DNA提取方法的岩陀样品紫外检测结果
2.2 DNA琼脂糖凝胶电泳检测
对常规CTAB法、改良CTAB法、SDS法和碱裂解法提取的岩陀植物叶片总DNA进行琼脂糖凝胶电泳检测,结果见图1。以上四种方法提取的岩陀叶片总DNA在15kb附近均有条带,改良的CTAB法提取的DNA条带单一明亮,无拖尾和弥散现象且点样孔中干净无残留,说明改良的CTAB法提取的DNA纯度较高;常规CTAB法提取的DNA同改良过的CTAB法相比存在RNA污染;SDS法和碱裂解法提取的DNA条带均有弥散现象,点样孔中有亮斑,说明这两种方法提取的总DNA中含有多糖或蛋白质杂质。SDS法较碱裂解法能看到DNA总条带的存在,而碱裂解法DNA总条带模糊,不易分辨,在四种DNA提取方法中碱裂解法提取效率最低。

A. 改良CTAB法;B. CTAB法;C. SDS法;D. 碱裂解法
2.3 PCR扩增检测
对以上四种不同方法提取的岩陀叶片总DNA进行PCP扩增,结果见图2。以改良CTAB法提取的DNA为模板扩增条带明亮清晰,且扩增率达到100%。以常规CTAB法提取的DNA为模板虽然也全部扩增出来,与改良CTAB法相比部分条带较暗,且存在非特异性扩增现象。以SDS法提取的DNA为模板,扩增效率偏低且有非特异性扩增,会严重影响下游操作的完成;以碱裂解法提取的DNA为模板扩增结果出现假阴性,条带弥散更不利于下游操作的完成。综合紫外检测和琼脂糖凝胶电泳结果,改良CTAB法更适合岩陀植物叶片总DNA的提取,能够满足高质量PCR扩增的需求。

A . 改良CTAB法 B. CTAB法 C. SDS法 D. 碱裂解法
3 讨论
自然界中无论植物、动物还是微生物,大都以DNA作为遗传物质,为了研究不同种属之间的差异,寻找适宜的DNA提取方法必不可少。目前,研究报道的三大DNA提取方法包括:沉淀法、磁珠法、离心柱法。沉淀法是DNA提取常用的方法,该方法的关键问题是杂质的去除。因此,不少专家学者给出了自己的见解,Fang等[10]认为在高盐TE缓冲液中,用无水乙醇沉淀DNA能够有效去除多糖。肖智样等[11]认为CTAB裂解液中适量增加EDTA的用量及异丙醇沉淀过夜能提高DNA的纯度;离心柱法是通过将对核酸有吸附作用的活性官能团镶嵌在离心柱上,加入不同的裂解液,洗涤试剂反复离心,达到核酸与杂质分离的目的。离心柱法提取DNA过程中需要的样品量较大,不适宜对珍稀样本DNA的提取;磁珠法[12]是通过磁珠表面修饰对核酸有吸附作用的活性官能团,利用磁珠的磁性在外磁场的作用下定向移动实现DNA的富集,从而达到将核酸与杂质分离的目的,该方法操作简单,用时短,安全无毒,灵敏度高,适用于痕量DNA的提取,但该方法成本较高不适合大量样本DNA的提取。
本试验对岩陀DNA提取方法进行研究,目的是获取高质量的基因组DNA,对核糖体ITS/ITS2序列、叶绿体、、等序列能够成功扩增,便于测序。本实验在试验研究中发现,使用根部细胞提取的植物基因组DNA无法成功扩增叶绿体、、等序列,初步分析原因是无法在根部细胞中提取到叶绿体基因。因此,在岩陀种DNA提取方法研究中选择该药材植物叶片作为试验材料较为适合。该试验采用的提取方法是沉淀法中的CTAB法、碱裂解法和SDS法。在用不同方法提取DNA过程中发现:SDS法提取的DNA在干燥后呈棕黄色,说明提取的DNA样品中含有酚污染;碱裂解法提取的DNA干燥后呈胶冻状,说明提取的DNA样品中含有多糖类物质,与图1 SDS法和碱裂解法提取的DNA电泳结果基本吻合。SDS法、碱裂解法提取的DNA电泳条带弥散且点样孔中有亮斑,后续进行的PCR扩增,产物电泳大多较暗,不清晰;而采用改良的CTAB法提取的DNA纯度高,PCR扩增产物电泳条带清晰明亮,扩增效率也较高。因此,改良CTAB法可以作为岩陀植物叶片DNA提取方法的最佳选择。
在植物总DNA提取过程中,最常出现的问题是自身DNA酶的剪切和次生代谢产物的干扰。因此,在植物总DNA提取实验中需要注意:(1)植物叶片选择无病虫侵害的新鲜叶片,提取前用95%乙醇擦洗叶片表面,吸水纸擦干后再进行液氮研磨,既能使酶失活又能防止外源DNA的污染;(2)岩陀叶片中含有酚类、多糖等次生代谢产物,在研磨过程中适量加入PVP-40(酚类化合物的螯合剂),能有效防止酚类物质氧化,防止其与DNA的结合[13]。对于多糖的去除办法,各种文献报道不一,原因在于不同植物的DNA提取方法中对于多糖处理各异,笔者去除多糖采用的是高盐法,DNA裂解液中NaCl的浓度增加到1.4 mol/L可以有效去除多糖。改良的CTAB法和常规CTAB法提取的DNA沉淀干燥后呈无色且在电泳图一中两种方法的点样孔都无杂质残留,这一现象也证实多糖已被有效去除。
目前,中药DNA条形码研究在中药鉴别领域处于领先地位,为传统鉴别方法出现的瓶颈提供新的思路。DNA提取方法也是日新月异,但中药品种复杂多样,同种DNA提取方法很难广泛应用于多种药用植物。因此,针对不同植物DNA提取方法的研究很有必要。本实验针对岩陀植物DNA提取方法进行了研究,期望能为其它植物的DNA提取提供一定的参考和借鉴意义。
[1] 谢宗万. 全国中草药汇编[M]. 北京:人民卫生出版社,1996: 373.
[2] 国家中药学管理局《中华本草》编委会. 中华本草:第十卷 [M]. 上海:上海科学技术出版社, 1998: 47.
[3] 潘玉杰,蒋坤,夏文,等. 岩陀中岩白菜素含量测定[J]. 医药导报, 2016, 35(10): 1130-1133.
[4] 黄梦玺,彭朝霞,杨朝莲,等. 贵州地产岩陀的质量研究[J]. 医药与保健, 2015,23(2): 166-166.
[5] 黄璐琦. 分子生药学[M]. 2版,北京:北大医出版社, 2006: 38-40.
[6] 何雪娇,郑涛,苏金强,等. 改良CTAB法提取野牡丹科7种植物DNA[J]. 广东农业科学, 2011, 31(18): 120-122.
[7] 罗焜,马培,姚辉,等. 中药DNA条形码鉴定中的DNA提取方法研究[J]. 世界科学技术-中医药现代化,2012,14(2): 1433-1439.
[8] 王茜,侯飞侠,王艺璇,等. 碱裂解法快速提取虫草属真菌DNA研究[J]. 时珍国医国药, 2016,27(4): 995-997.
[9] 陈士林. 中药DNA条形码分子鉴定[M]. 北京:人民卫生出版社, 2012.
[10] Fang G, Hammar S,et al. A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J]. BioTechniques, 1992, 13(1): 52-56.
[11] 肖智样,白冠章,张玲,等. 改进的CTAB法提取胡杨()总DNA[J]. 塔里木大学学报, 2009, 21(2): 29-32.
[12] 王平康,骆延,王光志,等. 磁珠法快速提取鉴定DNA的实验研究[J]. 生物学通报, 2006, 41(6): 50-51.
[13] 童巧珍,周日宝,刘湘,等. 药用百合鳞叶中总DNA提取方法的研究[J]. 中国药房, 2008, 19(6): 406-408.
GENOMIC DNA EXTRACTION METHODS FOR
FANG Qiang-qiang,*WANG Yan
(College of Pharmacology, Dali University, Dali, Yunnan 671000, China)
Fresh leaves ofwere used as experimental materials, the differences of the DNA extraction effects among different methods were compared to find proper DNA extraction methods for meeting the study demands on constructing DNA barcode recognition system ofwith different origins. CTAB method, improved CTAB method, SDS method and alkaline lysis method were used to extract total DNA, the quality of DNA extraction were evaluated by agarose gel electrophoresis, UV spectrophotometry and PCR amplification effect. The results showed that all four methods could extract genomic DNA from the leaves of, DNA purity and integrity in improved CTAB method is significantly higher than that in other methods, in which the PCR amplification efficiency reaches 100%, and the amplified bands are bright and clear. The improved CTAB method can be used as a suitable method for extracting total DNA from the leaves ofand could meet the study demand of DNA barcode.
; DNA extraction; CTAB method; SDS method; alkaline lysis method
Q781
A
10.3969/j.issn.1674-8085.2019.02.005
1674-8085(2019)02-0019-06
2018-12-20;
2019-01-25
国家自然科学基金项目(81560695);大理大学博士启动基金项目(KYBS201512);大理大学第八批中青年学术带头人培养基金项目
方强强(1990-),男,河南郑州人,硕士生,主要从事中药分子鉴定研究(E-mail:1053725723@qq.com);
*王 燕(1982-),女,云南大理人,副教授,博士,硕士生导师,主要从事体内药物分析学研究(E-mail:175404624@qq.com).
