改性橘子皮对Pb2+的吸附研究
2019-04-09钱晓敏丛龙洋张钱丽
钱晓敏,丛龙洋,张钱丽*
(1.苏州科技大学 化学生物与材料工程学院,江苏 苏州215009;2.江苏海尔森检测技术服务有限公司,江苏 苏州215123)
橘子作为一种味美多汁、营养丰富的水果,深受人们的喜爱,我国柑橘品种多样,产量颇丰,继而产生的废弃橘子皮量也很大。如果能有效利用这些橘子皮,不仅能解决废弃物处理问题,还能变废为宝。国内外学者对于如何有效利用橘子皮展开了大量研究[1]。橘子皮富含纤维素和木质素等有机成分[2],可用一些化学试剂对其进行改性,从而制得吸附性能良好的吸附剂材料[3-4]。随着经济的发展,环境污染日益受到人们的关注,尤其是重金属污染。在诸多重金属污染中,铅的毒性较大且较为常见,其来源于各种油漆、电池、冶炼、机械、电镀类产品、美容美发类产品、瓷器餐具类产品等[5]。铅能影响人体骨骼及智力的正常发育,造成消化功能和内分泌功能的紊乱,损害肾脏以及降低免疫力等[6-7]。对含铅废水,可用吸附法、膜分离法、离子液体萃取法、化学沉淀法等进行处理并回收铅资源[8],其中吸附法是研究热点[9]。Yang Fan 课题组[10]报道生物炭石墨烯复合物可以很好地同时去除农药莠去津和Pb2+,对Pb2+的吸附容量达到26.1 mg·g-1。廖柏寒等[11]报道改性谷壳生物炭负载磁性Fe 可去除废水中的Pb2+,吸附量为33.2 mg·g-1。
研究表明,化学改性橘子皮对重金属离子有很好吸附,郭学益课题组报道了CaCl2改性橘子皮、MgCl2改性橘子皮、巯基乙酸改性橘子皮对重金属离子的吸附[12-14]。化学改性橘子皮后羟基、羧基等官能团暴露于材料表面,并能降低橘子皮中高分子聚合物的聚合度,使木质纤维素材料出现膨胀,增大内部孔隙率和表面积,提升吸附重金属离子的能力。此外,以橘子皮为原料制备生物炭吸附重金属离子也常见报道[15-17]。将橘子皮制备成生物炭即在无氧条件下高温煅烧产生一种碳素含量高、孔隙结构丰富的物质,其缺点是能耗比较高。笔者同时制备了CaCl2改性橘子皮、MgCl2改性橘子皮和橘子皮生物炭,比较以上吸附剂对Pb2+的吸附行为,旨在筛选出性能优越、制备方便的Pb2+吸附剂,为橘子皮基吸附剂去除污水中Pb2+提供理论基础和方法。
1 实验部分
1.1 仪器与试剂
硝酸铅、NaOH、无水乙醇、CaCl2、MgCl2购自上海国药集团化学试剂有限公司,均为分析纯;实验用水为二次蒸馏水。
实验中使用管式炉(SKGL-1200,上海大恒光学精密机械有限公司)制备生物炭,使用火焰原子吸收光谱仪(A3-AFG,北京普析通用仪器有限责任公司)测定Pb2+的含量,使用场发射扫描电子显微镜(日立S-4700)表征吸附剂的微观形貌,使用红外光谱仪(Spectrum BXII,美国PerkinELmer Ins trumentsCo,Ltd)表征吸附剂官能团变化。
1.2 吸附剂的制备
(1)取500 g 橘子皮,洗净、烘干、粉碎,把粉碎好的橘子皮粉过40 目筛,得橘子皮粉吸附剂。
(2)称取30 g 橘子皮粉于烧杯中,加入250 mL 无 水乙醇、125 mL 0.8 mol·L-1的NaOH 和125 mL 0.8 mol·L-1的CaCl2溶液,搅拌18 h,抽滤、洗涤、烘干得CaCl2改性的橘子皮吸附剂[18]。
(3)称取30 g 橘子皮粉于烧杯中,加入200 mL 无 水乙醇、100 mL 0.5 mol·L-1的NaOH 和100 mL 1 mol·L-1的MgCl2溶液,搅拌18 h,抽滤、洗涤、烘干得MgCl2改性的橘子皮吸附剂[19]。
(4)将160 g 橘子皮粉放入管式炉,380 ℃氮气氛围下煅烧2 h,得到橘子皮生物炭。
1.3 吸附实验
在50 mL 比色管中加入25 mL 40 mg·L-1的Pb2+溶液,加入一定量吸附剂,恒温振荡一定时间,静置,用火焰原子吸收分光光度法测量上清液中Pb2+的含量,计算吸附率a(%)

式中C0为Pb2+的初始浓度,Ce为吸附平衡时Pb2+的浓度。
2 结果与讨论
2.1 吸附剂吸附性能比较
于1~8 号50 mL 比色管中分别加入25 mL 40 mg·L-1的Pb2+溶液后,分别加入0.01、0.03、0.06、0.09、0.12、0.15、0.18、0.21 g 制备好的吸附剂,恒温30 ℃水浴振荡30 min,静置,用火焰原子吸收分光光度法测量上清液中Pb2+的浓度,计算吸附率。图1 为橘子皮粉(曲线a)、橘子皮粉生物炭(曲线b)、MgCl2改性橘子皮粉(曲线c)、CaCl2改性橘子皮粉 (曲线d) 用量对Pb2+吸附率的影响。由图1 可知,橘子皮粉对Pb2+有一定吸附,但吸附性能比较差,橘子皮粉用量为0.15 g 时基本达到饱和吸附,吸附率为18.3%;将橘子皮制备成生物炭能大幅度提高其对Pb2+的吸附,用量为0.15 g 时也基本达到饱和吸附,吸附率为55.34%;用MgCl2改性橘子皮粉的吸附性能和橘子皮生物炭的吸附性能相当,用量为0.18 g 达到饱和吸附,吸附率为60.1%;而用CaCl2改性橘子皮的吸附性能最好,0.12 g 的用量就能达到饱和吸附,吸附率为98.4%。由以上实验结果可知,化学改性橘子皮粉或橘子皮生物炭能有效吸附Pb2+。从吸附性能、能耗、吸附剂制备简便等方面综合考虑,用CaCl2对橘子皮粉进行改性是较好的选择,笔者选用其作为吸附剂进行后续试验。

图1 吸附剂用量对Pb2+吸附率的影响
2.2 吸附条件的优化
试验吸附时间和温度对CaCl2改性橘子皮吸附Pb2+的影响。在5 支50 mL 比色管中分别加入25 mL 40 mg·L-1的Pb2+溶液和0.2 g CaCl2改性橘子皮,在30 ℃下分别恒温振荡10、20、30、40、50 min,静置,测量上清液中的Pb2+浓度,计算吸附率,结果如图2(A)所示。在8 支50 mL 比色管中分别加入25 mL 40 mg·L-1的Pb2+溶液和0.2 g CaCl2改性橘子皮粉,控制振荡温度为20、30、40、50、60、70、80、90℃,振荡吸附30 min后,静置,测量上清液中的Pb2+浓度,计算吸附率,结果如图2(B)所示。由图2 可知,CaCl2改性橘子皮对Pb2+的吸附是个快速吸附过程,30 min 就能达到吸附饱和,吸附率为99.6%;而吸附温度低于30 ℃时吸附率均高于99.5%,当温度高于40 ℃,吸附率随着温度的增加大幅度下降,说明CaCl2改性橘子皮粉对Pb2+的吸附是个放热过程,温度升高阻碍吸附的进行,此外温度升高,Pb2+运动加剧,也不利于吸附。

图2 吸附时间(A)和吸附温度(B)对Pb2+吸附率的影响
2.3 吸附等温线
0.2 g CaCl2改性橘子皮粉吸附25 mL 浓度分别为5、20、40、60、80、100 mg·L-1的Pb2+溶液,在30 ℃下恒温振荡30 min,做吸附等温实验,以平衡吸附量qe对吸附平衡时Pb2+浓度Ce作吸附等温曲线,如图3所示。其中平衡吸附量qe(mg·g-1)由公式qe=[(C0-Ce)×V]/m计算,式中C0为Pb2+的初始浓度,Ce为吸附平衡时Pb2+的浓度,m为吸附剂的质量(mg),V为溶液的体积(mL)。
由图3 可知,当Pb2+平衡浓度较小时,平衡吸附量随平衡浓度的增加快速增加;当平衡浓度达0.54 mg·L-1后,平衡吸附量基本稳定。说明CaCl2改性橘子皮粉对Pb2+的吸附可能为单分子层吸附,当Pb2+平衡浓度较低时,CaCl2改性橘子皮粉表面有大量吸附位点,平衡吸附量随着平衡浓度的增加而快速增加;当越来越多的吸附位点被占据后,平衡吸附量不随平衡浓度的增加而增加,基本达到饱和吸附。
用Langmuir 吸附等温方程和Freundlich 吸附等温方程对实验结果进行模拟拟合,结果如图4所示。Langmuir 吸附等温方程和Freundlich 吸附等温方程分别为

方程中Ce为 吸附平衡时溶液的浓度(mg·L-1),qe为平衡吸 附量(mg·g-1),Q0为 单层饱 和最大 吸 附容量(mg·g-1),b为吸附平衡常数(L·mg-1),n与吸附强度有关,kf为反映吸附容量的吸附常数。
由图4 可知,用Langmuir 方程拟合方程为Y=0.016 99x+0.053 6,相关系数为0.980 5,用Freundlich 方程拟合方程为Y=0.331 0x+1.101 2,相关系数为0.858 0,说明用Langmuir 方程模拟的结果比Freundlich 方程模拟的结果更好,CaCl2改性橘子皮粉对Pb2+的吸附是langnuir 单层吸附。
2.4 吸附-脱附循环实验
于50 mL 比色管中加入25 mL 40 mg·L-1的Pb2+溶液,加入0.2 g CaCl2改性橘子皮粉吸附剂,30 ℃恒温振荡30 min 后静置,测定吸附率。过滤吸附剂,用20 mL 0.2 mol·L-1HCl 解吸附(恒温30 ℃下震荡30 min后静置),用蒸馏水洗至中性,烘干。再次吸附同浓度的Pb2+,如此循环,测定CaCl2改性橘子皮粉吸附剂可重复使用的次数,结果如图5所示。
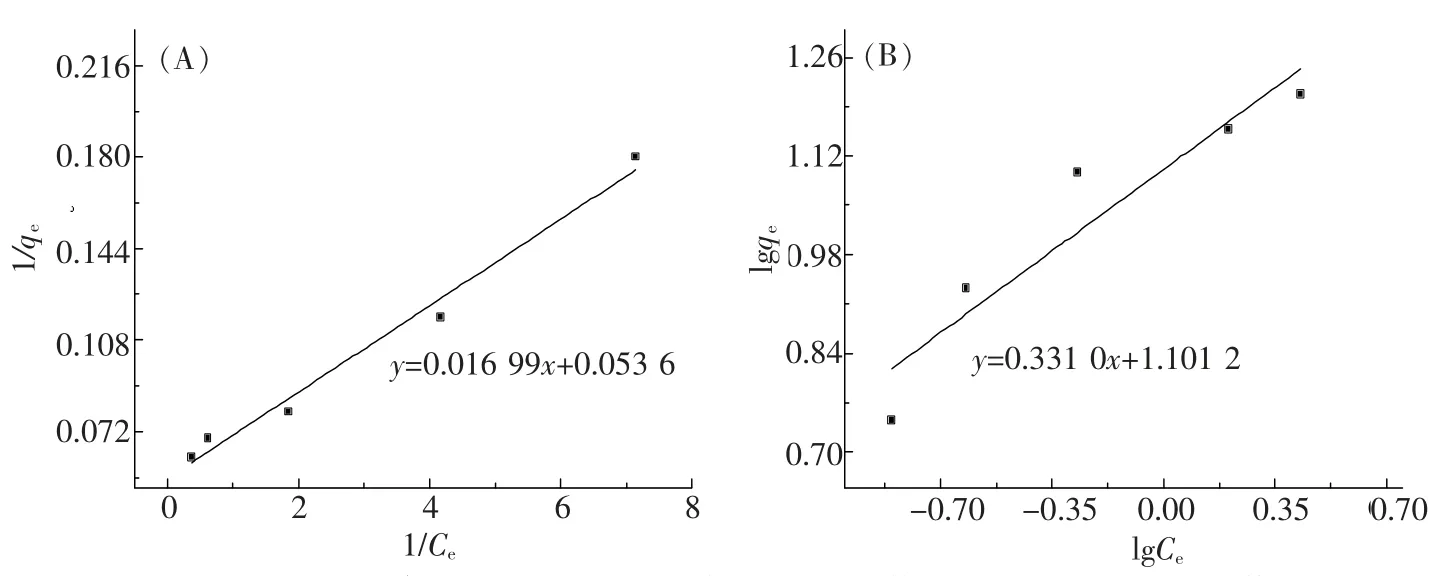
图4 CaCl2改性橘子皮对Pb2+的吸附Langmuir 模型(A)和Freundlich 模型(B)
由图5可知,从第三次开始,CaCl2改性橘子皮粉吸附剂对Pb2+的吸附率开始下降。前三次的吸附率保持在97%以上,说明CaCl2改性橘子皮粉吸附剂至少能有效循环利用三次。
2.5 吸附剂的表征
2.5.1 SEM 表征
图6为橘子皮粉(A)、CaCl2改性橘子皮粉(B)、MgCl2改性橘子皮粉(C)和橘子皮生物炭(D)的扫描电镜图。由图6 可以看出,橘子皮粉呈现出比较致密的结构,经过化学改性或碳化后,吸附剂表面变得粗糙和疏松,存在许多褶皱,增加了吸附剂表面积,有利于吸附Pb2+。

图5 吸附-脱附循环实验

图6 橘子皮粉(A)、CaCl2改性橘子皮粉(B)、MgCl2改性橘子皮粉(C)和橘子皮生物炭(D)的扫描电镜图

图7 橘子皮粉(A)和CaCl2改性橘子皮粉(B)的红外光谱图
2.5.2 红外光谱分析
图7 为橘子皮粉(曲线A)和CaCl2改性橘子皮粉(曲线B)的红外光谱图。图7 曲线(A)中3 429 cm-1吸收峰表明吸附剂表面存在大量的羟基 (-OH);2 926 cm-1处吸收峰对应CH、CH2和CH3中C-H 键的伸缩振动;1 743 cm-1处吸收峰对应羧基或酯基(-COOH、-COOCH3)中C=O 键的伸缩振动;1 643 cm-1处吸收峰对应离子化羧基(-COO-)中C=O 键的伸缩振动;1 069 cm-1处吸收峰对应醇或羧酸中C-OH 键的伸缩振动[20]。比较橘子皮粉和CaCl2改性橘子皮粉的红外光谱可知,CaCl2改性橘子皮粉中自由羰基峰(1 743 cm-1)消失,离子化羧基峰(1 643 cm-1)移动到1 631 cm-1,在1 323 cm-1处出现新峰,这些结果表明CaCl2改性使橘子皮上羧基、羟基官能团发生了变化。改性过程中使用的NaOH可使橘子皮中酯化羧基发生皂化,提高了离子化羧基的数量,CaCl2的加入能起到交联作用,有效吸附Pb2+离子。
3 结语
选用橘子皮为原料,对其进行CaCl2改性、MgCl2改性和无氧煅烧制备生物炭,用火焰原子吸收分光光度法监测上述四种吸附剂对Pb2+的吸附能力。实验结果表明,CaCl2改性橘子皮吸附性能最好,吸附温度30℃,吸附30 min,其最大吸附容量可达22.39 mg·g-1。吸附过程可用Langmuir 吸附等温模型拟合,属于单层吸附。
