球头三型孢菌产赤藓糖醇的两阶段pH值调控
2019-04-09顾丽娜李良智郭伟强胡翠英扶教龙
顾丽娜,李良智,郭伟强,康 培,胡翠英,扶教龙
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009)
赤藓糖醇(1,2,3,4-丁四醇)是一种天然的四碳糖醇,它存在于自然界的一些蘑菇和水果中,同时酒、酱油等发酵类产品中也能检测到赤藓糖醇的存在[1]。在10%的质量浓度下,赤藓糖醇的甜度约为蔗糖的60%~80%[2]。另有研究表明,赤藓糖醇的血糖指数和胰岛素指数分别为0 和2,因而赤藓糖醇的摄入几乎不会造成血液中葡萄糖水平的上升[3]。此外,大多数糖醇类甜味剂的热量值大约在2 cal·g-1,而赤藓糖醇的热量值只有0.2 cal·g-1[4]。同时,赤藓糖醇还具有很高的人体耐受量,即使大量食用也不易引起腹泻或肠胃胀气[5]。由于很多口腔微生物无法利用赤藓糖醇,食用赤藓糖醇也不会造成龋齿[6]。因此,它是一种优良的食品甜味剂。
据专利报道,球头三型孢菌(Trichosporonoides oedocephalis)可耐受20%~60%(w/v)的葡萄糖,是生产赤藓糖醇的优良菌株[7]。在前期关于渗透压对球头三型孢菌产赤藓糖醇代谢影响的研究过程中发现:在初始pH值为5.5 的条件下,发酵36 h 后,发酵液的pH值会降至3.0 以下,这说明球头三型孢菌在利用葡萄糖生产赤藓糖醇的发酵前期,产生了大量的有机酸,造成发酵体系的pH值迅速下降。这种低pH值胁迫的持续进行会影响酵母质膜所带的电荷,引起细胞质膜对部分离子的通透性发生变化,并最终影响细胞对营养物质的吸收、酶的合成、酶活性的发挥以及正常的代谢途径。过低的pH值还会造成酵母蛋白变性,引起细胞死亡[8-9]。因此,在采用球头三型孢菌以葡萄糖为底物发酵生产赤藓糖醇的过程中,对发酵体系的pH值进行合理调控是十分必要的。进一步地,由于细胞在一个发酵周期内的生理状态有差别,其菌体生长和产物合成达到最优值所需的pH值可能并不相同。事实上,已经有很多研究着眼于探索发酵过程的分段pH值控制策略。例如,为了提高菌株产甘露醇的能力,岳敏等人[10]采取了两阶段pH值控制策略,即在发酵的前12 h 将pH值控制在5.5,之后将pH 降至4.5,最终得到了103 g·L-1的甘露醇产量。2013 年,江南大学的张显等人[11]基于3-羟基丁酮还原酶/2,3-丁二醇脱氢酶对pH值的偏向性,提出了两阶段pH值控制策略,即在发酵的前48 h 将pH值控制在6.5,后48 h 则控制在8.0,最终在pH值控制策略的基础上进行补料分批发酵,将3-羟基丁酮的产量提高到73.6 g·L-1。此外,浙江大学的研究人员在发酵的前48 h 将pH值控制在6.8 以促进细胞生长,然后将其调至5.8 以增强吡喹啉奎宁(PQQ)的生物合成。最终,PQQ 的产量提高到158.61 mg·L-1,比最适恒定pH值条件下的产量提高了44.9%[12]。针对球头三型孢菌发酵生产赤藓糖醇的pH值调控问题,目前国内外还未有系统的研究。
笔者首先采用摇瓶发酵初步研究了pH 对球头三型孢菌产赤藓糖醇的影响,接着在5L发酵罐中进行pH 恒定为4.5、5.0、5.5、6.0 的比较发酵,根据球头三型孢菌在不同pH 条件下的赤藓糖醇产量、菌体生物量、葡萄糖消耗速率和赤藓糖还原酶(ER)酶活等参数的变化规律,最终探索出适合该菌株生产赤藓糖醇的pH值调控策略。
1 材料与方法
1.1 菌株
耐高渗酵母球头三型孢菌(Trichosporonoides oedocephalisATCC 16958)购自美国标准菌种收藏所。
1.2 实验试剂
酵母粉和蛋白胨购自北京奥博星生物技术有限公司;葡萄糖、氯化钾、硫酸镁、磷酸二氢钾购自国药集团化学试剂有限公司;NADPH 购自上海翊圣生物科技有限公司;赤藓糖购自上海源叶生物科技有限公司。
1.3 培养基
种子培养基:酵母浸粉10 g·L-1,蛋白胨20 g·L-1,葡萄糖20 g·L-1。发酵培养基:酵母浸粉10 g·L-1,葡萄糖200 g·L-1,磷酸二氢钾0.5 g·L-1,硫酸镁0.5 g·L-1,氯化钾5 g·L-1。
1.4 培养方法
1.4.1 种子培养 从4 ℃保存的斜面培养基上刮取一环菌接种到50 mL 种子培养基中,在30 ℃、200 rpm的摇床条件下培养48 h。
1.4.3 5L发酵罐发酵培养 将培养至指数中期的种子液以10%的接种量接种到5 L 发酵罐中,发酵罐的装液量为3 L,通气量控制在0.5~1 vvm,搅拌转速350 r·min-1,温度30 ℃。
1.5 分析方法
1.5.1 赤藓糖醇产量测定 高效液相色谱法(HPLC):采用Agilent 1260 系统,NH2P-50 4E(250 mm×4.6 mm,Shodex,Japan)色谱柱,ELSD(蒸发光散射检测器)检测器。样品分析条件为:柱温30 ℃,流动相为“乙腈-水(70∶30)”,流速0.7 mL·min-1。ELSD 的漂移管温度设为35 ℃,氮气流量为1.6 L·min-1,增益值为1。
1.5.2 生物量测定 通过测定细胞的干重来确定生物量浓度。发酵周期内取出一定体积的发酵液,14 000 r·min-1离心20 min,去上清,将沉淀用去离子水清洗两遍后,再次离心。小心丢弃上清液,将细胞沉淀物在80 ℃烘箱中干燥至恒定干重。
1.5.3 残糖测定 取发酵液离心,上清液经适当稀释后,用葡萄糖氧化酶膜生物分析仪(SBA 生物传感分析仪)测定残余葡萄糖量。
1.5.4 ER 酶活测定 使用牛血清蛋白作为标准,用二喹啉甲酸(BCA)测定法测定总蛋白浓度。ER 酶活测定方法参照文献[13]进行,并作适当调整。反应缓冲体系为:50 mM 磷酸盐缓冲液(pH=6.5),12 mM 赤藓糖,0.2 mM NADPH。酶反应温度为37 ℃。37 ℃下1 min 催化1 μmol NADPH 氧化所需的酶量定义为一个酶活单位。比酶活用每毫克细胞蛋白的酶活性表示。
2 结果与讨论
2.1 不同初始pH值对球头三型孢菌发酵产赤藓糖醇的影响
将发酵培养基的初始pH值分别调整至4.0、4.5、5.0、5.5 和6.0,接种后置于摇瓶中进行发酵培养,120 h 后检测发酵产物中赤藓糖醇的含量。测定结果如图1所示。
图1 数据表明,随着pH值的增大赤藓糖醇的产量不断提高。pH=4.0 时,赤藓糖醇产量仅为25.19 g·L-1,而当pH值增大至6.0 时,赤藓糖醇的产量提高至45.79 g·L-1,是pH=4.0 时产量的1.82 倍。由此可见,pH值这一环境条件对于球头三型孢菌生产赤藓糖醇的发酵过程影响很大,故采用合适的策略对发酵体系的pH值进行合理调控是十分重要的。

图1 不同初始pH值对赤藓糖醇合成的影响
2.2 5L发酵罐中恒定pH值发酵
在上述摇瓶实验的基础上,笔者在5 L 发酵罐中继续进行恒定pH值(4.5、5.0、5.5 和6.0)的发酵研究,并在整个发酵周期内,每隔12 h 取样检测赤藓糖醇产量(如图2所示)、菌体生物量(如图3所示)和葡萄糖剩余量(如图4所示)。

图2 不同恒定pH值条件下球头三型孢菌产赤藓糖醇发酵曲线
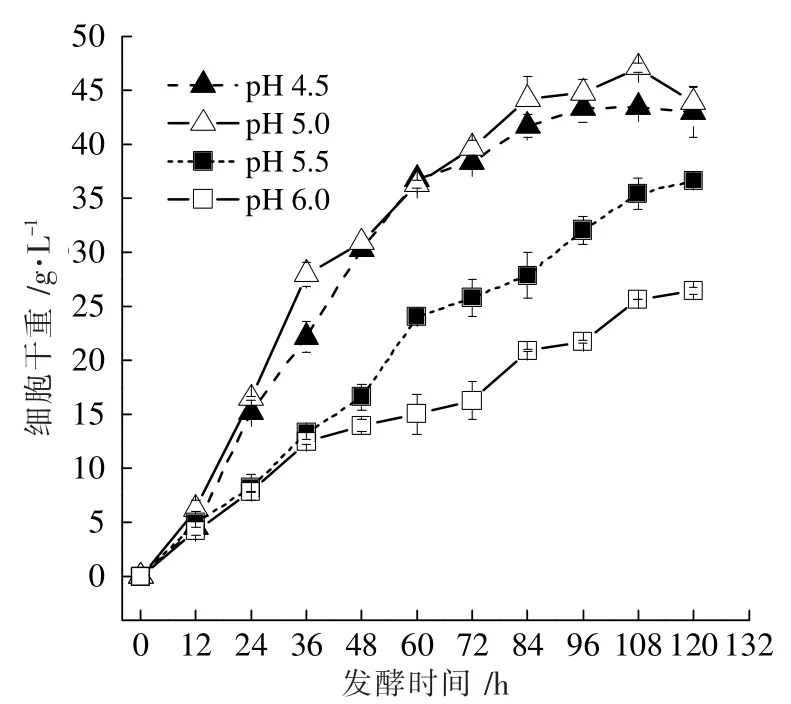
图3 不同恒定pH值条件下球头三型孢菌生长曲线
图2 数据显示,随着发酵体系中pH值的升高,赤藓糖醇的产量不断上升,在发酵120 h 后,pH=4.5、5.0、5.5、6.0 所对应的赤藓糖醇产量分别为31.39、36.02、38.23、46.75 g·L-1,其中pH=6.0 的最终赤藓糖醇产量比pH=4.5提高了48.93%。图3 中的菌体生物量数据表明,在pH值为4.5 和5.0 的条件下,菌体的生长速率要高于pH=5.5、6.0,且在这4 个pH值条件中,最适合球头三型孢菌生长的pH值为5.0。pH=4.5、5.0 条件下,菌体生物量在发酵108 h 后达到最大值,分别为43.44 g·L-1和47.07 g·L-1,而在pH=5.5、6.0 环境下生长的菌体细胞,其最大生物量出现的时间为发酵120 h,分别为36.60、26.44 g·L-1。特别地,在发酵36 h 时,pH=4.5、5.0、5.5 和6.0 的菌体生物量分别为22.18、27.99、13.28、12.46 g·L-1,即此时pH=5.0 的菌体生物量分别为pH=4.5 的1.26 倍、pH=5.5 的2.11 倍、pH=6.0 的2.25 倍。图4 的残糖数据也同样显示,在发酵36 h 后,pH值为5.0 的发酵体系中葡萄糖消耗量最大,其中的葡萄糖浓度已经降至100 g·L-1。总体来看,pH=6.0 的耗糖量在发酵中后期低于其他pH值条件,这可能是由于菌体生物量太低造成的。
大学学习自由度大,学习的自主性和广泛性特点显著。大学要求大学生必须对自身的学习负责,课时数也有所减少。由于中学和大学教育衔接不通畅,大学生入学后容易出现焦虑迷茫期,导致学期动力减退,心理相对脆弱,学习成绩不合格率升高(金国雄等,2003)。大学商务英语课程通常采取班级授课制,班级学生英语水平和英语学习态度不一,而由于他们自主学习能力不足,导致班级授课效果不高,班级分层越来越严重,甚至出现有些学生完全放弃英语学习的情况。即使程度较好的班级,也更多的是由教师来主导课堂,学生被动接受。而这种英语学习方式并无法充分调动学生的主观能动性,提高学生的学习动力。
由于ER 催化赤藓糖醇合成的最后一步,即以NADPH 为辅酶,催化赤藓糖还原为赤藓糖醇,因而被认为是赤藓糖醇合成过程中的关键酶[14-16]。为了更深层次地研究pH值对球头三型孢菌产赤藓糖醇的影响,笔者同时测定了细胞内的ER 酶活,结果如图5所示。
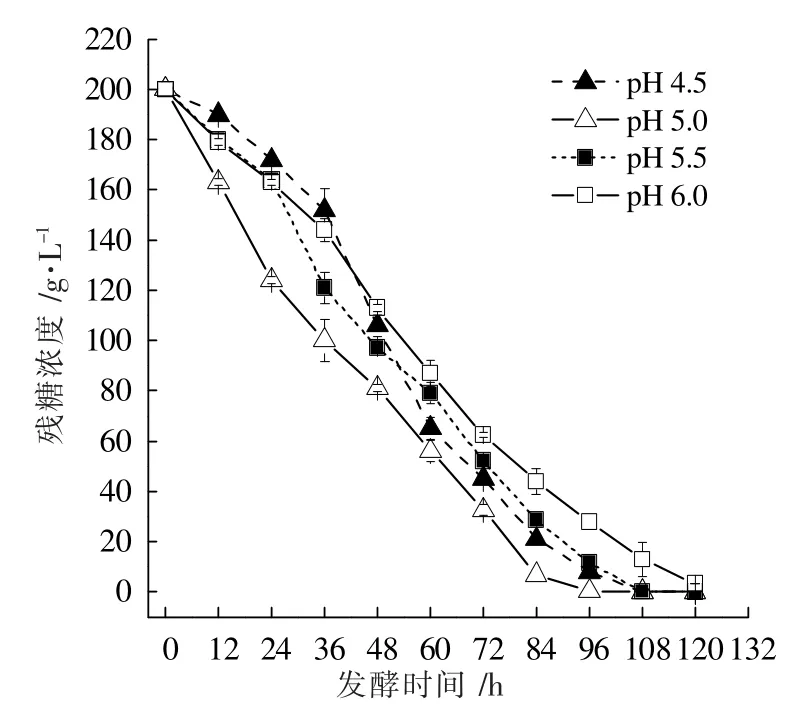
图4 不同恒定pH值条件球头三型孢菌发酵残糖曲线

图5 不同恒定pH值条件球头三型孢菌细胞内ER 酶活变化曲线
图5 中的ER 酶活数据表明,随着pH值的上升,球头三型孢菌细胞内的ER 活性也随之增大。而且,pH=6.0 时的ER 酶活在整个发酵周期内都大幅度地高于其他pH值条件。在发酵72 h 时,pH=6.0 条件下细胞内ER 酶活为0.383 U·mg-1protein,分别为同时刻pH=4.5、5.0、5.5 的3.83 倍、2.70 倍、2.28 倍。因此,在所研究的4 个pH值条件中,保持发酵体系的pH值为6.0 可以在整个发酵周期内大幅度提高ER 的活性,实现赤藓糖醇的高效合成。
为了更简洁直观地分析适合球头三型孢菌发酵生产的pH值条件,笔者对其在不同pH值条件下的最大菌体生物量和比生产速率进行了对比,结果见表1。表1 数据显示,pH=5.0 条件下最大菌体生物量为47.07 g·L-1,是pH=6.0 的1.78 倍,然而赤藓糖醇的比生产速率却是随pH值的上升而增大,尤其在pH=6.0 条件下,赤藓糖醇的比生产速率可以达到0.015 g·(gh)-1,是pH=5.0 的2.14 倍。

表1 不同pH值条件下最大菌体生物量和赤藓糖醇比生产速率对比
综上,pH=5.0 较适合球头三型孢菌生长,pH=6.0 则会大幅度地提升ER 酶活,有利于赤藓糖醇合成。
2.3 球头三型孢菌产赤藓糖醇发酵过程分阶段pH值调控
上述实验结果反映出球头三型孢菌细胞生长和发酵生产赤藓糖醇所需的最适pH值是不同的,因此,为了更进一步地提升赤藓糖醇的产量,有必要对发酵过程的pH值进行分段调控。基于以上分析,笔者提出了一种两阶段pH 调控策略,即在发酵前期(0~36 h)控制pH=5.0,之后控制pH=6.0。发酵结果如图6所示。
72 h 之前,两阶段pH值调控与单一控制pH=5.0 对于葡萄糖的利用速率几乎相同,但72 h 之后,两阶段pH值调控的耗糖量远远低于单一控制pH=5.0,84 h 时pH=5.0的残糖量仅为6.85 g·L-1,而此时两阶段pH值调控的残糖量为22 g·L-1,介于pH=5.0~6.0(残糖量为44 g·L-1)之间,这说明两阶段pH值调控策略增大了发酵体系中葡萄糖的利用效率。采用两阶段pH值调控策略后,经过120 h 的发酵,最终的菌体生物量为47.50 g·L-1,是单一控制pH=6.0的1.80 倍。此外,两阶段pH值调控发酵过程中,ER 的酶活在48 h 达到最大值0.55 U·mg-1protein,比单一pH值控制时的最大酶活 (pH=6.0,0.38 U·mg-1protein) 提高了44.74%。最终发酵产物中赤藓糖醇的产量达到56.78 g·L-1,比单一控制pH值的最大产量(pH=6.0,46.75 g·L-1)提高了21.45%。
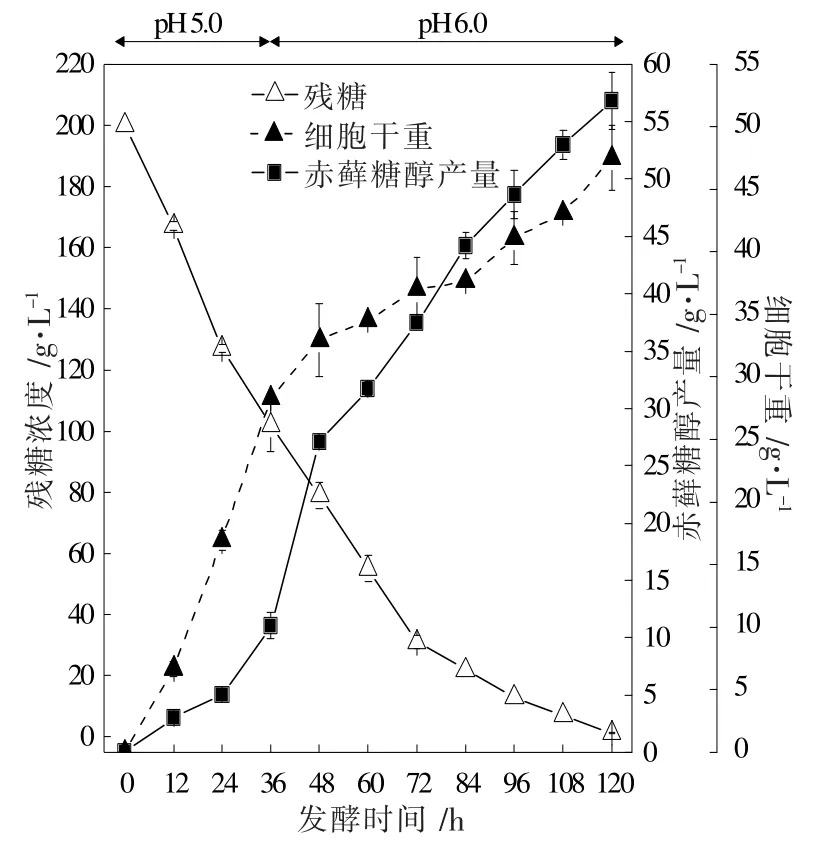
图6 两阶段pH值调控策略下赤藓糖醇合成时间曲线
3 结语
球头三型孢菌发酵过程中菌体生长和产赤藓糖醇的最适pH值不同,经过初步探索,发现pH=5.0 最适合菌体的生长,而pH=6.0 则大幅度提升了ER 的酶活性,更有利于赤藓糖醇的合成。因而提出了一种两阶段pH值调控策略:在发酵前期(0~36 h)控制pH=5.0,之后控制pH=6.0。在此策略下进行发酵,最大ER 酶活比单一pH值控制提高了44.74%。发酵120 h 后,赤藓糖醇产量达到56.78 g·L-1,比单一控制pH值的最大产量(pH=6.0,46.75 g·L-1)提高了21.45%。
