产阿扎霉素F菌株Streptomyces malaysiensis 种子培养条件研究
2019-04-09白亭亭李铭刚施竹凤杨群辉彭荣珍杨明英杨佩文王家银赵黎明
张 庆,白亭亭,李铭刚,施竹凤,杨群辉,彭荣珍,杨明英,杨佩文,王家银,赵黎明
(1.云南省农业科学院农业环境资源研究所,云南 昆明 650205;2.云南大学,云南 昆明 650091;3.云南省农业科学院农业经济与信息研究所,云南 昆明 650205;4.四川省农业科学院,四川 成都 610066)
【研究意义】 阿扎霉素F系列化合物是从云南省宁蒗县土壤样品中分离筛选得到的一株链霉菌所产生的具有独特大环内酯结构的抗生素,该抗生素具有广谱的抗真菌活性,具有开发为新型杀菌剂的潜力[1]。前期试验结果表明,菌种是从自然界中筛选的野生菌株,目标化合物产量较低,难以满足工业化生产的需要。因此,需要通过改进生产菌株的种子质量,创造适合菌体生长的最佳条件,充分发挥菌种的生产潜力,从而实现提高目标化合物发酵产量的目的。【前人研究进展】在微生物发酵生产过程中,通过培养获得质量优良的种子是整个发酵工艺的前提[2-3]。培养基组成(如碳源、氮源、磷酸盐等的种类和浓度)和培养条件(如温度、酸碱度、溶解氧等)是对菌体生长繁殖、产物的生物合成、产品的分离精制乃至产品的质量和产量都能直接或间接地产生影响的重要因素。通过优化培养基组成和培养条件,可实现提高菌株种子质量的目的[4-5]。Plackett-Burman(PB)试验和响应面分析(Response Surface Analysis,RSA)试验是优化培养基组成常用的方法。通过PB试验,可以从多个考察因素中快速有效地筛选出主要因素,是RSA试验的前提[6]。RSA试验则是采用多元二次回归方程的方法,拟合主要考察的各因素与其响应值之间的函数关系,通过对函数响应面和等高线的分析以及试验指标的各因子水平及其交互作用分析,确定各考察因素最优参数的试验方法[7-8]。【本研究的切入点】在菌株ECO-00002工业化发酵生产实践中,菌株种子的优劣直接影响到菌株发酵周期和阿扎霉素F系列化合物的产量。因此,有必要进行种子培养基和培养条件筛选优化研究。【拟解决的关键问题】本研究拟通过菌株种子培养基和培养条件优化,提高菌体生物量,为后续发酵产物的形成打下基础,指导工业化生产。
1 材料与方法
1.1 菌株
云南大学微生物研究所保藏菌种马来西亚链霉菌S.malaysiensisECO-00002。
1.2 培养基
基础培养基[9]:酵母膏4 g,葡萄糖4 g,麦芽膏5 g,复合维生素(维生素B11 mg,维生素B61 mg,核黄素1 mg,烟酸1 mg,苯丙氨酸1 mg,生物素1 mg,丙氨酸0.3 mg),微量盐(FeSO4·7H2O20 mg,MnCl2·2H2O 10 mg,ZnSO4·7H2O 10 mg),琼脂20 g,水1000 mL,pH 7.5,制作平板和试管斜面。液体种子培养基:葡萄糖14.5 g,酵母膏15 g,麦芽膏20 g,CaCO33 g,MgSO4·7H2O 1 g,MnSO4·4H2O 0.1 g,KH2PO40.2 g,水1000 mL,pH7.5。
PB试验培养基和RSM试验种子培养基:采用STATISTICA 6.0进行试验设计,并配制相应培养基,培养基于1×105Pa下灭菌20 min。
1.3 PB和RSA试验方法
采用PB试验设计考察主要的碳氮源成分对种子生长的影响,筛选适宜的碳氮源;在此基础上,采用RSA试验优化适宜碳氮源的比例。具体方法:将供试菌株接种于斜面试管培养基上,然后置于28 ℃恒温条件下培养120 h。再用灭菌蒸馏水洗下菌体,并按照10 % 的接种量接入装有100 mL 种子培养基(PB培养基和RSA培养基)的500 mL 三角瓶中,并于28 ℃、200 r/min的摇床上振荡培养48 h。待培养结束,种子液用滤纸过滤后,于80 ℃烘干至恒重,并称取菌体生物量。
1.4 复合维生素、复合盐和CaCO3的优化试验方法
在确定种子生长适宜碳氮源的基础上,优化种子培养基中的复合维生素(维生素B11 mg/L、维生素B61 mg/L、核黄素1 mg/L、烟酸1 mg/L、苯丙氨酸1 mg/L,生物素1 mg/L,丙氨酸0.3 mg/L)、复合盐(MgSO4·7H2O 1.00 g/L、MnSO4·4H2O 0.10 g/L、KH2PO40.20 g/L)和CaCO3(3.00 g/L)的比例。各因素的比例分别按初始液体种子培养基中的比例设置添加与不添加2个处理,试验方法和测定方法同上。
1.5 培养条件优化试验方法
在培养基筛选优化的基础上,进行起始pH、摇瓶装液量对菌株生长的影响试验。分别设置初始pH为4、5、6、7、8、9等6个梯度和种子瓶装液量为80、100、120、140、160、180 mL/500 mL等6个梯度试验,试验方法和测定方法同上。
1.6 不同培养条件对种子生物量的影响试验和方法
根据培养基筛选优化的试验结果,配制种子培养基,并根据优化的培养条件,进行种子培养,考察优化前后菌株种子生长情况,试验方法和测定方法同上。
2 结果与分析
2.1 PB试验结果与分析
对种子培养基组成中的葡萄糖、酵母膏、麦芽膏、(NH4)2SO4、NaNO3等5个碳氮源因素进行筛选,每个因素设高低2个水平,实验设计与结果如表1~2所示。回归分析表明,葡萄糖、酵母膏以及麦芽膏是主要的影响因素,3者在大于95 %的概率水平上差异显著,其它2个因素(NH4)2SO4和NaNO3在95 %的概率水平上差异不显著,由此确定葡萄糖、酵母膏和麦芽膏为主要因素进行下一步实验。

表1 种子培养基中的碳氮源筛选PB试验设计与结果
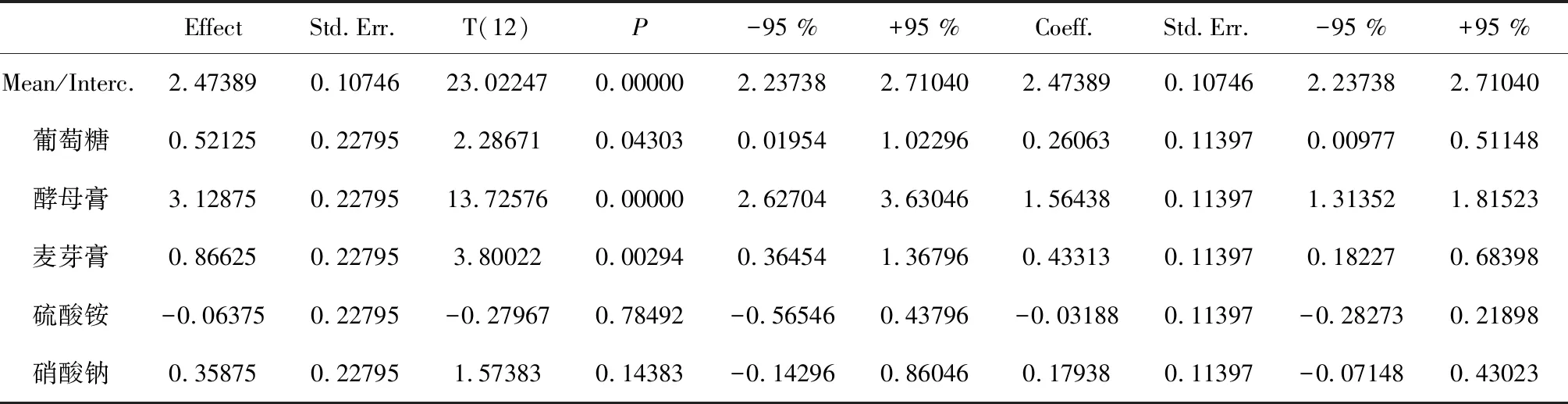
表2 种子培养基中的碳氮源筛选统计分析结果
2.2 RSA试验结果与分析
在PB试验基础上,以麦芽膏2.0 %为比例,对葡萄糖和酵母膏的配比进行优化,结果用STATISTICA 6.0进行统计分析,结果如表3~4和图1所示。各因素之间有一定交互作用,二次方模型与上述结果的拟合较好(模型的R2>0.98)。模型为: mycelia cake=5.43624+0.11894 ×葡萄糖浓度(%)+3.12863×酵母膏浓度(%)-0.91677×葡萄糖浓度(%)2-1.42188×酵母膏浓度(%)2+1.50750×葡萄糖浓度(%)×酵母膏浓度(%),各因素优化的比例:葡萄糖浓度1.45 %,酵母膏浓度1.50 %,麦芽膏2.00 %。
2.3 复合维生素、复合盐和CaCO3的优化试验结果与分析
在PB试验和RSA试验基础上,设置添加与不添加2个处理,考察复合维生素、复合盐和CaCO3对种子生物量的影响,试验结果如表5所示。试验结果表明,复合盐和CaCO3对菌株生物量有较大影响,而复合维生素的影响不明显。种子培养基中可以不加复合维生素,但必须加复合盐和CaCO3。
2.4 培养条件优化试验结果与分析
2.4.1 起始pH对种子生物量的影响 不同起始pH对菌株种子生物量的影响试验结果如表6所示。从表6可以看出,当 pH<5时菌株生长较差,生物量低;当pH为7~8时,菌株生长较好,生物量最高,随着pH持续升高,生物量反而下降。因此,选择种子培养基的初始pH为7.5。

表3 RSA试验设计与结果

表4 RSA试验统计分析结果
2.4.2 装液量对种子生物量的影响 不同种子瓶装液量对菌株生物量的影响试验结果如表7所示。试验结果表明,在80、100、120、140、160、180 mL等6个梯度种子瓶装液量试验中,装液量与菌体生物量呈反比,则随着装液量的增加,菌体生物量逐渐降低。但综合考虑种子瓶的利用效率,500 mL三角瓶装种子培养基的量选择100~120 mL为适宜。

图1 RSA试验确定响应最大值Fig.1 The maximum response value determined by RSA test

项目Item复合维生素Multivitamin复合盐Inorganic salt碳酸钙CaCO3添加Added不添加Not added添加Added不添加Not added添加Added不添加Not added生物量(%)Biomass5.715.866.803.045.363.1148 h pH5.245.135.065.784.935.25

表6 起始pH对菌株种子生物量的影响

表7 种子瓶装液量对菌株种子生物量的影响
2.5 不同培养条件对种子生物量的影响
以初始种子培养条件为对照,考察了优化的培养基和培养条件下菌株种子生长情况,试验结果如表8所示。在优化的培养基和培养条件下,菌株生物量(菌丝体干重)由原来的4.09 g提高到8.91 g,提高率为117.70 %(P<0.01)。
3 讨 论
3.1 培养基成分对种子质量的影响
在微生物发酵工业化生产中,培养生理状态好、生长快、菌体生物量高、延滞期短的优良种子是获得目标化合物高产的先决条件[10-12]。不同培养类型的微生物对营养元素(碳源、氮源、能源、无机盐、生长因子等)的需求不同,需要根据所培养菌种对营养要素和生长条件的需求,进行优化试验,才能获得优良的菌株种子[13-15]。目前种子培养基优化试验常用的方法有单因子试验法、正交试验法和响应面试验法等多种方法。单因子试验法主要确定单一因素对菌株生物量的影响,而不能研究各因素间的交互作用[16]。正交试验法可以同时考察多个因素对菌株生物量的影响,既能同时考察多个因素对菌株生物量的影响,又能研究多个因素之间的交互作用,从而求得因素和响应值之间的回归方程,试验次数少、周期短,是优化种子培养基的一种有效办法[17-19]。陈光义等通过对产环己酰亚胺的菌株种子培养基优化,目标化合物的产量比原始产量提高了10.7 %[9]。刘金国等采用单因素试验和正交试验,对链霉菌702的种子培养基和培养条件进行优化,目标活性化合物的生物效价提高了27.7 %[4]。本试验采用 PB试验法,从葡萄糖、酵母膏、麦芽膏、(NH4)2SO4、NaNO3等5个影响因素中,筛选出具有显著影响的因素为葡萄糖、酵母膏和麦芽膏,进一步通过RSA试验法确定了3 个因素的最优水平,菌株生物量比原始培养条件下提高了117.70 %,优化效果显著,表明PB试验法和RSM试验法相结合,可以快速、有效地从多个因素中,筛选出主要的影响因素,确定其最优值。

表8 不同培养条件对菌株种子生物量的影响(X±SE)
3.2 种子培养条件对种子质量的影响
菌株种子的质量好坏是影响发酵工业化生产水平的重要因素,除营养条件外,种子生长条件也是决定其质量好坏的主要条件[20]。在种子培养过程中,保持菌株生长所需的最适温度,则有利于菌体快速生长,从而可以缩短生长期。而pH值是微生物在一定环境条件下代谢活动的综合指标,每一类微生物都有其最适的和能耐受的pH值范围,它对菌体的生长也有较大影响。同时,良好的氧气供应是好氧微生物生长最重要条件之一,装液量直接决定微生物生长过程中获得溶解氧量的高低。一定的转速下,装液量越少,微生物获得的溶解氧越高,菌株生长越旺盛。培养时间的长短则是影响种子质量和浓度的另一个重要因素,种龄过长或过短,不但会延长发酵周期,而且会降低产量[21-22]。观察供试株菌ECO0002种子生长过程可以发现,随着菌体的生长,生物量不断提高,到40 h时达到最大,之后随着时间的延长,生物量变化不大。表明40 h时,菌株处于对数生长期中后期,作为种子液最为适宜。
4 结 论
阿扎霉素产生菌马来西亚链霉菌ECO-00002种子生长的主要影响碳源为葡萄糖、酵母膏、麦芽膏,各因素的最大响应值为葡萄糖1.45 %,酵母膏1.50 %,麦芽膏2.00 %;无机盐为CaCO33.00 g/L、MgSO4·7H2O 1.00 g/L、MnSO4·4H2O 0.10 g/L、KH2PO40.20 g/L,初始pH 7.50,装液量100 mL/500 mL,培养温度28 ℃,培养时间为200 r/min振荡培养40 h。在优化的种子培养基和培养条件下,菌体生物量由原来的4.09 g提高到8.91 g,提高率为117.70 %,优化效果显著。
