存在营养风险的原发性肝癌患者术前营养支持的效果及对免疫功能的影响
2019-04-08邓照军倪志陈明霞
邓照军 倪志 陈明霞
原发性肝癌(primary liver cancer,PLC)外科手术后,患者肝脏或胆囊部位全部切除将导致体内的分解代谢平衡出现紊乱[1]。术前,大多数患者存在不同程度的营养不良,其中PLC手术患者营养风险的发生率极高。因肝胆系统在营养物质吸收及代谢方面发挥着重要作用,所有肝胆外科患者均呈现不同程度的肠肝循环障碍和胆盐合成障碍,由此影响营养物质的吸收而造成不同程度的营养不良[2]。营养不良不仅降低机体免疫力,且不利于术后伤口愈合,进而增加感染发生率及死亡发生率[3]。本研究旨在探讨存在营养风险的PLC手术患者术前营养支持的必要性及临床效果。
资料与方法
一、临床资料
将我院2017年1月至2018年4月期间治疗的存在营养风险的PLC手术患者138例作为研究对象,所有患者均符合《原发性肝癌诊疗规范(2017年版)》[4]中诊断标准,其纳入标准:(1)给予手术治疗;(2)患者无药物及酒精滥用史;(3)神志清楚并2周内患者未服用抗精神病或抑制抑郁药物治疗;(4)患者及家属知情并签署同意书,且经过我院伦理委员会批准。排除标准:(1)处于昏迷状态的重病患者;(2)伴有糖尿病等内分泌紊乱者。将所纳入的138例患者按照是否给予术前营养支持分为观察组及对照组(均69例),观察组39例男性,30例女性,年龄25~83岁,平均(45.3±18.7)岁,对照组37例男性,女性32例,年龄26~85岁,平均(47.6±19.5)岁,两组患者性别(χ2=0.117,P=0.732)、年龄(t=0.707,P=0.480)比较,差异无统计学意义。
二、方法
治疗方法 对照组术前仅采用常规对照治疗。观察组采取常规治疗联合术前营养支持,营养支持包括肠外营养及肠内营养,每天静脉滴注250~500 mL葡萄糖氨基酸溶液(Baxter Healthcare Ltd.),人血蛋白10 g(上海莱士血液制品股份有限公司),并且为患者补充必须营养物质;将瑞代(德国Fresenius Kabi Deutschland GmbH)作为肠内营养制剂,手术时,将鼻肠管置于空肠内,术后1 d,10%葡萄糖盐水(500 mL,)经鼻肠管注入空肠内,注入速度为80 mL/12 h,术后2 d,将营养液经鼻肠管注入空肠,最初剂量为250 mL/12 h,根据患者病情调整剂量(500~1 000 mL/12 h)。连续给药14 d。
三、观察指标
观察指标 疗效评价,显效:患者症状消失,无其他并发症的发生;有效:症状好转,并发症减少;无效:症状无明显变化,并发症增加或恶化[7]。于手术前后抽取空腹静脉血,检测血清白蛋白(Alb)、前白蛋白(PAB)、血红蛋白(Hb)及免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、CD4+及CD3+水平含量;比较两组术后恢复情况;对两组患者不良反应发生率情况进行比较。对138例PLC患者采用电话随访方式进行随访,观察患者生存情况,截止日期为2018年3月31日。
四、统计学分析

结 果
一、两组患者疗效的比较
术后,观察组患者显效、有效、无效分别为54例(78.26%)、10例(14.49%)、5例(7.24%),明显优于对照组[显效、有效、无效分别为41例(59.42%)、14例(20.29%)14例(20.29%)(u=2.253,P=0.012)],且观察组总有效率为92.8%,明显高于高于对照组79.7%(χ2=4.944,P=0.026)。
二、两组患者手术前后营养状况的比较
术前,两组患者的Alb、PAB与Hb水平比较,差异无统计学意义(P>0.05);术后,两组患者三项指标水平较同组术前明显降低(P<0.05);且术后,观察组的变化幅度低于对照组(P<0.05)。见表1。
三、两组患者术后恢复情况比较
观察组患者术后住院时间、首次排气时间、排便时间、留置胃管时间均明显短于对照组(P<0.05)。
四、两组患者手术前后免疫功能比较
两组患者术前IgA、IgG、CD4+及CD3+比较差异无统计学意义(P>0.05);治疗后,观察组IgA、IgG、CD4+及CD3+分别为(2.8±0.4) g/L、(8.2±0.7) g/L、(30.2±4.1)%、(58.1±5.6)%,均高于对照组(2.0±0.2) g/L、(7.2±0.4) g/L、(27.1±3.5)%、(53.6±5.2)%,(P<0.05)。
五、两组患者不良反应的比较
术后对照组不良反应发生率明显高于观察组(P<0.05)。见表3。
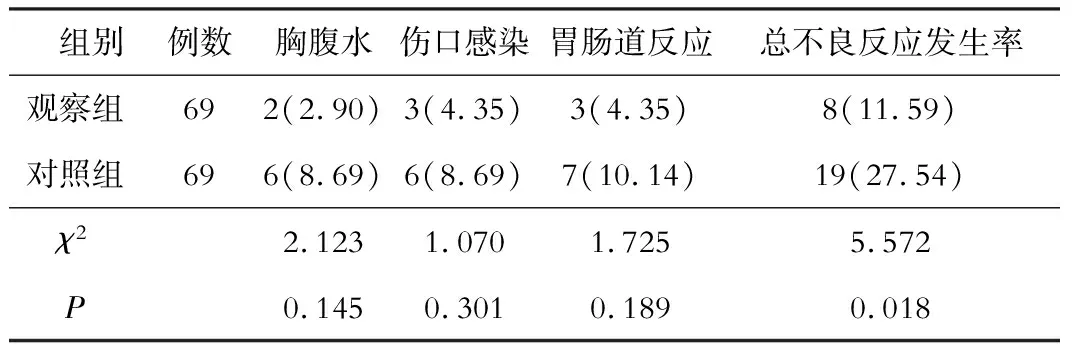
表3 两组患者不良反应的比较[(n)%]
六、影响原发性肝癌患者的生存的因素分析
PLC 患者1年生存率为83.3%(115/138),死亡率为16.7%(23/138),其中接受营养支持的原发性肝癌患者术后1年的生存率为89.85%(62/69),未接受营养支持的原发性肝癌患者术后1年的生存率为76.81%(53/69)。单因素分析显示,营养支持、Child-Pugh分级、肝硬化、肿瘤大小、血管侵犯、TNM分期、淋巴结转移与PLC患者术后生存预后有关;COX回归分析发现,未给予营养支持、Child-Pugh B级、肿瘤直径≥5 cm、TNM III~IV期、存在血管侵犯及淋巴结转移为PLC患者术后生存的独立危险影响因素。
讨 论
大多数肝胆外科PLC手术患者存在一定程度的营养风险,加之手术的影响,将更进一步导致患者营养不良,进而对患者术后的各项指标及功能恢复不利[5]。国外研究表明,PLC手术患者因手术治疗的强烈刺激,进而造成患者机体出现应激反应,并且,患者手术后不能进食,以致于患者机体内代谢功能出现紊乱,机体自身免疫系统备受抑制[6]。因此如何对PLC手术患者加强营养供给,已成为了国内外临床医师关注的重点。相关研究表明,营养支持包括肠内营养及肠外营养的供给,肠内营养主要是通过静脉系统传输营养物质,促使蛋白在肝脏内的加速合成,进而直接给肠道给予营养支持;而肠外营养是给予患者营养药物等支持[7]。对外科肝胆手术患者而言,及时给予营养支持不仅可以给机体补充足够的营养物质,而且还对肠道功能恢复起促进作用,可防止肠道黏膜受到应激性损伤。

表1 两组患者手术前后营养状况(±s)比较

表2 两组患者术后恢复情况比较(±s)
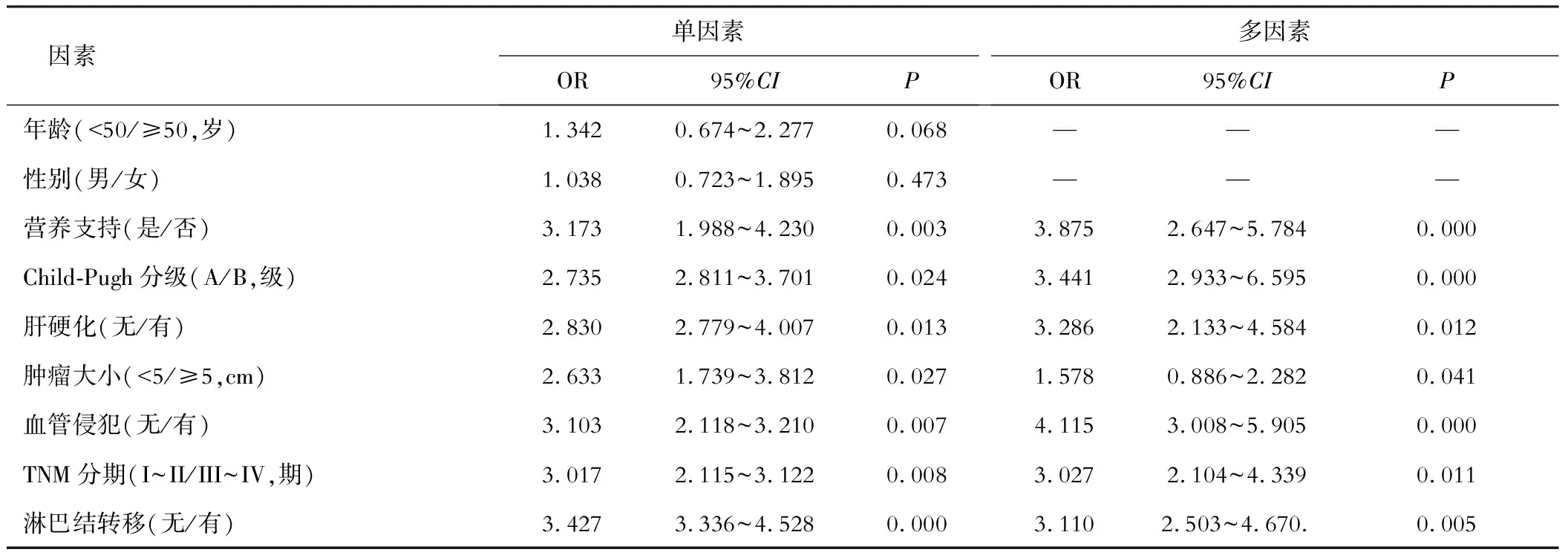
表4 影响患者生存预后的COX回归分析
本研究结论显示,手术治疗后,行术前营养支持患者的ALB、PAB与Hb水平均高于术前未行营养支持的患者,提示,给予营养支持后,有助于存在营养风险的患者储备营养物质,增强机体对应激反应的抵抗能力,改善患者术后营养状况;观察组患者术后免疫功能降低程度低于对照组,表明,术前给予营养支持能够抑制免疫球蛋白的分解,帮助患者术后免疫功能的恢复[8]。此外,本研究中观察组患者的首次排气、排便、住院和留置胃管时间均遭遇对照组,提示,术前给予营养支持能缩短患者住院时间,加快患者恢复。在给予营养支持过程中,医务人员严格加强管理,给药速度过快时,可能引起恶心呕吐、胸腹水及胃肠道反应等副作用,一旦出现此类现象,即可减少营养支持补及量,同时减缓给药速度,另外,为了防止感染,用于固定肠鼻管的胶布需每12 h更换一次。且已有报道指出,应用术前营养支持的患者测定生化指标显示无营养不良发生,而未进行营养支持的患者血清白蛋白、前白蛋白、血红蛋白均显著降低,以致于造成患者营养不良,实施营养支持过程中,应遵循从少到多、由稀到浓及由慢到快的原则进行,以此保证肠道的适应[9]。本研究中营养支持组患者的不良反应率低于未行营养支持的患者,且其总有效率高于未行营养支持患者,提示,术前营养支持对术后恢复的必要性,表明术前给予营养支持的安全性较高且都有助于患者手术的成功,随访发现,术前给予营养支持患者术后1年生存率高于未行营养支持患者,表明营养支持对患者预后具有改善作用,分离患者临床病例资料发现术前未给予营养支持、Child-Pugh B级、肿瘤直径≥5 cm、TNM Ⅲ~Ⅳ期、存在血管侵犯及淋巴结转移为PLC患者术后生存预后的独立影响因素。
综上所述,给予PLC手术患者术前营养支持,不仅可以增强临床效果,促进肠道功能恢复,提高机体免疫能力,而且降低不良反应发生率,改善患者预后。