三赞胶降解菌的筛选鉴定及降解产物的抗氧化活性分析
2019-04-08程斌李晓雁潘奕臣冯雪黄海东通信作者
程斌,李晓雁,潘奕臣,冯雪,黄海东,通信作者
三赞胶降解菌的筛选鉴定及降解产物的抗氧化活性分析
程斌1,李晓雁2,潘奕臣1,冯雪1,黄海东1,通信作者
(1. 天津农学院 农学与资源环境学院,天津 300384;2. 天津农学院 食品科学与生物工程学院,天津 300384)
筛选得到3株三赞胶降解菌,可在以三赞胶为唯一碳源的培养基平板上产生降解圈,多项分类鉴定结果表明,降解菌JD05和JD08分别为荧光假单胞菌和巨大芽胞杆菌,降解菌SZJ01为烟曲霉。3株降解菌协同作用,37 ℃处理72 h,三赞胶溶液粘度下降79.6%,多糖分子量降低为2个不同分子量分布的组分,重均分子量分别为1.9×104Da和3.7×103Da,经生物降解处理后,三赞胶多糖降解产物的抗氧化活性提高,清除羟自由基和超氧阴离子的IC50分别为3.8 mg/mL和2.6 mg/mL。
三赞胶;多糖;降解菌;分子量;抗氧化活性
鞘氨醇单胞菌属的菌株能合成多种微生物多糖产物[1-2],例如结冷胶(gellan gum,S-60)、温轮胶(welan gum,S-130)、鼠李胶(rhamsangum,S-194)、定优胶(diutan gum,S-657)等,这些多糖主链结构相对保守,为-X-葡萄糖-葡萄糖醛酸-葡萄糖-X-,X是鼠李糖或甘露糖,但侧链基团种类和连接方式各有不同,使每种多糖产物具有各自独特的物理学性能[3]。三赞胶(Sanxan)又称为鞘氨醇胶Ss,是鞘氨醇单胞菌属菌株合成的一个新多糖品种,其合成菌三赞鞘氨醇单胞菌()是鞘氨醇单胞菌属的新种[4]。三赞胶多糖由葡萄糖、葡萄糖醛酸、甘露糖和鼠李糖组成,其主链结构为-4-β-D-Man- 1-4-β-D-GlcA-1-3-α-L-Rha-1-3-β-D-Glc,三赞胶具有增稠和假塑性能,其溶液加热冷却后,能形成螺旋缠绕结构的弹性凝胶,具有耐酸耐高温性能[5-6],近期已通过专家评审委员会的技术审查,作为增稠剂、稳定剂和凝固剂用于食品领域[7]。
三赞胶是由4种不同单糖分子组成的杂多糖,分子量在106Da以上,具有螺旋缠绕的二级结构,稳定性好,对淀粉酶、纤维素酶、酸碱等具有抗性[8]。这种稳定性在产物应用时的抗温抗酸碱方面具有明显优势,但也存在一些弊端,例如这类高分子聚合物在环境中大量释放后,难以降解从而造成环境污染。而且,高分子量的多糖分子活性功能基团被包裹在分子内部,难以进入生物体细胞内,抗氧化等生物学活性较低。对多糖进行降解可以提高其抗氧化活性,得到的寡糖产品具有抑菌、抗病毒、提高免疫力等功能,可以提高产品的应用价值[9]。国内外对微生物多糖的生物降解进行了大量研究,特别是黄原胶的降解[10-12],但是关于三赞胶生物降解的研究还未见报道。
本研究分离得到3株具有协同降解效果的菌株JD05、JD08和SZJ01,对降解菌进行了多相分类鉴定,并研究了三赞胶生物降解产物的抗氧化活性。
1 材料与方法
1.1 菌种
三赞胶合成菌由本实验室保藏,菌株JD05、JD08和SZJ01为本研究筛选并保藏。
1.2 材料与试剂
邻二氮菲、Tris-HCl、邻苯三酚、铁氰化钾、三氯乙酸、FeCl3等均为分析纯;窄分布葡聚糖分子量标准品购自中国计量科学研究院;细菌基因组 DNA 提取试剂盒、DNA 琼脂糖凝胶回收试剂盒、质粒提取试剂盒、普通DNA产物纯化试剂盒、pGM-T克隆试剂盒均购自天根公司;真菌基因组 DNA 提取试剂盒购自天津兰瑞公司;PCR 主要试剂购自润泰公司。
1.3 培养基
三赞胶降解菌富集培养基(g/L):三赞胶10,酵母粉0.2。
三赞胶降解菌筛选培养基(g/L):三赞胶10,酵母粉0.2,琼脂15。
R2A培养基(g/L):葡萄糖0.5,蛋白胨0.5,酵母粉0.5,可溶性淀粉0.5,酸水解酪素0.5,磷酸氢二钾0.3,丙酮酸钠0.3,硫酸镁0.05,琼脂15,pH 7.2±0.2。
但这并没有阻止人们拯救洛丽塔的决心,人们拥向海洋馆,手里拿着一面自制的旗帜,呼吁游客抵制观看洛丽塔的表演,“它已经很累了,难道我们要为满足自己欲望让它无休止地演出吗?”
改良马丁培养基(g/L):葡萄糖20,蛋白胨5,酵母粉2,磷酸氢二钾1,硫酸镁0.5,琼脂15,pH 6.4±0.2。
1.4 试验方法
1.4.1 三赞胶的制备
按照文献[13]的方法进行菌株的发酵和三赞胶的制备。
1.4.2 三赞胶降解菌的富集
取天津市纪庄子污水处理厂曝气池活性污泥,加入100 mL三赞胶降解菌富集培养基中,28、32和37 ℃,200 r/min条件下摇床培养7 d;选择降解效果较好的培养温度,在此温度下,取降解液按10%的接种量再次转接到三赞胶降解菌富集培养基中,200 r/min摇床培养5 d,反复传代富集三赞胶降解菌,直至5 d内溶液粘度降至6 r/min条件下300 mPa·s以下,以此时的降解液作为下一步筛选菌种的样品。
1.4.3 三赞胶降解菌的筛选与分离纯化
用1 mL三赞胶降解液,使用无菌水倍比稀释后,取100 μL涂布于三赞胶筛选培养基平板上,37 ℃培养,挑取有明显降解圈的菌落,将降解菌中的细菌和霉菌分别划线接种于R2A和改良马丁平板培养基上,选择单菌落进行分离纯化,再转接于三赞胶筛选培养基上进行验证。
按参考文献[14]中的方法进行菌种的形态学观察,氧化酶活性、过氧化氢酶活性、硝酸盐还原、葡萄糖氧化发酵、产H2S、淀粉水解、甲基红试验等生理生化特征测定。
1.4.5 降解菌的分子鉴定与系统进化分析
提取菌株的基因组DNA,细菌16S rDNA的PCR扩增引物为27 F(5'-GAGAGTTTGATCCTG GCTCAG-3')和1 541 R(5'-TACGGCTACCTTG TTACGACTT-3')[10],真菌ITS序列的PCR扩增引物为ITS1(5'-CTTGGTCATTTAGAGGAAGT AA-3')和ITS4(5'-TCCTCCGCTTATTGATAT GC-3'),nLSU的PCR扩增引物为LROR(5'-AC CCGCTGAACTTAAGC-3')和LR7(5'-TACTACC ACCAAGA TCT-3'),SSU的PCR扩增引物为NS1(5'-GTAG TCATATGCTTGTCTC -3')和NS8(5'-TCCGCA GGTTCACCTACGGA-3')。扩增得到目的基因片断后,琼脂糖凝胶电泳检测,用DNA产物纯化试剂盒将PCR产物进行纯化,与pGM-T载体连接后,转化至TOP10感受态细胞中,在含 IPTG和X-Gal的LB平板上37 ℃过夜培养,挑取白色单菌落,验证并送北京奥科鼎盛公司测序。将得到的16S rDNA、ITS、nLSU和SSU测序结果与GenBank中核酸数据进行BLAST比对,得到与降解菌株序列同源性最高的序列,使用软件ClustalX 1.8对得到的核苷酸序列进行分析,得到序列间的相似值。利用软件 MEGA 6.0计算出序列的系统进化距离,采用邻位相连法构建系统进化树[15]。
1.4.6 三赞胶和降解液的粘度检测
取100 mL样品溶液,利用Brookfield R/S Plus旋转流变仪,选择cc40转子,在25 ℃下测定样品溶液在6 r/min剪切速率下的粘度。
1.4.7 降解处理后多糖产物的分离纯化
取100 mL 经降解处理后的三赞胶溶液,稀释10倍后,90 ℃加热30 min,冷却后1 3000 r/min离心30 min后弃沉淀,反复离心4~6次,直至上清液镜检无菌体细胞,Sevag法除蛋白后,加入5倍体积的无水乙醇沉淀多糖,放入截留分子量3 500的透析袋中,去离子水透析48 h,冷冻干燥备用。
1.4.8 样品的分子量测定
将冻干后的多糖样品重新用ddH2O溶解,用岛津LC-20A凝胶渗透色谱仪分析多糖样品的重均分子量、数均分子量和分子量分布指数(Polydispersity index,PDI),用葡聚糖分子量标准品进行校准,色谱柱为Agilent PL aquagel-OH MIXED 8μm column,示差折光检测器;流动相使用ddH2O,流速1.0 mL/min,柱温36 ℃,进样体积20 μL。
1.4.9 三赞胶降解物的单糖组成分析
称取5 mg多糖样品,加入2 mol/L三氟乙酸1.5 mL,120 ℃水解4 h,水解后的样品置于旋转蒸发仪中干燥,完全蒸干后加入3 mL甲醇40 ℃旋蒸干燥,重复3次。加入1 mL超纯水溶解,按照文献[16]的方法进行PMP柱前衍生化。PMP衍生化的水解样品和葡萄糖、葡萄糖醛酸、甘露糖、鼠李糖标准品按下述方法进行HPLC分析:色谱柱为Unitary C18(250 mm×4.6 mm×5 μm),流动相为乙腈和0.05 mol/L pH 6.8的磷酸缓冲液(∶=18∶82),流速1.0 mL/min,柱温40 ℃,紫外检测波长为250 nm,进样量为20 μL。
1.4.10 抗氧化活性的测定
样品羟自由基清除率、超氧阴离子清除率和还原力的测定按照文献[8]的方法进行。
2 结果与分析
2.1 三赞胶降解菌的筛选与降解效果
将活性污泥样品加入三赞胶降解菌富集培养基中,不同温度富集培养7 d,结果表明在37 ℃培养10 d后粘度下降。将发生降解的样液转接,反复传代富集三赞胶降解菌群,得到的降解液在37 ℃,200 r/min摇床培养5 d,可以将样液的粘度由2 780 mPa·s降至145 mPa·s(图1)。
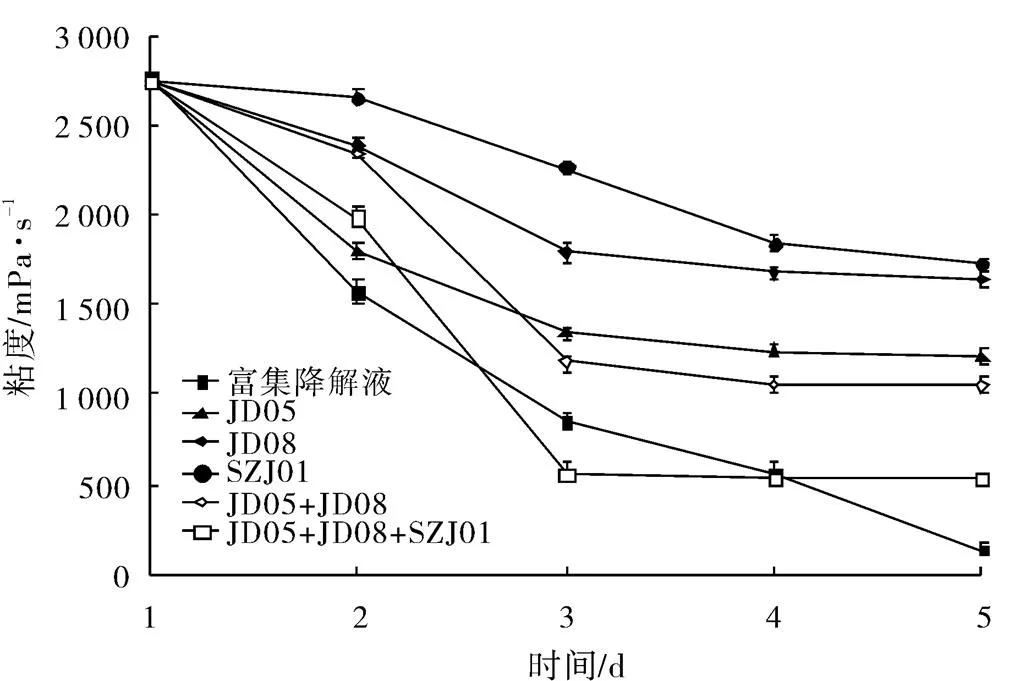
图1 不同菌株对三赞胶的降解效果
将富集到的降解液稀释涂布三赞胶筛选培养基平板,得到的菌株SZJ01可以产生明显的降解圈,JD05和JD08协同作用也可以产生降解圈(图2、图3)。将菌株JD05、JD08和SZJ01分别在R2A和改良马丁培养基中进行摇床培养,制成107CFU/mL的菌液,以10%的接种量接入三赞胶降解培养基中,37 ℃、200 r/min摇床培养3 d后,溶液粘度分别下降51.3%、35.0%和17.9%;将3种菌株的发酵液混合后,相同条件下,三赞胶溶液的粘度下降79.6%,说明3种株菌对三赞胶溶液具有明显的协同降解作用。但继续延长处理时间,混合菌5 d处理后,仍无法将三赞胶完全降解。
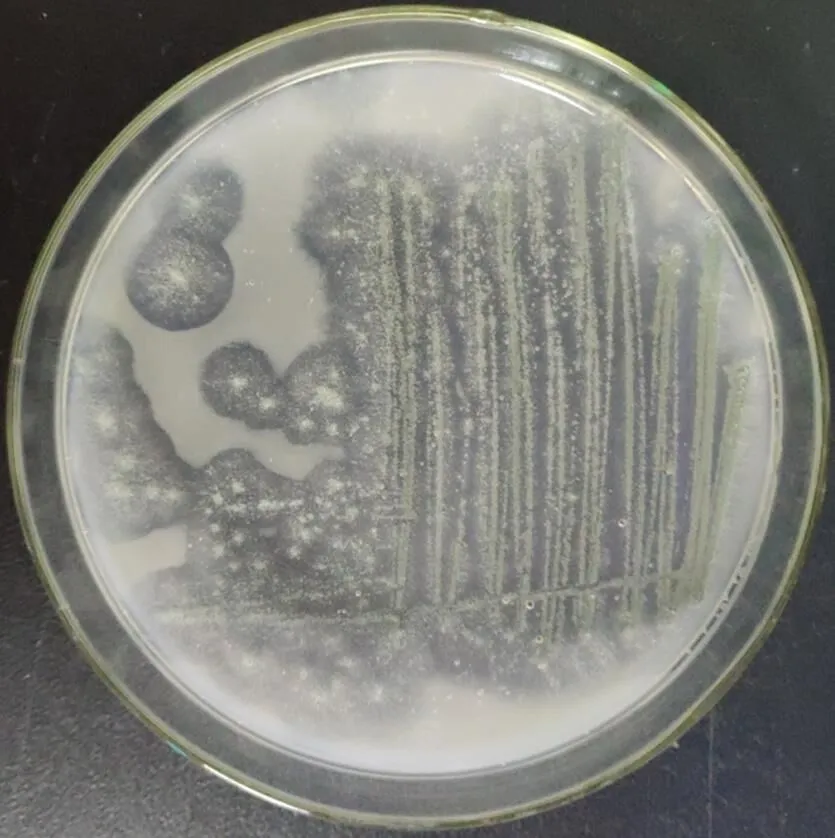
图2 菌株SZJ01的三赞胶降解圈
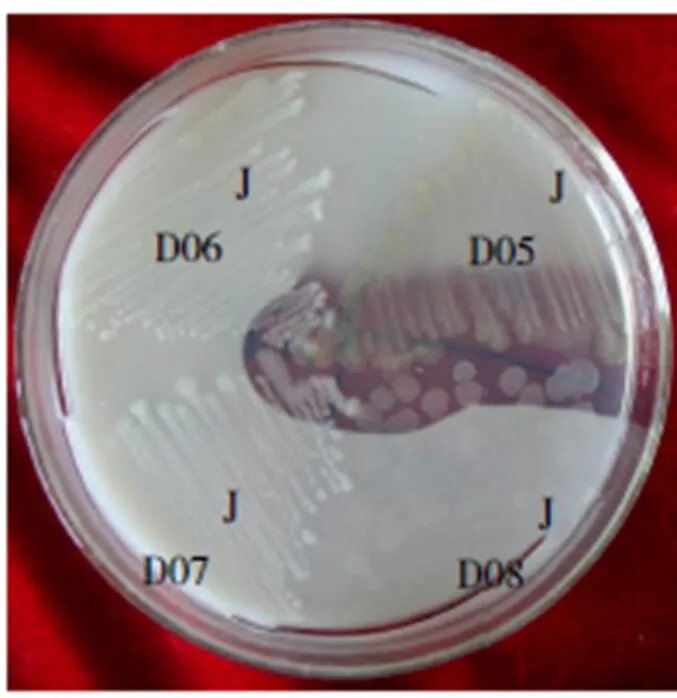
图3 菌株JD05和JD08的三赞胶降解圈
2.2 三赞胶降解菌的鉴定
菌株JD05在R2A平板上的菌落为黄绿色,革兰氏阴性,杆状,细胞大小(0.5~0.7)μm×(1.3~1.9)μm,氧化酶、接触酶、脲酶、柠檬酸盐利用和明胶水解呈阳性,硝酸盐还原,H2S产生,吲哚产生,甲基红试验和V-P试验呈阴性。测序得到长度为1 522 bp菌株JD05的16S rDNA序列,在GenBank中的序列登记号为MK240500,经BLAST比对和MEGA 6.0软件构建系统进化树(图4),结果表明JD05属于假单胞菌属(),与AE1的同源性为99.5%。综合形态学、生理生化和分子鉴定结构,确定菌株JD05为荧光假单胞菌。
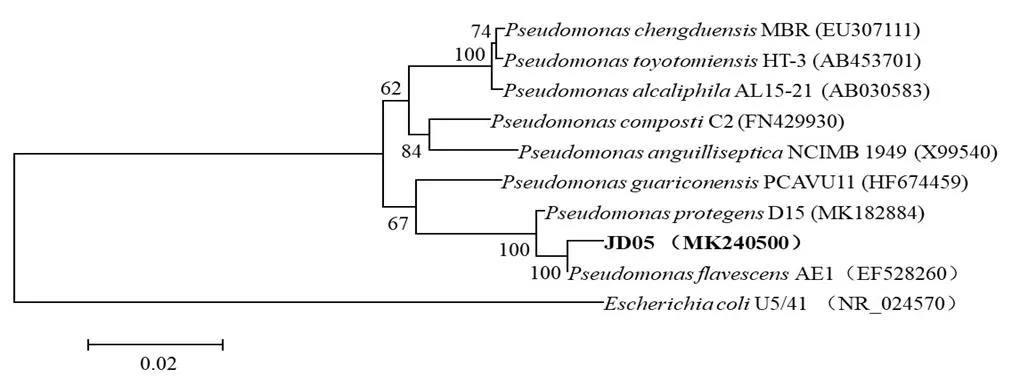
图4 菌株JD05的16S rDNA序列系统进化树
菌株JD08在R2A平板上的菌落为白色,革兰氏阳性,杆状,细胞(1.2~1.5)μm×(2.8~3.6)μm,中生芽孢,氧化酶、接触酶、脲酶、明胶水解、硝酸盐还原和V-P试验呈阳性,H2S产生,吲哚产生,甲基红试验和柠檬酸盐利用呈阴性。菌株JD08的16S rDNA序列长度为1 449 bp,在GenBank中的序列登记号为MK240499,进行BLAST比对和系统进化分析(图5),结果表明JD08属于芽孢杆菌属(),与DSM 32的同源性为98.9%。综合多种分类鉴定结果,确定菌株JD08为巨大芽孢杆菌。

图5 菌株JD08的16S rDNA序列系统进化树
菌株SZJ01在改良马丁培养基上形成的菌落表面绒毛状,灰白色菌丝上有墨绿色孢子,菌丝的顶端膨大形成球形孢囊,孢囊表面可辐射生出一层孢子梗,分生孢子为球形,直径(1.2~1.4)μm。菌株SZJ01的ITS、LSU和SSU序列长度分别为613、1 304和1 676 bp,在GenBank中的序列登记号分别为MK240371,MK240373和MK240374。基于ITS、LSU和SSU序列的系统进化树表明,菌株SZJ01属于曲霉属(),与在同一个分支簇(图6),根据BLAST比对,菌株SZJ01的ITS、LSU和SSU序列与的同源性分别为99.6%、100.0%和99.8%,结合形态学指标鉴定,确定其为烟曲霉。

图6 菌株SZJ01基于ITS、LSU和SSU序列的系统进化树
2.3 三赞胶的降解产物分析
用葡聚糖分子量标准品校准的多糖分子量计算回归方程为:Log()=11.061-0.736t,为重均分子量,t为保留时间(min),相关系数为0.998 7。凝胶渗透色谱检测表明,三赞胶的重均分子量为5.4×106Da,聚合物分散指数(PDI,Polymer dispersity index)为1.18。经富集降解菌处理,三赞胶被完全降解,未分离纯化到多糖组分。菌株JD05、JD08和SZJ01处理后的三赞胶样品,多糖分子量分布变宽,没有明显的多糖主峰。3株降解菌联合降解三赞胶溶液3 d后,可分离得到2个多糖组分,分子量分别为1.9×104和3.7×103(图7)。经PMP衍生和HPLC检测,在降解液中可检测到葡萄糖、葡萄糖醛酸和鼠李糖,用三氟乙酸水解多糖样品,进而分析其单糖组成,发现经3种降解菌协同作用后,三赞胶由葡萄糖、葡萄糖醛酸和甘露糖组成,鼠李糖组分完全降解。
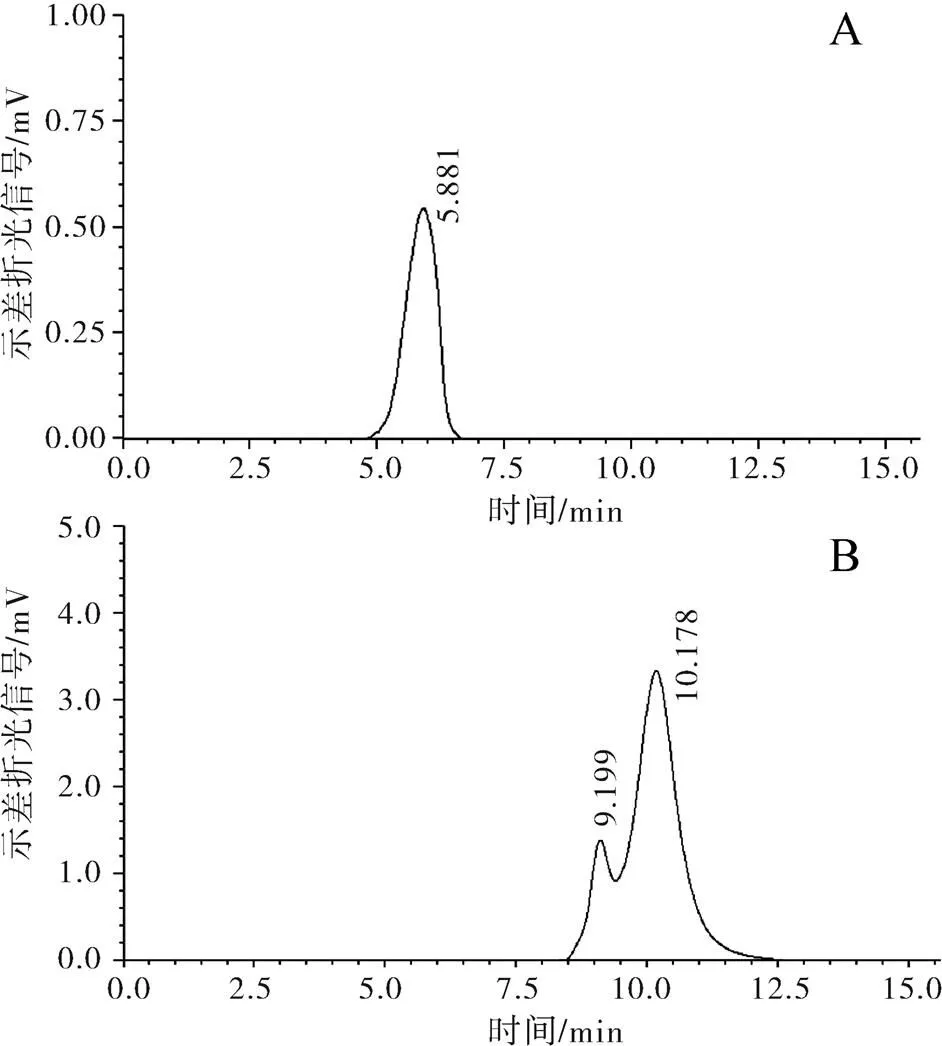
图7 三赞胶及降解物的凝胶渗透色谱
注:A为三赞胶多糖;B为3株降解菌联合降解后的三赞胶多糖
为验证3株降解菌产生水解酶对三赞胶的降解作用,在三赞胶发酵液中分别加入降解菌的上清液,透射电子显微镜观察降解菌水解酶对三赞胶的影响。从图8A可以看出,三赞胶合成菌在发酵过程中向胞外分泌纤毛状多糖,但并不从细胞上脱离,说明三赞胶是一种典型的胞壁多糖,菌株JD05产生的水解酶可以将三赞胶从细胞上分离下来(图8B),视野中能看到脱落的多糖分子(图8C)。而另外2株降解菌,未观察到其对三赞胶合成过程的影响,推测菌株JD05产生的水解酶可能对三赞胶多糖有解聚作用,或可以影响多糖的高级结构,但由于三赞胶是一种高分子杂多糖,结构复杂,分子量大,靠单一降解菌的水解酶无法彻底将其降解。

图8 降解菌对三赞胶合成影响的透射电镜观察(×7 000)
注:A为三赞胶合成菌;B为JD05上清液处理后的三赞胶合成菌;C为脱落的三赞胶多糖
2.4 三赞胶降解产物的抗氧化活性分析
将三赞胶和经降解菌处理的多糖样品纯化,进行抗氧化活性测定,结果如图9所示,可以看出经生物降解处理的样品,三项抗氧化活性指标均高于对照的三赞胶多糖,且随多糖分子量的降低,样品的抗氧化活性提高,经菌株JD05、JD08和SZJ01处理后的多糖样品还原力最高,A700达到0.693;对羟自由基和超氧阴离子的清除率分别达到67.6%和73.5%。三赞胶清除羟自由基的IC50为17.7 mg/mL,清除超氧阴离子的IC50为13.6 mg/mL;经3种菌协同降解后,三赞胶的抗氧化活性明显提高,清除羟自由基和超氧阴离子的IC50分别为3.8和2.6 mg/mL。
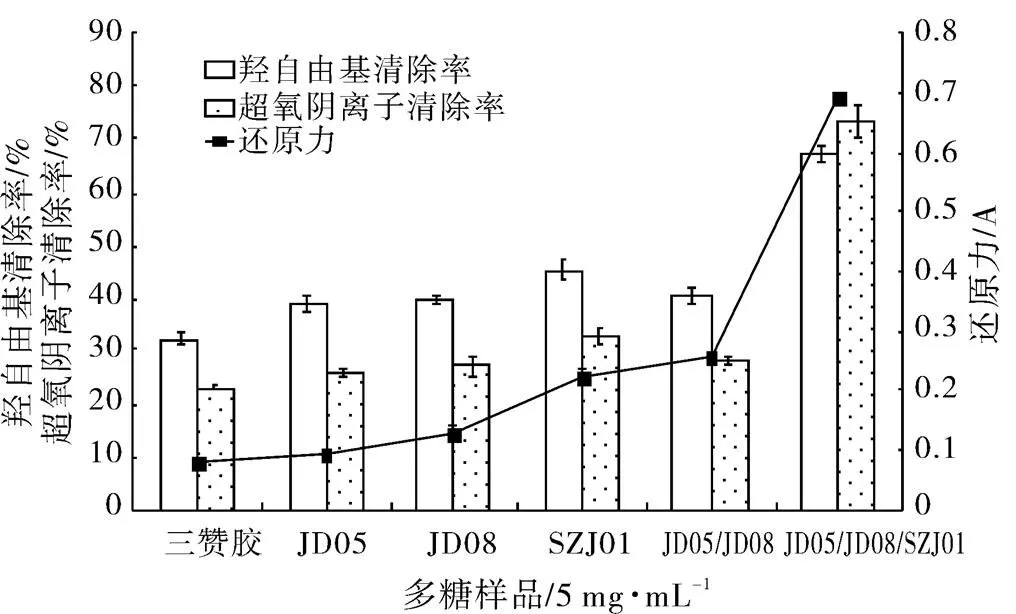
图9 三赞胶及生物降解后多糖的抗氧化活性
3 结论
本文富集得到可以将三赞胶完全降解的混合菌群,从而解决了三赞胶环境释放后的环保问题,实现了高分子多糖推广应用“进可攻,退可守”的要求[17]。分离筛选到3株在以三赞胶为唯一碳源的平板上生长的降解菌JD05、JD08和SZJ01,多相分类鉴定结果表明其分别为荧光假单胞菌、巨大芽胞杆菌和烟曲霉。3株降解菌协同作用,可将三赞胶溶液的粘度降低79.6%,同时三赞胶多糖的重均分子量由5.4×106Da降低为1.9×104Da和3.7×103Da。随着分子量的降低,三赞胶多糖降解产物的抗氧化活性明显提高,本研究为拓展三赞胶多糖的应用范围提供了数据支持。
[1] Fialho A,Moreira L,Granja A,et al. Occurrence,production,and applications of gellan:current state and perspectives[J]. Appl Microbiol Biotechnol,2008,79:889-900.
[2] 黄海东,刘云,刘如林. 合成生物聚合物的重要微生物资源-鞘氨醇单胞菌[J]. 微生物学报,2009,49(5):561-567.
[3] García M C,Alfaro M C,Muñoz J. Rheology of sheared gels based on low acyl-gellan gum[J]. Food Sci Technol Int,2016,22(4):325-332.
[4] Haidong H,Wei W,Ting M,et al.sp. nov.,isolated from soil[J]. Int J Syst Evol Microbiol,2009,59(4):719-723.
[5] Haidong H,Mengmeng W,Hongpeng Y,et al. Structural and physical proterties of sanxan polysaccharide from Sphingomonas sanxanigenens[J]. Carbohyd Polym,2016,144:410-418.
[6] 张爱琳,黄海东,张亚运,等. 几种食品添加剂对鞘氨醇胶Ss凝胶特性的影响[J]. 天津农学院学报,2016,23(2):36-40.
[7] 文雯. 5种食品添加剂新品种公开征求意见涉及三赞胶、聚甘油蓖麻醇酸酯等[EB/OL]. (2018-12-18)[2019-04-01]. http://info.foodmate.net/reading/show-5699. html.
[8] 李晓雁,黄海东,李军. 三赞胶的降解及抗氧化活性的研究[J]. 食品工业科技,2013,34(20):99-101.
[9] 钟思恩,刘杨,曹纯洁,等. 三种多糖降解复合物体外抑制HeLa细胞的增殖作用[J]. 现代食品科技,2018, 34(10):72-80.
[10] 许超,熊亚茹,卢明倩,等. 一株具有褐藻胶降解能力的海洋细菌的筛选鉴定及其多糖利用能力研究[J]. 生物技术通报,2017,33(4):198-204.
[11] 孙涛,熊小英,魏颖隽,等. 黄原胶降解及其抗氧化性能研究[J]. 天然产物研究与开发,2012,24(1):102-104.
[12] 杨杰,单岩,张庆,等. 黄原胶降解酶酶学性质的初步研究[J]. 食品科技,2010,35(4):25-29.
[13] 黄海东,王薇,马挺,等. 鞘氨醇单胞菌TP-3合成新型生物聚合物Ss的发酵条件优化[J]. 微生物学通报,2009,36(2):155-159.
[14] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[15] Tamura K,Stecher G,Peterson D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol,2013,30:2725-2729.
[16] 符梦凡,赵一帆,阎卫东. 柱前衍生化HPLC法分析枸杞多糖中单糖组成[J]. 食品科学,2018,39(18):186-191.
[17] 江丽丽,张庆,徐世艾. 黄原胶降解的研究进展[J]. 微生物学通报,2008,35(8):1292-1296.
Screening, identification of sanxan-degrading microorganisms and antioxidant activities of degradation product
CHENG Bin1, LI Xiao-yan2, PAN Yi-chen1, FENG Xue1, HUANG Hai-dong1,Corresponding Author
(1. College of Agronomy & Resources and Environment, Tianjin Agricultural University, Tianjin 300384, China; 2. College of Food Science and Bioengineering, Tianjin Agricultural University, Tianjin 300384, China)
Sanxan-degrading strains were screened, which formed degrading band on medium plate with sanxan as the only carbon source. On the basis of polyphasic taxonomic study, strain JD05, JD08 and SZJ01 were considered to be,and. Treated by the mixture fermentation liquid of these three strains with the temperature of 37 ℃ and 72 h, the viscosity of sanxan solution decreased by 79.6%. The molecular weight of polysaccharide was reduced to two components with different molecular weight distributions, with 1.9×104Da and 3.7×103Da, respectively. The antioxidant activity of sanxan degradation product increased, with the IC50of scavenging hydroxyl free radical 3.8 mg/mL and the IC50of scavenging superoxide anion 2.6 mg/mL, respectively.
sanxan; polysaccharide; degrading microorganisms; molecularweight; antioxidant activity
1008-5394(2019)04-0043-06
10.19640/j.cnki.jtau.2019.04.009
Q939.97
A
2019-04-03
国家级大学生创新创业训练计划项目(201810061001);天津市大学生创新创业训练计划项目(201910061068);国家自然科学基金(31571790)
程斌(1997-),男,本科在读,研究方向:生物技术。E-mail:153900910@qq.com。
黄海东(1972-),男,教授,博士,研究方向:资源与应用微生物学。E-mail:hdhuang@tjau.edu.cn。
责任编辑:张爱婷
