常规超声及甲状腺球蛋白检测诊断甲状腺滤泡癌的价值
2019-04-08瞿嫣慧刘亦伦
瞿嫣慧,王 燕,李 艺,吴 琼,刘亦伦
上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233
甲状腺滤泡癌(follicular thyroid carcinoma,FTC)是发病率仅次于甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的原发性甲状腺恶性肿瘤,占所有甲状腺恶性肿瘤的10%~15%,近年来呈增多趋势[1]。但其与甲状腺腺瘤(thyroid adenoma,TA)超声表现类似,术前常被误诊为TA。由于缺乏特征性的细胞核特征,术前细胞学检查及术中冷冻均难以将两者区别,往往需要术后组织学检查发现包膜或局部血管浸润才可诊断。超声检查是目前临床评估甲状腺结节的重要手段,尤其是在诊断PTC方面,但关于FTC的报道较少。因此,本研究通过研究FTC与TA的临床特征及术前超声声像图,探讨能否通过临床特征及超声声像图特征鉴别两者。
1 资料和方法
1.1 研究对象
收集2013年7月—2017年6月于上海交通大学附属第六人民医院行超声检查并经手术后病理学检查证实的55例FTC患者,共56个结节。选取同期经手术后病理学检查证实为TA的患者,排除纯囊性变者,选取78例共88个结节作为对照。
1.2 仪器与方法
在术前1周内检测患者血清甲状腺激素及相关抗体水平,包括游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离四碘甲状腺原氨酸(free tetraiodothyronine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺球蛋白(thyroglobulin,Tg)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)及甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)。
超声检查仪器包括SIEMENS Acuson S2000、ESAOTE Mylab 90、PHILIPS IU Elite和HITACHI HI Vision 900等,采用线阵探头,频率为8~15 MHz。对甲状腺进行全面扫查,若有多个病灶,以最大或最可疑病灶为观察对象。
在二维声像图上观察结节的大小(以最大径表示)、位置(左叶、右叶、峡部)、内部回声(极低回声、低回声、等回声、高回声)、回声均一性(回声均匀、回声不均匀)、结节囊性变(无囊性变、存在囊性变)、形态(规则、不规则)、边界(清晰、不清)、声晕(无晕环、有规则细晕、有厚薄不均的晕)和钙化(无钙化、微钙化、粗大钙化、环形钙化)情况。
用彩色多普勒血流显像观察结节内部及周边血流分布情况,采用Frates等[2]的分类方法进行描述:0型,无血流;1型,少许内部血流且无周边环状血流;2型,周边环状血流但无或少许内部血流;3型,周边环状血流及中等内部血流;4型,内部血流丰富伴或不伴周边环状血流。
采用频谱多普勒超声观察频谱形态特征,并测量结节内部的收缩期峰值流速(peak systolic velocity,PSV)、舒张末期流速(end diastolic velocity,EDV)及阻力指数(resistance index,RI)。由1名超声科医师在不提供病理学检查结果的情况下对所有患者的超声声像图进行回顾性分析。
1.3 统计学处理
采用IBM SPSS 20.0进行统计学分析。使用Kolmogorov-Smirnov(K-S)检验评估患者年龄以及FT3、FT4、TSH、Tg、TPOAb及TgAb水平是否符合正态分布,如符合以x±s表示,采用独立样本t检验进行分析;如不符合,则以中位数表示,采用非参数Mann-Whitney秩和检验进行分析。两组间性别及其余声像图特征的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
55例FTC患者中男性14例、女性41例,78例TA患者中男性10例、女性68例,两组患者比较差异无统计学意义(P=0.062)。K-S检验发现患者年龄符合正态分布,FTC患者平均年龄为(49.4±15.4)岁,TA患者平均年龄为(50.4±12.7)岁,两组间差异无统计学意义(P=0.685)。
55例FTC中,1例为双侧病灶,其余54例为单发病灶;3例(5.5%)伴有PTC,2例(3.6%)为滤泡型乳头状癌,7例(12.7%)伴有结节性甲状腺肿,1例(1.8%)伴有亚急性甲状腺炎,8例(14.5%)伴有桥本甲状腺炎。诊断时,有4例(7.3%)出现肺转移,4例(7.3%)出现骨转移,其中3例(5.5%)既有肺转移又有骨转移。56个FTC结节包括2例嗜酸细胞性滤泡癌;4个为广泛浸润型(7.1%),其余52个(92.9%)为微浸润型。
78例TA中,15例(19.2%)为多发病灶,其中10例(12.8%)为双叶多发病灶,68例(87.2%)为单发病灶;24例(30.8%)伴有PTC,其中1例(1.3%)为滤泡型乳头状癌,28例(35.9%)伴有结节性甲状腺肿,11例(14.1%)伴有桥本甲状腺炎。88个TA结节包括1个(1.1%)嗜酸细胞性腺瘤和13个(14.8%)非典型腺瘤。
2.2 术前血清甲状腺激素及相关抗体水平
两组术前血清FT3、FT4水平见表1,差异无统计学意义(P=0.586、P=0.219)。两组术前血清TSH、Tg、TPOAb和TgAb水平见表1,Tg水平差异有统计学意义(P=0.002),但TSH、TgAb和TPOAb水平差异无统计学意义(P=0.078、P=0.058、P=0.105)。
FTC患者中位术前血清Tg水平为138.70 ng/mL,高于TA组的46.08 ng/mL。勾画受试者工作特征(receiver operating characteristic,ROC)曲线(图1),曲线下面积(area under curve,AUC)为0.67,最佳阈值为98.38 ng/mL,此时灵敏度为57.4%,特异度为70.8%,阳性预测值为66.3%,阴性预测值为62.4%,准确率为64.1%。
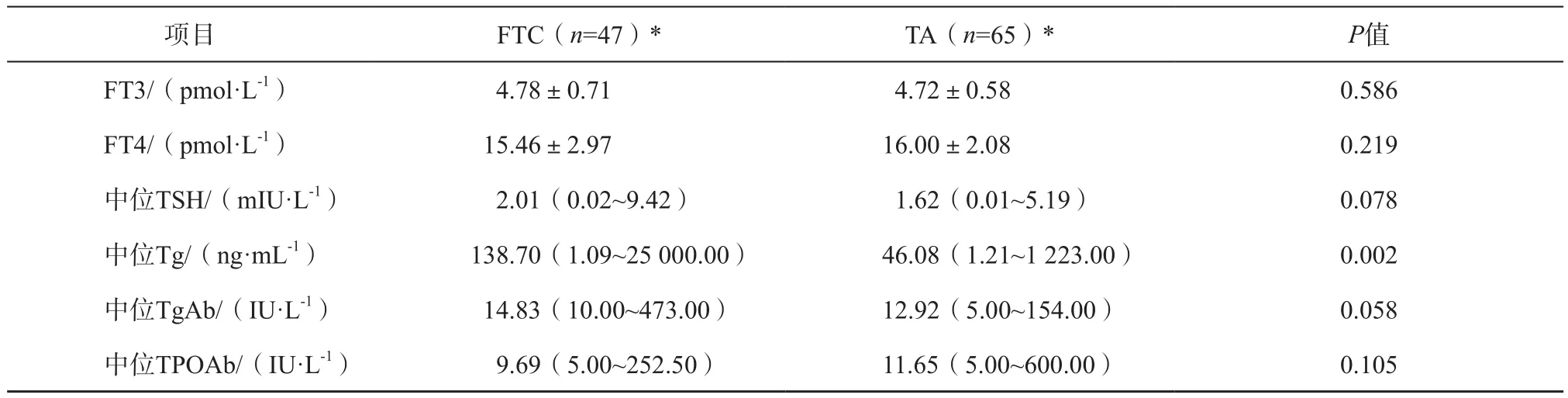
表 1 FTC与TA的血清甲状腺激素及相关抗体水平
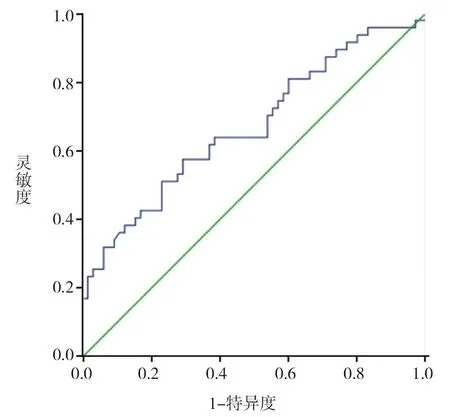
图 1 Tg的ROC曲线
2.3 超声声像图特征
FTC与TA的超声声像图特征比较见表2。FTC结节最大径为8~70 mm,平均最大径为(34.13±15.46)mm,TA结节最大径为3~68 mm,平均最大径为(27.79±14.59)mm,两组间差异有统计学意义(P=0.014)。勾画ROC曲线(图2),AUC为0.613,最佳阈值为30.50 mm,灵敏度为60.7%,特异度为61.4%,阳性预测值为61.1%,阴性预测值为61.0%,准确率为61.1%。
FTC与TA在回声均一性(P=0.000)、囊实性(P=0.025)、晕环(P=0.000)、钙化(P=0.047)方面差异有统计学意义;在回声水平、位置、形态、边界、血流分布、PSV、EDV及RI方面差异无统计学意义(P>0.05,图3~4)。

表 2 FTC与TA的超声声像图特征

图 2 结节最大径的ROC曲线
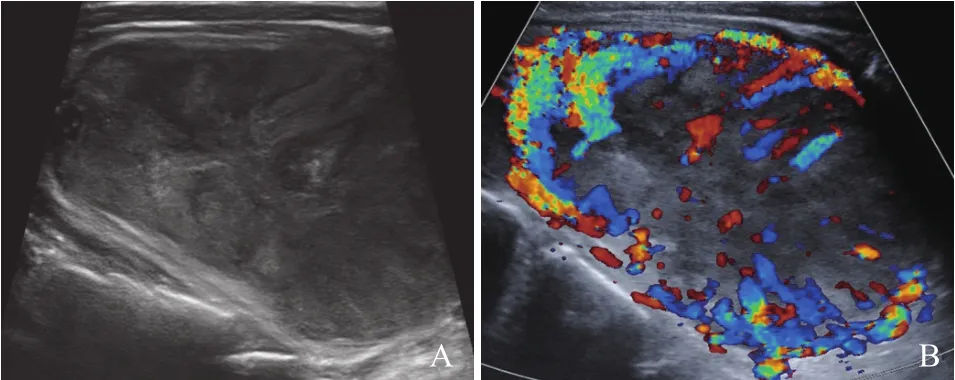
图 3 1例FTC(广泛浸润型)伴肺转移及骨转移患者超声声像图

图 4 1例TA患者超声声像图
3 讨 论
FTC是甲状腺滤泡上皮来源的一种恶性肿瘤,发病率仅次于PTC,占所有甲状腺恶性肿瘤的10%~15%。它是一种无乳头状癌细胞核特征的、有滤泡分化的、存在包膜或局部血管浸润的肿瘤[3]。TA是一类有滤泡分化、包膜完整且无脉管浸润的甲状腺良性肿瘤[3]。由于缺乏典型的细胞核特征,细胞学检查难以鉴别FTC与TA,需依靠组织学标本中发现包膜或局部血管浸润或周围组织浸润和(或)发生转移区分。目前,鉴别FTC与TA是临床面临的一个难题。
本研究分析了FTC与TA的临床特征及超声声像图表现,结果显示FTC与TA虽然存在相似之处,但FTC的血清Tg水平常显著升高,且结节更大,多呈实性,内部回声不均匀,存在钙化,周围晕环消失或有厚薄不均的晕环。
Tg是由甲状腺滤泡上皮细胞合成,储存于甲状腺滤泡腔中的一种大分子糖蛋白,正常情况下只有极微量的Tg进入血液循环,多用于甲状腺滤泡上皮来源的分化型肿瘤术后观察131I疗效及监测肿瘤复发和转移[4-5]。本研究中,FTC组术前血清中位Tg水平高于TA组(138.70 ng/mL vs 46.08 ng/mL),差异有统计学意义(P=0.002),与Lee等[6]和Besic等[7]的结论一致。这可能是由于FTC生长较快,失去正常的滤泡结构,且呈侵袭性生长,可侵犯包膜血管或存在包膜浸润,导致Tg大量进入血液循环。本研究中Tg的最佳阈值为98.38 ng/mL,在既往报道的80~400 ng/mL范围内[6-9]。本研究中19例(24.4%)TA患者术前Tg水平高于98.38 ng/mL,这可能与其结节出现囊性变,存在滤泡破坏有关。此外,本研究中有2例FTC患者术前Tg水平>25 000 ng/mL,且均存在肺及骨转移,提示术前Tg水平显著升高可能与肿瘤转移有关。
关于结节大小对鉴别FTC的意义,目前尚存争议。Sillery等[10]研究发现FTC体积明显大于TA体积;也有学者[11-13]认为结节大小无法鉴别FTC良恶性,但结节>4 cm是术后远处转移的危险因素[12]。本研究中FTC平均最大径为(34.13±15.46)mm,大于FA的(27.79±14.59)mm,差异有统计学意义(P=0.014),且结节最大径的最佳阈值为30.50 mm。
本研究中,FTC内部回声多欠均匀(83.9%),TA内部回声多较均匀(51.1%),与既往研究结果一致[11]。原因可能是FTC中既有滤泡增生,也存在细胞成分丰富的实体性增殖,导致其声反射强度不同。
存在囊性变被认为是TA的特征性表现。本研究中大多数FTC以实性为主(67.9%),而TA以囊实性多见(51.1%),与既往研究结论一致[10-11,14]。这可能是因为FTC细胞增殖迅速,无TA中可见的自身溶解和退行性变。
众所周知,微钙化对诊断甲状腺恶性肿瘤尤其是PTC有较高的特异度,但其诊断FTC的价值目前尚存在争议。有学者认为FTC中无砂粒体,因而FTC中多无微钙化[15],但也有学者发现钙化是FTC的独立危险因素[11,13-14,16]。本研究中,FTC伴钙化的比例(41.1%)高于TA(20.5%),多呈粗大钙化,可能需要进一步扩大样本量以研究钙化鉴别FTC的价值。
晕环指甲状腺结节周围的低回声带。本研究中,FTC周围晕环消失或有厚薄不均晕环,而TA周围可见规则细晕,与既往研究结果一致[10,11,13,16]。原因可能是FTC中癌细胞反复突破包膜,而后被纤维组织覆盖,致其局部包膜不规则增厚,超声上表现为局部晕环增厚。
本研究中,FTC与TA均呈低回声或等回声、形态规则、边界清晰的结节,两组间回声水平、形态及边界差异无统计学意义,这与两者的组织学结构类似有关。两组间血流分布及PSV、EDV、RI差异无统计学意义。既往有研究认为,彩色多普勒超声对FTC有诊断价值,FTC结节内部更常见丰富或不规则血流,而TA结节多表现为周边血流而内部血流较少[13],也有部分学者认为两者间血供差异无统计学意义[10,16]。本研究为回顾性分析,彩色多普勒血流信息受不同仪器及操作者经验的影响较大,需要进行前瞻性研究以验证结节内血流鉴别FTC的价值。
本研究尚存在不足之处。首先,为回顾性研究,仅能通过留存的静态图像及报告描述对结节进行评估,无法动态观察结节整体情况,可能缺少结节部分信息。其次,未考虑TgAb、甲状腺手术史或药物对血清Tg水平的影响。
综上所述,本研究通过比较FTC与TA患者的临床特征及超声声像图特征,发现相比TA,FTC患者术前血清Tg水平更高,结节更大,内部回声不均匀,多呈实性,内部存在钙化,周围无晕环或有厚薄不均晕环。因此,甲状腺超声检查发现无囊性变、内部回声不均匀的大结节,周边无或有厚薄不均的晕环,内部可见钙化,且伴血清Tg水平升高,应警惕FTC的可能。
