补充维生素D3协同第二代抗组胺药物治疗慢性自发性荨麻疹的临床疗效观察和作用机制研究
2019-04-04宋玉杰雷铁池
易 红 宋玉杰 江 珊 史 赢 万 静 雷铁池
近60%~70%的慢性自发性荨麻疹(chronic spontaneous urticaria,CSU)很难找到确切致敏原因[1]。第二代抗组胺药是治疗CSU的主要药物。然而,一些CSU患者对单一抗组胺药物治疗反应较差,停药后皮疹再发[2]。近年来发现约91.3%的CSU患者存在VD3不足甚至缺乏[3]。本研究比较CSU患者补充VD3后对抗组胺药物治疗反应性的变化,旨在探讨VD3在CSU发病中的作用以及协同治疗CSU的临床意义。
1 材料与方法
1.1 一般资料 90例CSU和21例CIndU患者均来自2017年10月至2018年10月武汉大学人民医院皮肤科门诊,另招募55名健康自愿者(均排除自身免疫性疾病和过敏性疾病等)作为健康对照组。三组人群性别和年龄构成比基本相似。CSU患者的入选标准及排除标准参照文献[3,4]。本研究经武汉大学人民医院医学伦理委员会批准,入组前所有受试者均签署知情同意书。
1.2 主要试剂和仪器 Ficoll淋巴细胞分离液(天津市灏洋生物制品科技有限公司),植物血凝素(PHA)、1α,25-(OH)2D3(美国Sigma公司),胎牛血清、青霉素-链霉素溶液(上海碧云天生物技术研究所),CCK-8试剂盒(广州奕元生物科技有限公司),RPMI 1640培养基、Trizol、RT-PCR试剂盒(美国Invitrogen公司),实时荧光定量PCR试剂盒(大连Takara公司),CFX connect荧光实时定量PCR仪(美国Bio-Rad公司)。
1.3 分组与VD3补充治疗 入组时所有入组患者和健康对照组进行血清25-(OH)D3、D-dimer、FDP、ESR水平测定。入组患者填写关于UAS7评分的量表。依据文献报道[5], 25-(OH)D3<10 ng/mL被认定为严重缺乏,10~20 ng/mL为缺乏,20~30 ng/mL为不足,≥30 ng/mL为正常。UAS7总分为42分,0~14分为轻度,15~28分为中度,29~42分为重度[6]。
将VD3严重缺乏及缺乏的CSU患者随机分为对照组和治疗组,对照组仅用一种第二代抗组胺药,治疗组除第二代抗组胺药外补充VD3。VD3严重缺乏组的治疗组每天补充2400 IU VD3,6周后复测VD3并调整用量,再治疗6周,而VD3缺乏组的治疗组每天补充800 IU VD3,6周后减为400 IU维持治疗6周。所有患者均在6和12周复诊,进行UAS7评分,并监测不良反应的发生。治疗中如发现有25-(OH)D3>100 ng/mL,血钙>2.52 mmol/L,停止补充VD3。
1.4 CCK-8法检测PBMC增殖率 PBMC分离后,以(1~2)×106/mL浓度接种于96孔板中,加入不同浓度的PHA(终浓度分别为1、3、10、30、100 μg/mL)及空白组(培养基),于37 ℃,5% CO2,饱和湿度培养箱培养69 h,每孔加入CCK-8 20 μL后继续培养3 h,在酶标仪450 nm处测定吸光值(OD)。细胞增殖率(%)=(OD处理组-OD对照组)/OD对照组×100%。
1.5 PBMC分离与体外培养 抽取15例CSU及15名健康自愿者静脉血10 mL,用Ficoll密度梯度离心法分离PBMC。1α,25-(OH)2D3溶解于DMSO。根据预实验结果和参照文献[7],选用对细胞增殖无影响的两个浓度(1 nM和10 nM 1α,25-(OH)2D3)处理体外培养的PBMC。将CSU患者PBMC分为3组,分别加入含10 μg/mL PHA(含等体积的DMSO),10 μg/mL PHA +1 nM 1α,25-(OH)2D3和10 μg/mL PHA +10 nM 1α,25-(OH)2D3的RPMI 1640培养基,于37 ℃,5% CO2,饱和湿度培养箱培养72 h。离心后收获细胞用于细胞总RNA抽提。
1.6 qPCR检测PBMC IL-6和VDR mRNA水平 用Trizol法抽提PBMC总RNA。取1.5 μg总RNA进行逆转录,逆转录反应体系为20 μL,反应条件:37℃ 10 min,37℃ 50 min,70℃ 15 min,4℃维持。引物序列:人IL-6,正义,5-TCAGCCCTGAGAAAGGAGACAT-3;反义,5-GCTCTGGCTTGTTCCTCACTACT-3;人VDR,正义,5-CAAGGACAACCGACGCCA-3;反义,5-TCCCTCCACCATCATTCACAC-3;内参GAPDH,正义,5-GGTCGGAGTCAACGGATTTG-3;反义,5-GGAAGATGGTGATGGGATTTC-3。实时荧光定量PCR反应体系为20 μL,反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火40 s,70℃延伸30 s,扩增40个循环。熔解曲线的反应条件为:95℃ 15 s,60℃ 1 min,95℃ 15 s。
1.7 其他检测方法 血浆D-dimer、FDP(免疫比浊法),ESR(快速血沉法),血清25-(OH)D3水平(超高效液相色谱-串联质谱法)等均由本院临床检验中心完成。自体血清皮肤试验(ASST)和自体血浆皮肤试验(APST)参照本实验室以前报道的方法[8]。

2 结果
2.1 受试者血清25-(OH)D3水平, 3个炎性指标和荨麻疹严重程度UAS7评分之间相关分析 与健康对照组相比,血清25-(OH)D3水平测定结果显示90例CSU患者(U=1189,P<0.0001)和21例CIndU患者(U=357.0,P<0.05)均呈明显降低,但3个炎症指标(D-dimer、FDP、ESR)仅在CSU组中均增高明显,见表1。在CSU患者中,25-(OH)D3严重缺乏者占 31%(28/90),缺乏者56%(50/90);在CIndU患者中,严重缺乏者占14%(3/21),缺乏为57%(12/21);55名健康对照中,严重缺乏者仅占4%(2/55),缺乏为35%(19/55)。我们的数据还显示3个炎症指标(D-dimer、FDP、ESR)与UAS7呈正相关,结果提示部分CSU患者可能存在VD3严重缺乏和全身性炎症。
2.2 CSU患者与健康对照组IL-6 mRNA和VDR mRNA表达水平比较 15例CSU患者中,IL-6 mRNA表达水平有7例患者明显高于健康自愿者,1例明显低于健康志愿者,7例无明显差异;VDR mRNA表达水平有13例患者较健康自愿者明显增加,2例无明显差异,见表2。体外培养PBMC试验显示随着VD3处理浓度增加,IL-6 mRNA表达水平减低,而VDR表达水平增加(图1)。结果提示VD3能抑制淋巴细胞释放促炎因子IL-6,增加VDR表达。
2.3 补充与未补充VD3的CSU患者荨麻疹严重程度UAS7评分变化 14例VD3严重缺乏的CSU患者与未补充对照组比较,在治疗后12周UAS7评分明显下降(P<0.0001)(图2)。而25例VD3缺乏的CSU患者与未补充对照组治疗后6、12周UAS7评分均下降不明显(P>0.05)。

表1 慢性自发性荨麻疹、慢性可诱导性荨麻疹及健康对照组25-(OH)D3、D-二聚体(D-dimer)、纤维蛋白降解产物(FDP)、ESR的检测结果[M(P25,P75)]
注:a:与健康对照组比较P<0.0001;b:与健康对照组比较P<0.01;c:与健康对照组比较P<0.05
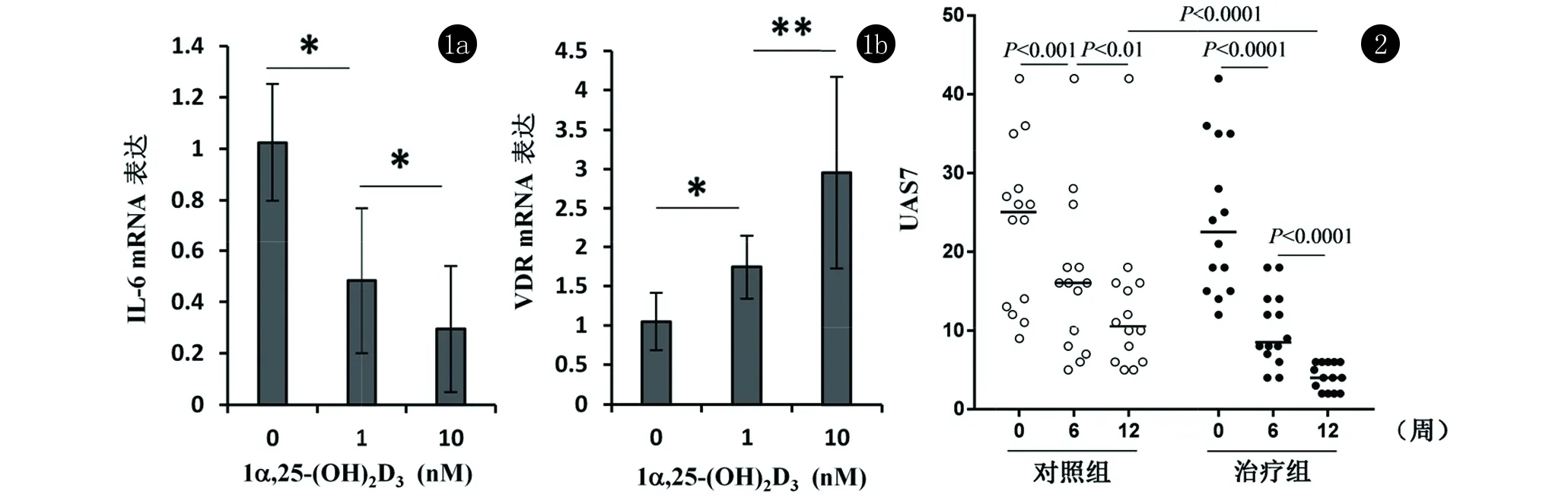
图1 不同浓度的1α,25-(OH)2D3处理后CSU患者PBMC IL-6(a)、VDR mRNA(b)表达(注:*:P<0.05,**:P<0.01)
图2 VD3严重缺乏组治疗效果的比较

表2 慢性自发性荨麻疹及健康对照组IL-6 mRNA和VDR mRNA表达[M(P25,P75)]
3 讨论
表皮基底层和棘层角质形成细胞中的7-脱氢胆固醇经UVB介导的光化学作用合成内源性VD3是人体VD3来源的主要途径[9]。然而,过度皮肤防晒、户外运动减少、肥胖等可能是内源性VD3合成不足的主要原因[10,11]。本研究结果显示31% CSU,14% CIndU和4%正常人血清VD3水平呈严重缺乏,且荨麻疹严重程度UAS7评分与3个炎症指标(D-dimer、FDP、ESR)呈正相关。本研究还发现CSU患者中65%为女性,女性患者VD3水平明显低于男性。Woo等[12]报道UAS7评分与血清VD3水平呈负相关,他们还观察到10例VD严重缺乏的急性荨麻疹患者有5例最后发展成为CSU。以上高度提示VD3严重缺乏可能是CSU疾病发生发展的风险因素之一。
有研究显示CSU患者可能存在一种低水平或亚临床的全身性炎症反应[13]。VD3通过上调MKP-1途径来抑制单核细胞或巨噬细胞中p38的活化以及IL-6和TNF-α的表达,发挥一定的抗炎作用[14]。我们用qPCR技术测定15例CSU外周血分离PBMC的IL-6和VDR mRNA表达水平,与正常人PBMC进行比较,结果发现CSU患者的IL-6和VDR mRNA均高于健康对照组,体外PBMC的1α,25-(OH)2D3处理组与未处理组比较,IL-6 mRNA表达减低而VDR mRNA增加。这一结果也支持了我们的假设,VD3在CSU治疗中可能存在一定的抗炎作用。越来越多的研究证实经VD与细胞核内VDR结合后可能通过以下机制发挥抗炎、抗过敏作用:①VD可以刺激肥大细胞VDR表达,阻止了Lyn与FcεRI的β链以及MyD88的结合,抑制IgE介导的肥大细胞活化,维持肥大细胞膜的稳定[15];②VDR与MKP-1基因上游的VDRE结合,可能影响MKP-1转录,上调MKP-1的表达[14];③除1,25-(OH)2D3外,体内可能还存在有与VDR结合尚未识别的分子,发挥抗炎活性[16]。
通过对CSU患者进行荨麻疹严重程度UAS7评分发现,VD3缺乏组与严重缺乏组的患者分别补充小剂量和大剂量的VD3,并与单用抗组胺药组比较,在补充治疗后第12周,VD3严重缺乏组UAS7评分较对照组显著下降,同时测定血清VD3水平均较补充前明显增加。VD3缺乏组UAS7评分与对照组比较无统计学意义,提示这组患者可能还存在有其他致病因素如亚临床炎症和凝血功能紊乱等[13]。
综上,血清VD3水平缺乏甚至严重缺乏是CSU病情发生发展的风险因素之一。VD3通过与核内VDR结合,抑制促炎因子如IL-6的释放。补充VD3有助于控制CSU,尤其是VD3严重缺乏患者的临床症状。我们还发现CSU患者PBMC的VDR表达水平较正常人明显增高,推测可能是一种VD3配体不足所致的代偿性增加,其分子机制有待进一步检查。
