龙血竭总黄酮对Kv1.3通道的调节作用
2019-04-04尹世金张丰邹艳王少兵石书娟龙思如何回香黎莉
尹世金,张丰,邹艳,王少兵,石书娟,龙思如,何回香,黎莉
(1 中南民族大学 药学院,武汉430074;2 武汉大学 医学院,武汉430071)
机体正常的免疫反应能有效抵御外界病原微生物的侵扰,而当机体免疫功能紊乱出现自身免疫抗原时,机体免疫系统会产生自身抗体,通过破坏自身脏器组织引发多种自身免疫性疾病(AID).研究发现AID如类风湿性关节炎[1]、系统性红斑狼疮[2]、I型糖尿病[3]等患者体内效应记忆性T淋巴细胞(TEM)异常激活与增殖,激活的TEM细胞膜上电压门控性钾通道Kv1.3表达水平显著上升,提示Kv1.3通道在AID发生中扮演了重要角色.而药理学阻断Kv1.3通道[1]或对其进行基因敲除[4],均能对自身免疫性模型动物产生良好的防治作用,揭示Kv1.3通道是开发治疗AID先导药物的新靶点[5].
中草药为挖掘生物活性物质提供了丰富资源,研究发现龙血竭能够同时抑制经典免疫反应和补体替代免疫反应[6],抑制T细胞的异常激活与增殖,表现为较强的免疫抑制作用,这一作用与其浓度依赖性阻断哺乳动物Kv1.3通道功能有关[7],也使从龙血竭中分离Kv1.3通道阻断剂成为可能.但龙血竭成分复杂,含有黄酮类、萜类、酚类、甾体类等多种组分,前期研究发现龙血竭总黄酮是发现靶向离子通道蛋白生物活性物质的重要组分[8],因此本文拟提取龙血竭总黄酮,研究其对哺乳动物Kv1.3通道功能的调节作用,为进一步深入挖掘龙血竭中Kv1.3通道阻断剂指明方向.
1 材料和方法
1.1 试剂与药品
RPMI 1640、高糖型DMEM(Hyclone);胎牛血清(FBS,Gibco);Jurkat T 细胞、 HEK-293T细胞(武汉大学典藏中心);乙酸乙酯(上海生工);lipofectamine 2000(Invitrogen);二甲基亚砜(DMSO,Biosharp);细胞内外液试剂(Sigma);龙血竭原材料(西双版纳药业,批号Z20063472),标准品龙血素B(上海纯优生物科技,批号119425-90-0);电压门控性钾通道Kv1.1,Kv1.2,Kv1.3的真核表达载体pIRES2-EGFP由武汉大学李文鑫教授实验室提供.
1.2 仪器
紫外分光光度计(UEC1312028,上海美普达);CO2培养箱(Heal Force,HF160W);膜片钳放大器(EPC9/2,HEKA);显微操作器(MP225,Sutter);程控玻璃电极拉制仪(05-E型)、玻璃微电极抛光仪(2002-C)、多通道快速微量程控给药系统(MPS-2)均购自武汉仪博公司;微电极玻璃毛细管(武汉微探科学仪器).
1.3 龙血竭总黄酮的提取和含量测定
龙血竭总黄酮(tFRD)采用课题组优化的工艺进行提取[9],以乙酸乙酯为提取溶剂,10倍溶剂70 ℃下回流提取30 min,提取1次.提取物中总黄酮含量以龙血素B (LrB)为对照品,于紫外分光光度计277 nm处测量对照品及提取物吸光度,以对照品浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,根据线性回归方程计算提取物中总黄酮的含量.
1.4 细胞培养和通道蛋白的外源性表达
人白血病淋巴细胞系Jurkat T 细胞和 HEK-293T细胞分别培养在添加有10%胎牛血清、100 U/mL 青霉素、100 μg/mL链霉素的RPMI 1640和 高糖型DMEM培养基中,于37 ℃、5%CO2培养箱中培养.将编码有电压门控性钾通道Kv1.1,Kv1.2,Kv1.3的真核表达载体pIRES2-EGFP用lipofectamine 2000转染至HEK-293T细胞中,24 h后选用发绿色荧光的细胞进行电生理测试.
1.5 细胞内外液和龙血竭总黄酮工作液的配制
用于记录电压门控性钾通道电流的细胞外液成分为:140 mmol/L NaCl ,5 mmol/L KCl,2 mmol/L CaCl2,1 mmol/L MgCl2,10 mmol/L HEPES,10 mmol/L D-Glucose,外液PH值用NaOH调至7.4,渗透压用蔗糖调至310~320 mOs/L.电极内液成分为:140 mmol/L KCl,1 mmol/L MgCl2,1 mmol/L EGTA,10 mmol/L HEPES,3 mmol/L Na2ATP,内液渗透压为280~290 mOsm/L,PH值以KOH调至7.2.提取的龙血竭总黄酮粉末用DMSO溶解后,以不同浓度配制在细胞外液中用于电生理实验.
1.6 电生理实验
采用EPC9/2(HEKA)放大器进行全细胞膜片钳记录,环境温度控制在22~25 ℃,实验参数的设置、数据的采集和电压刺激均通过Patch Master软件完成.微电极玻璃毛细管经程控玻璃电极拉制仪两步拉制,经玻璃微电极抛光仪抛光,灌注电极内液后稍加正压,入液电阻为2~5 MΩ.在全细胞记录模式下将细胞膜电位钳制在-60 mV,每20 s 给予400 ms步长、+50 mV的去极化脉冲刺激以激活电压门控性钾通道电流.待电流稳定后,采用多通道快速微量程控给药系统对所记录细胞依次进行浓度梯度给药,同时记录细胞膜上通道电流变化情况.
1.7 数据处理和统计分析

2 结果
2.1 龙血竭提取物中总黄酮的质量鉴定
将龙血素B对照品溶液和龙血竭提取物样品溶液于220~600 nm处进行连续波长扫描,获得紫外吸收图谱如图1A所示,可知龙血竭提取物的紫外吸收曲线与对照品龙血素B基本一致,二者均在277 nm处有明显的吸收峰,与以往报道一致[9],表明龙血竭总黄酮提取成功.
将对照品龙血素B进行浓度梯度检测,以对照品浓度为横坐标,吸光度OD277为纵坐标,绘制标准曲线并拟合直线回归方程(图1B),算得提取物中总黄酮质量分数为65.12%,与报道基本一致[9],满足《药品注册管理办法》之中药5类新药的植物药提取有效部位的含量要求,可用于进一步的药理学活性测定.
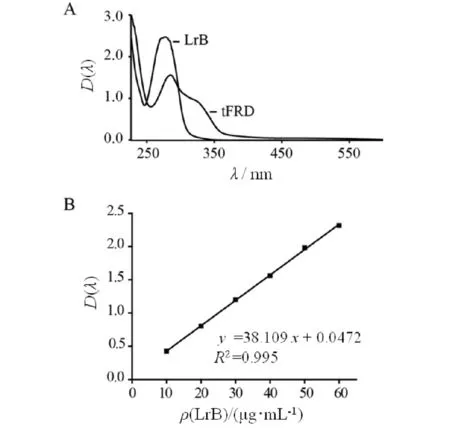
A)龙血竭总黄酮和龙血素B的全波长紫外吸收图谱; B)龙血素B的定量标准曲线图1 龙血竭提取物中总黄酮的质量鉴定Fig.1 Quality identification of total flavonoids from the extract of Resina Draconis
2.2 龙血竭总黄酮对内源性表达的Kv1.3通道调节作用
由于人源性白血病淋巴细胞系JurkatT细胞膜上主要表达电压门控性钾通道Kv1.3[10],JurkatT细胞是研究生物活性物质调节内源性Kv1.3通道的优良细胞模型.将JurkatT细胞膜电位钳制在-60mV,予以400ms步长、+50mV去极化电压刺激,激发出细胞膜上Kv1.3通道电流,记录不同浓度龙血竭总黄酮外液灌流时JurkatT细胞膜上Kv1.3通道电流的变化情况(见图2).当给予质量浓度为0.01%的龙血竭总黄酮外液时,可将JurkatT细胞上的Kv1.3通道电流抑制55%以上,龙血竭总黄酮对Kv1.3通道的电流抑制呈现浓度依赖性特点,其抑制效应可部分得以洗脱.通过Hill方程对龙血竭总黄酮抑制效应的量效曲线进行拟合,得到龙血竭总黄酮对内源性Kv1.3通道的半数抑制浓度为(0.007199±0.000617)%.

A)龙血竭总黄酮对Jurkat T细胞Kv1.3通道的电压-电流图; B)龙血竭总黄酮抑制Jurkat T细胞Kv1.3通道电流的量效曲线(n=5)图2 龙血竭总黄酮对Jurkat T细胞内源性表达的Kv1.3通道浓度依赖性抑制作用Fig.2 Inhibitory effects of tFRD on endogenous Kv1.3 channels in Jurkat T cells with a concentration-dependent manner
2.3 龙血竭总黄酮对外源性表达的Kv1.3通道调节作用
HEK-293T细胞极少表达细胞外配体所需的内生受体且易转染,是一个常用的表达外源基因的细胞株.本研究将编码mKv1.3通道的质粒pIRES2-EGFP-mKv1.3转染至HEK-293T细胞24h,选用发绿色荧光的阳性细胞进行全细胞膜片钳记录,观察不同浓度的龙血竭总黄酮对外源性表达的Kv1.3通道电流影响(见图3).
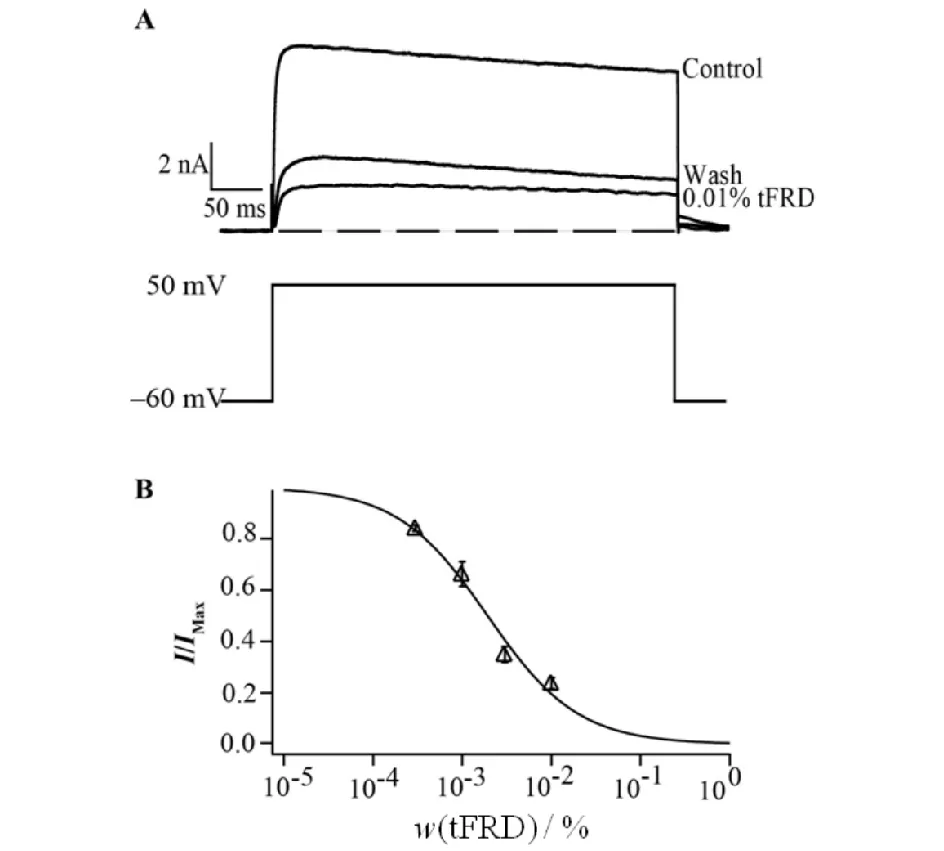
A)龙血竭总黄酮对HEK-293T细胞Kv1.3通道的电压-电流关系图; B)龙血竭总黄酮抑制外源性Kv1.3通道电流的量效曲线(n=6)图3 龙血竭总黄酮对外源性表达HEK-293T细胞上Kv1.3通道的浓度依赖性抑制作用Fig.3 Inhibitory effects of tFRD on exogenous Kv1.3 channels in HEK-293T cells with a concentration dependent manner
龙血竭总黄酮对外源性表达Kv1.3通道抑制作用较强,呈浓度依赖性,当细胞外液中龙血竭总黄酮浓度为0.01%时,HEK-293T细胞膜上Kv1.3通道电流被抑制了73%,抑制效应可部分洗脱.通过Hill方程对龙血竭总黄酮抑制外源性Kv1.3通道电流的量效曲线进行拟合,得到其半数抑制浓度为(0.001937±0.000228)%.
2.4 龙血竭总黄酮对其它电压门控性钾通道的影响
电压门控性钾通道具有不同的亚型,不同结构的电压门控性钾通道在生物体具有不同功能.为探究龙血竭总黄酮阻断Kv1.3的通道选择性,本研究分别将编码有通道mKv1.1,hKv1.2的真核表达载体pIRES2-EGFP-mKv1.1,pIRES2-EGFP-hKv1.2转染至HEK-293T细胞中,24h后选用发绿色荧光的阳性细胞进行全细胞膜片钳测试,记录细胞外液中不同浓度龙血竭总黄酮对外源性表达的Kv1.1,Kv1.2通道电流的影响(见图4). 较Kv1.3通道的作用,龙血竭总黄酮对Kv1.1和Kv1.2通道的抑制效果较微弱,0.01%高浓度的龙血竭总黄酮对Kv1.1和Kv1.2通道电流的抑制率分别只有50.8%和53.33%;通过Hill方程进行量效曲线拟合,得到IC50分别为(0.011818±0.00132)%和(0.02698±0.00374)%.表明龙血竭总黄酮阻断Kv1.3通道效率要高于Kv1.1和Kv1.2,活性差异分别为6.11倍和13.93倍,提示其对Kv1.3通道具有选择性阻断作用.
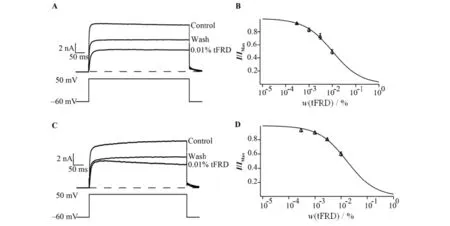
A,C)龙血竭总黄酮对HEK-293T细胞Kv1.1和Kv1.2通道的电压-电流关系图; B,D)龙血竭总黄酮抑制外源性Kv1.1和Kv1.2通道电流的量效曲线(n=6)图4 龙血竭总黄酮对外源性表达的 Kv1.1和Kv1.2通道电流的影响Fig.4 Effects of tFRD on exogenous Kv1.1 and Kv1.2 channels
3 讨论
Kv1.3通道是治疗AID的理想新靶点[11],开发Kv1.3通道阻断剂的先导化合物是治疗AID的重要途径.为获得新型Kv1.3通道阻断剂,可从有毒动物分泌的毒液中筛选特异性的生物活性多肽[12,13],或从药用植物中发现靶向阻断通道的有机小分子[14];前者虽具有较高的通道阻断效率[15],但多肽的不稳定性和潜在抗原性限制了其成药性,而源于药用植物的有机小分子则受限较少,因此从天然植物中发现新型Kv1.3有机小分子阻断剂正成为研究热点[16].
龙血竭是传统名贵中药,具有活血化瘀、消炎止痛等广泛的药理作用,它还具有独特的免疫调节作用,可浓度依赖性阻断JurkatT淋巴细胞膜上Kv1.3通道[7],是发现新型Kv1.3通道阻断剂的天然药物资源.但龙血竭组成复杂,包含黄酮类、萜类、酚类、甾体类等,为确定龙血竭阻断Kv1.3通道的活性部位,缩小从龙血竭中筛选挖掘Kv1.3通道阻断剂的范围,本文在前期证实龙血竭总黄酮具有良好的离子通道蛋白阻断作用的基础上[8],采用组优化工艺[9]提取总黄酮,运用电生理学技术检测其对Kv1.3通道的调节作用.结果表明:龙血竭总黄酮对内源性和外源性Kv1.3通道均表现出较强的抑制作用,呈现浓度依赖性,较Kv1.3通道的同源蛋白,具有一定的通道选择性,说明龙血竭总黄酮部分介导了龙血竭对Kv1.3通道的阻断作用,或能对自身免疫性疾病的防治研究提供思路.
龙血竭总黄酮中包括龙血素B、剑叶龙血素A、剑叶龙血素B等多种类型的查尔酮类化合物[18],结构类似但又有微小差别.研究发现龙血素B能高效率、高选择性阻断哺乳动物Kv1.3通道[17],引起通道的快速失活,表现出深部孔区阻断特性,部分解释了龙血竭总黄酮能够选择性阻断Kv1.3通道的药理学活性.但本文中龙血竭总黄酮并未体现这一深部孔区阻断Kv1.3通道特性,提示龙血竭总黄酮中可能还存在其它调节Kv1.3通道的活性单体,其阻断通道作用正是这些包括龙血素B在内的多种活性单体共同作用的结果,深入研究它们调节Kv1.3通道的共性差异和构效关系,将有助于阐明龙血竭总黄酮中查尔酮类等化合物调节Kv1.3通道的作用机理.
