谷子种子愈伤组织的诱导与植株再生
2019-04-03王晓璐尹艺臻温银元原向阳王育选赵娟
王晓璐,尹艺臻,温银元,原向阳,王育选,赵娟
(山西农业大学 农学院,山西 太谷 030801)
谷子(Setaritalica(L.) Beauv) 别称粟,为一年生禾本科狗尾草属植物,起源于中国,是世界上最古老的栽培作物之一,也是我国北方干旱和半干旱地区重要的区域性粮食作物,具有基因组稳定、适应性广、抗逆强、营养丰富等特点,在我国的粮食安全中起重要作用[1~7]。脱壳后的谷子称为小米,含丰富的蛋白质,维生素,脂肪,钙铁锌硒等微量元素,同时,谷子营养均衡,是较好的饲料作物[8~11]。作为“五谷”之一的谷子是山西省主要栽培农作物之一,播种面积在全国位居第二,种植品种以晋谷21号为主[12,13]。晋谷21号原名晋汾7号,是经南繁北育、多代选择而培育成的谷子品种,其米色金黄发亮,细柔光滑,品质和产量高,同时晋谷21号也是我国推广面积最大、品牌名称最多、小米加工企业利用最广的优质谷子品种[14~19]。
新世纪以来,随着世界人口的不断增长,对粮食的需求量也在持续的增加,Borlaug[20]推测在2025年主要粮食作物产量要提高4.5 t·hm-2。常规的作物育种技术已经不能满足人口日益增长的需求,需要通过基因工程技术,来提高谷子的产量和品质,而建立一套高效、优良的谷子再生体系,是利用基因工程方法选育、改良谷子品种、提高产量的前提条件[1~3]。目前,较之小麦、玉米等大作物,关于谷子组织培养方面的报道相对较少,现有相关报道中多以谷子幼穗、花药等为外植体进行愈伤组织的诱导和植株再生,而幼穗等部位的取材常常受到地理环境、季节和发育阶段等条件的严格限制[3],影响其在很多方面的应用。相比之下,谷子种子可常年保存,取材方便,是一种较理想的遗传转化的受体材料。但谷子种子再生体系的建立对基因型的依赖非常大,影响条件也较多,尚未见到关于晋谷21号种子再生体系建立的相关报道。本试验以晋谷21号成熟谷子的种子为外植体,研究了不同植物生长调节剂种类和浓度配比对晋谷21号谷子种子愈伤组织诱导及植株再生的影响,以期建立稳定高效的谷子种子再生体系,为基因工程技术在谷子上的进一步应用及开展谷子的相关育种工作奠定基础。
1 材料与方法
1.1 试验材料
谷子品种“晋谷21号”由山西省农科院经作所提供。
1.2 试验方法
1.2.1 外植体的获得
挑选干净、饱满的成熟谷子种子,流水冲洗10 min后转至超净工作台,无菌水冲洗1次,用75%乙醇灭菌20 s后用0.1% HgCl2浸泡10 min,期间不断振荡。表面消毒后的种子用无菌蒸馏水清洗5次,放到无菌的滤纸上,吸干表面水分,然后将种子接种在诱导愈伤培养基上,(25±1) ℃暗培养。
1.2.2 愈伤组织的诱导
将处理好的成熟种子接种于附加不同激素浓度和配比的愈伤组织诱导培养基上,每个处理接种10瓶,每瓶接种7个种子,在(25±1) ℃暗培养3周,期间计算种子的萌发率并观察愈伤组织的诱导情况,计算愈伤组织诱导率。试验重复3次。
2,4-D处理:以MS培养基为基本培养基,添加不同浓度的2,4-D(0.5、1.0、2.0、3.0、4.0 mg·L-1)。NAA处理:以MS培养基为基本培养基,添加不同浓度的NAA(1.0、2.0、3.0、4.0、5.0、6.0 mg·L-1)。6-BA处理:以筛选出的MS+2.0 mg·L-12,4-D为基本培养基,添加不同浓度的6-BA(0.1、0.2、0.5、1.0、1.5 mg·L-1)。上述各处理均在培养基中添加蔗糖30 g·L-1、琼脂5 g·L-1,pH5.6~5.8。
1.2.3 愈伤组织的分化
选取诱导获得的优质愈伤组织接种到附加不同激素种类和浓度的分化培养基中,每个处理接12瓶,每瓶接种5个愈伤组织,在(25±1) ℃光下培养4周,光照时间为15 h·d-1,期间不断观察愈伤组织的生长和分化情况并记录,计算愈伤组织分化率。试验重复3次。
6-BA处理:以MS培养基为基本培养基,添加不同浓度的6-BA(0.5、1.0、1.5、2.0、2.5 mg·L-1);ZT处理:以MS培养基为基本培养基,添加不同浓度的ZT(0.5、1.0、1.5、2.0、2.5 mg·L-1),上述各处理均在培养基中添加蔗糖30 g·L-1琼脂5 g·L-1,pH为5.6~5.8。
1.2.4 分化苗的生根培养
选取长势良好的分化苗并将其转接到MS基本培养基上,观察分化苗的生根情况。
1.2.5 数据的统计分析
分析成熟种子接种到诱导愈伤培养基4 d后,统计种子的萌发数量,计算种子的萌发率; 21 d 后,统计种子的出愈数量,计算愈伤组织诱导率;愈伤组织接种到分化培养基30 d 后,统计愈伤组织分化的数量,计算愈伤组织分化率。每次试验重复 3 次。
种子萌发率/%=种子的萌发数/接种的种子总数×100
愈伤组织诱导率/%=诱导的愈伤组织种子数/接种的种子总数×100
愈伤组织分化率/%=分化幼苗的愈伤组织数/诱导的总愈伤组织数×100
使用SPSS 19.0对数据进行统计分析。
2 结果与分析
2.1 不同种类、浓度的生长素对谷子愈伤组织诱导和生长情况的影响
由表1可知,将谷子种子接种到愈伤诱导培养基后,2~3 d种子开始萌发,之后种子胚芽基部开始膨大,1周左右开始形成愈伤组织。在附加不同种类生长素的培养基中诱导出的愈伤组织差异较大。培养基中附加2,4-D时,1周后可以观察到透明粘稠状的愈伤组织,2周后愈伤组织开始变为淡黄色,并达到最大,3周后愈伤组织开始褐化,变得更加粘稠,并且随着2,4-D浓度的增大,褐化速度加快;而附加了NAA的培养基中,1周后可以观察到透明沙状的愈伤组织,2周后愈伤组织有透明变为浅白色,3周后愈伤组织变为淡黄色,并达到最大,部分浓度的愈伤组织出现褐化,且随着NAA浓度的增大,其褐化速度加快(图1)。
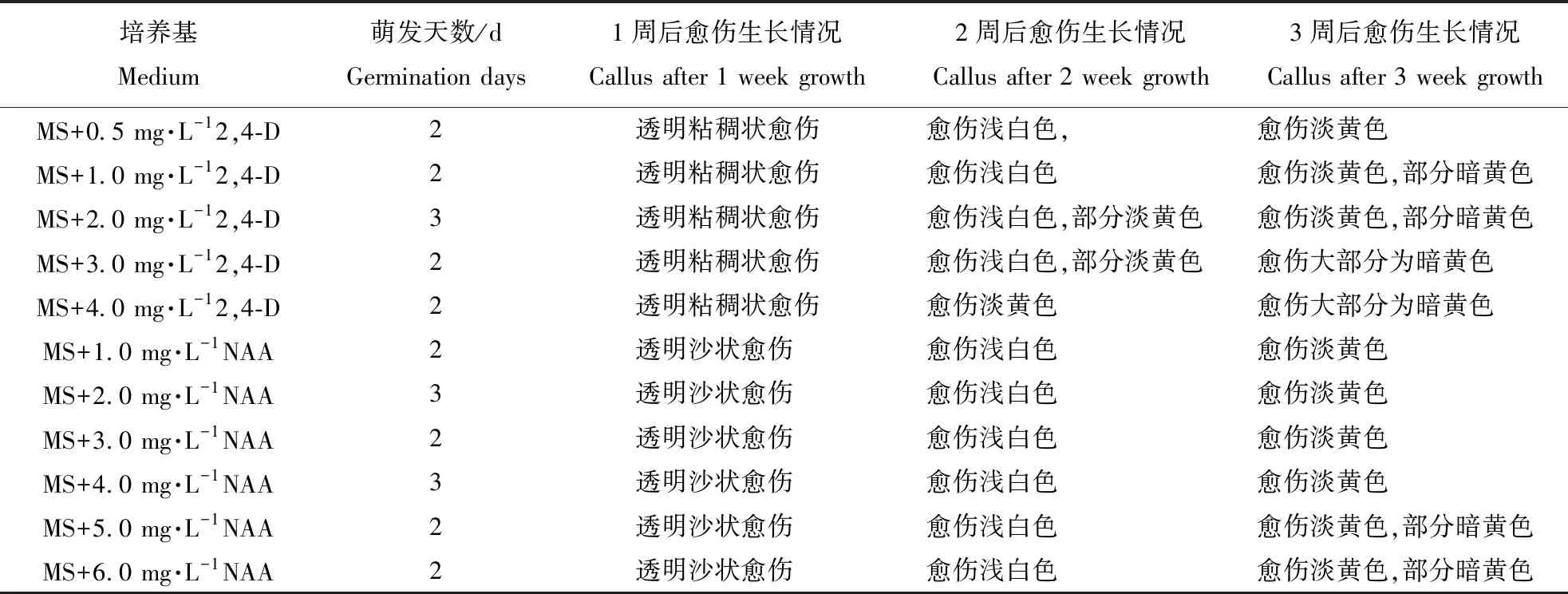
表1 不同种类、浓度的生长素对谷子愈伤组织诱导和生长情况的影响Table 1 Effects of different concentrations of auxin on callus induction and growth of Millet

图1 不同种类生长素对谷子愈伤组织诱导和生长情况的影响Fig.1 The situation of millet callus induction at different hormone注:(a:MS+2.0 mg·L-12,4-D 1周后; b:MS+2.0 mg·L-12,4-D 2周后; c:MS+2.0 mg·L-1NAA 2周后)Note:(a: MS+2.0 mg·L-12,4-D 1 week later; b: MS+2.0 mg·L-12,4-D 2 weeks later; c: MS+2.0 mg·L-1NAA 3 weeks later)
2.2 不同种类、浓度的生长素对谷子愈伤组织诱导的影响
由表2可知,添加的不同种类、浓度的生长素对种子的萌发影响不大(2,4-D 69.43%,NAA 70.47%),而添加不同种类的生长素对愈伤组织的诱导影响较为明显(2,4-D 81.14%,NAA 76.67%),愈伤组织的诱导率都随着2种生长素浓度的增加都呈现出先增高后降低的趋势,2,4-D 2.0 mg·L-1、NAA 5.0 mg·L-1时均表现出最高的愈伤诱导率(2,4-D 88.57%,NAA 84.29%),2种激素相比较而言,2,4-D诱导愈伤的效果要优于NAA。综上可知2,4-D2.0 mg·L-1为最佳的诱导愈伤组织的激素和浓度。
2.3 不同激素配比对谷子愈伤组织诱导的影响
由表3可知,6-BA与2,4-D配比使用促进种子的萌发,培养基中单独附加2,4-D 2.0 mg·L-1时,种子萌发率为68.57%,而2.0 mg·L-12,4-D

表2 不同种类、浓度的生长素对谷子愈伤组织诱导的影响Table 2 Effects of different kinds and concentrations of auxin on callus induction of millet
注:同列不同小写字母表示差异显著(P<0.05)。下同。
Note: Different lowercase letters show significant difference in the same column (P<0.05).The same below.
与不同浓度6-BA配比使用时,种子平均萌发率可达77.72%,其萌发率提高了9.15%;同时2,4-D与6-BA配比还可提高愈伤的质量,且对愈伤组织的诱导产生影响,6-BA浓度过低或过高都会降低愈伤组织的诱导率,当6-BA浓度为0.2 mg·L-1时,诱导率达92.86%,随着6-BA浓度的增加,愈伤组织的褐化速度越快。综合考虑,0.2 mg·L-1的6-BA与2.0 mg·L-12,4-D配比有利于愈伤组织的诱导(图2)。
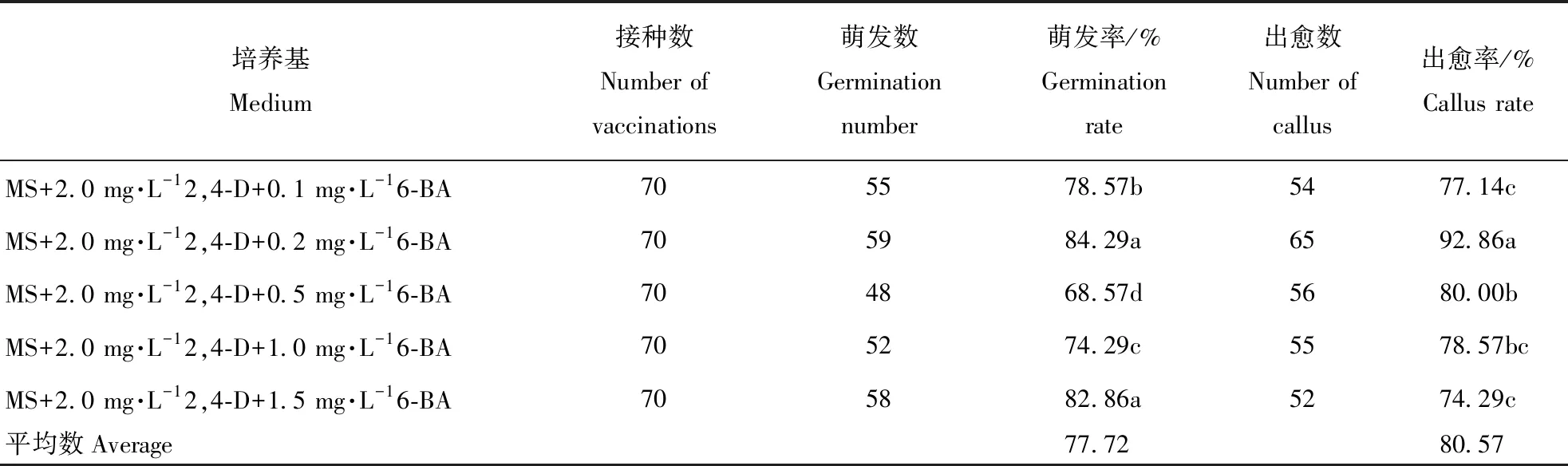
表3 2,4-D与6-BA配比对谷子愈伤组织诱导的影响Table 3 Effects of 2,4-D and 6-BA on callus induction of millet

图2 2,4-D与6-BA配比对谷子愈伤组织诱导影响Fig.2 Effects of 2.0 mg·L-1 2,4-D and 0.2 mg·L-1 6-BA on callus induction of milletMS+2.0 mg·L-12,4-D+0.2 mg·L-16-BA
2.4 不同种类、浓度的细胞分裂素对谷子愈伤组织分化情况的影响
选取诱导获得的优质愈伤组织接种到分化培养基上,诱导愈伤组织分化(表4)。3周左右愈伤组织分化产生绿芽,1个月左右分化产生不定芽,后期继续观察发现各不同处理的培养基中都会出现愈伤组织生根的现象。当6-BA浓度为0.5~1.5 mg·L-1和ZT浓度为0.5~1.0 mg·L-1时,愈伤组织都可以分化产生较多的绿芽,并且愈伤组织褐化速度也较慢。以6-BA浓度为1.0 mg·L-1时,愈伤组织产生的绿芽最多,且愈伤组织不易褐化,分化出的绿芽也可以正常的生长,为诱导愈伤
组织分化的最适宜培养基(图3)。ZT浓度为1.0 mg·L-1时,愈伤组织产生的绿芽较同浓度6-BA少,但分化出的绿芽后期生长更为健壮(图4)。提高6-BA和ZT浓度则愈伤组织褐化加快,ZT浓度达到2.5 mg·L-1时,愈伤组织只分化根,且快速褐化(图5)。
2.5 不同种类、浓度的细胞分裂素对谷子愈伤组织分化的影响
由表5可知,不同种类的细胞分裂素对谷子愈伤组织分化的影响是有差异的(6-BA6.67%,ZT4.00%),愈伤组织的分化率会随着6-BA浓度的增加呈现出先增高后降低的趋势,而ZT则没有,随着ZT浓度的增加,愈伤组织的分化率呈现出高低起伏的趋势。当6-BA的浓度为1.0 mg·L-1、ZT浓度为0.5 mg·L-1时均达到最高的愈伤分化率(6-BA13.33%,ZT10.00%)。2种激素相比较而言,6-BA对愈伤组织的分化效果要优于ZT。因此,综合考虑,6-BA1.0 mg·L-1为最佳的诱导愈伤组织的激素和浓度。
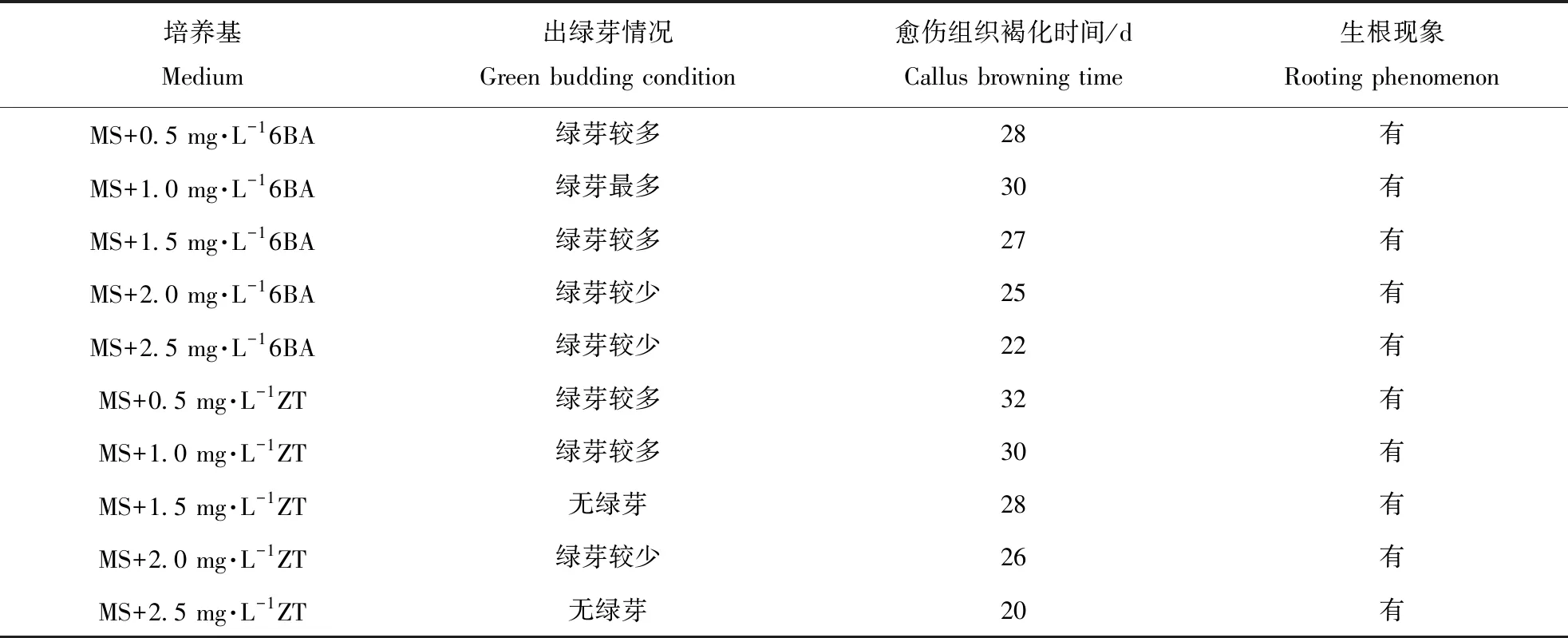
表4 不同种类、浓度的细胞分裂素对谷子愈伤组织分化情况的影响Table 4 Effects of cytokinin on callus differentiation of Millet

图3 6-BA对谷子愈伤组织分化的影响MS+1.0 mg·L-16-BAFig.3 Effects of 6-BA on callus differentiation of Millet MS+1.0 mg·L-16-BA

图4 ZT对谷子愈伤组织分化的影响MS+1.0 mg·L-1ZTFig.4 Effects of ZT on callus differentiation of Millet MS+1.0 mg·L-1ZT

图5 愈伤组织褐化生根Fig.5 Browning and rooting of callus
2.6 分化苗的生根情况
将长势良好的分化苗接种到不附加任何激素的MS基本培养基上后,培养3~4周后所有的分化苗均可生根,且根系健壮,可用于移栽(图6)。
3 讨论与结论
目前关于谷子组织培养的报道相对较少,现有研究中建立谷子再生体系时所用的外植体以幼穗最多,也有用花药、茎尖和叶片等为外植体进行培养的。日本学者研究通过培养处于四分体至单核小细胞子期的花药成功诱导出愈伤组织,并获得再生植株[22];王寒玉等[23]研究用谷子的茎尖做外植体诱导愈伤组织,并成功的获得了再生植株;许智宏等[24]研究以谷子的幼穗为外植体进行谷子愈伤组织的诱导和再生植株的获得,并取得了成功;王节之等[25]利用谷子幼穗为外植体,筛选出了比较理想的适合愈伤组织诱导和分化的激素配比。上述研究表明幼穗、茎尖等部位都可以作为建立谷子再生体系的外植体,但幼穗、茎尖和花药等部位的取材受到季节和发育阶段等条件的限制,存在取材的局限性。相比较而言,谷子的成熟种子取材方便,不受季节和数量等的限制,摸索好建立再生体系的条件后可随时取材随时诱导,避免了再生植株长期继代后再生能力降低和发生变异的问题。本试验以晋谷21的成熟种子为外植体,通过诱导筛选获得了较高的愈伤组织诱导率,但愈伤组织的分化率相对偏低,仍需进一步优化提高愈伤组织的分化率。

表5 不同种类、浓度的细胞分裂素对谷子愈伤组织分化的影响Table 5 Effects of different types and concentrations of cytokinin on the differentiation of millet callus

图6 生根培养Fig.6 Rooting culture
植物激素是影响谷子愈伤组织诱导和分化再生植株的重要因素,培养的外植体部位不同时,植物激素的种类和配比浓度也要随之变化。王节之等[21]在试验中发现不同激素对谷子幼穗组培的作用不同,2,4-D可以促进幼穗愈伤组织的诱导,KT可以促进细胞的分裂,6-BA在幼穗愈伤组织分化成苗中起主导作用;王寒玉等[2]研究发现在含有2,4-D的培养基上加入细胞分裂素ZT和KT后在一定程度上提高了愈伤组织的诱导效率。尤其以种子为外植体时,不同基因型谷子种子诱导愈伤组织及再生植株时对激素种类和浓度的需求差异很大,李惠等[1]研究发现在谷子种子愈伤组织诱导的过程中,附加NAA的效果优于2,4-D,且在培养基中添加低浓度的CTK,可以改善愈伤组织的质量;袁进成等[3]研究发现谷子在合适的2,4-D(2.0 mg·L-1)浓度的培养基中,4 种不同基因型的种子愈伤诱导率差异较大,从60.75%到12.75%,而且诱导出来的愈伤状态差异也较大,谷子诱导愈伤较好的激素配比是2,4-D+ZT,愈伤分化较优的激素配比为NAA 和6-BA 的组合。本试验结果表明在愈伤组织的诱导过程中,MS培养基中加入不同浓度的2,4-D和NAA都可以促进愈伤组织的诱导,但加入2,4-D的效果更佳,加入适合浓度的6-BA可以改善愈伤组织的质量,诱导愈伤组织分化则以6-BA为好,这与上述报道结果有明显差别。说明谷子基因型是影响谷子种子再生体系建立的关键因素之一,尤其以成熟种子作为外植体时,不同品种间的差异较大,筛选适宜培养的基因型并对其进行优化才能建立稳定高效的再生体系。
