抗坏血酸引发对Na2SO4胁迫下燕麦种子活力的影响
2019-04-03夏方山王雅聪董秋丽王明亚丁荷星朱慧森董宽虎
夏方山,王雅聪,董秋丽,王明亚,丁荷星,朱慧森,董宽虎
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.山西农业大学 林学院,山西 太谷 030801;3.中国农业大学 动物科技学院,北京 100193)
土壤盐渍化是目前人类面临的主要生态危机之一,我国盐渍化土地面积约有3.5×107hm2,占耕地面积的1/3,这严重制约着我国农业的增产和增收[1]。种子萌发与幼苗建成不仅直接决定着植物的生长发育,对外界环境的感应也最为敏感[2]。然而,土壤盐渍化会造成植物种子的萌发率降低、萌发时间变长、幼苗生长缓慢等问题,进而直接制约着植物的种群分布与繁衍以及农牧业的生产成败[3,4]。因此,如何促进植物种子的耐盐性萌发能力是最大限度地利用盐渍化土地的根本保障。种子引发被认为是促进植物种子萌发的有效途径,而采用生理活性物质进行种子引发则是目前该领域研究的热点问题[5,6]。研究表明,抗坏血酸(ascorbic acid,ASC)作为种胚细胞内普遍存在的重要生理活性物质,不仅能增强鹰嘴豆(Cicerarietinum)[7]、甘蔗(Saccharum)[8]、燕麦(Avenasativa)[9]、菜豆(Phaseolusvulgaris)[10]及小麦(Triticumaestivum)[11]等植物的耐盐性,还可提高油菜(Brassicacampestris)[12]和燕麦[13]等植物种子的耐盐性萌发能力。然而,关于外源ASC引发促进植物种子耐盐性萌发的研究报道仍然较少,其具体机理也尚不清楚。
燕麦作为传统的优质粮饲兼用作物,在我国北方干旱和半干旱的农牧交错带广泛种植,具有耐瘠薄、耐盐碱及抗旱耐寒等优点[14,15]。燕麦产量高、营养丰富、适口性好,是制作青干草和优质青贮饲料的重要原材料[16]。同时,燕麦种子富含对人类健康起关键作用营养成分[17],其油脂含量高达3.1%~11.6%,不饱和脂肪酸含量高于80%[13]。然而,不饱和脂肪酸及其衍生物往往易于劣变或酸败,因萌发时对逆境胁迫更敏感而使其种用价值下降[13,18]。所以,这也是盐碱地制约燕麦生产的关键原因,且春季返盐时最严重[19]。我国燕麦主产区的土壤盐分主要是NaCl和Na2SO4[20]。我们前期研究发现,外源ASC引发能促进NaCl胁迫下燕麦种子的萌发及幼苗生长[13],然而,在以Na2SO4为主要盐分的土壤中,外源ASC引发的燕麦种子能否保持较高的活力水平仍然不是很清楚,从而制约着ASC引发燕麦种子在盐渍化土地上生产的应用。因此,本研究以外源ASC引发的燕麦种子为材料,选择Na2SO4进行盐胁迫处理,以探究外源ASC引发对Na2SO4胁迫燕麦种子的萌发是否具有相似的效果,并试图探索能够最大限度地提高Na2SO4胁迫下燕麦种子活力的途径,以期系统揭示外源ASC引发对盐胁迫燕麦种子活力的影响,从而为保障农牧业健康发展和解决人类粮食安全问题提供指导。
1 材料方法
1.1 种子来源与ASC引发处理
供试燕麦种子品种为太阳神(Titan),由北京正道生态科技有限公司提供,并于-20 ℃条件下保存至进行试验,其它具体信息及ASC引发处理的详细操作均参照已发表文献[21]。
1.2 发芽试验与指标测定
发芽条件参照国际种子检验协会制定的种子检验规程(2015)[22],具体试验操作参照已发表文献[21]。发芽率的计算参照国际种子检验协会制定的种子检验规程(2015)[22],发芽指数及幼苗活力指数的计算参照Abdul-Baki和Anderson[23]的方法,平均发芽时间参照Ellis和Roberts[24]的方法计算。
1.3 统计分析
数据采用Excel 2010以及SAS 9.0软件分析,并以Duncans法进行多重比较。
2 结果与分析
2.1 Na2SO4胁迫下ASC引发燕麦种子发芽率的变化
相同浓度ASC引发时,燕麦种子发芽率随Na2SO4浓度的增加呈下降趋势(表1),但在Na2SO4浓度为0和50 mmol·L-1时无显著(P>0.05)差异,而在100 mmol·L-1时显著(P<0.05)降低。随ASC引发浓度的增加,燕麦种子发芽率在Na2SO4浓度为0和50 mmol·L-1时没有发生显著(P>0.05)变化,但在100 mmol·L-1的Na2SO4时呈先升后降的趋势,在ASC浓度为1.5 mmol·L-1时达到最大值,并显著(P<0.05)高于ASC浓度为0、0.5和2.0 mmol·L-1时。
2.2 Na2SO4胁迫下ASC引发燕麦种子发芽指数的变化
相同浓度ASC引发时,燕麦种子发芽指数会随Na2SO4浓度的增大呈显著(P<0.05)下降趋势(表2)。在0 mmol·L-1Na2SO4时,燕麦种子发芽指数会随ASC浓度的增大呈下降趋势,浓度为0和0.5 mmol·L-1的ASC引发下燕麦种子发芽指数显著(P<0.05)高于ASC浓度为1.5和2.0 mmol·L-1时;Na2SO4浓度为50 mmol·L-1时,燕麦种子发芽指数也随ASC浓度的增加呈下降趋势,ASC浓度为0 mmol·L-1引发的燕麦种子发芽指数显著(P<0.05)高于ASC浓度为0.5~2.0 mmol·L-1时,并在ASC浓度为2.0 mmol·L-1时显著(P<0.05)低于其浓度为0~1.0 mmol·L-1时;Na2SO4浓度为100 mmol·L-1时,燕麦种子发芽指数随ASC浓度的增加呈先升后降的趋势,在ASC浓度为1.0和1.5 mmol·L-1时显著(P<0.05)高于其它浓度引发,而浓度为0(CK)mmol·L-1的ASC引发下燕麦种子发芽指数显著低于ASC浓度为0.5~2.0 mmol·L-1时。
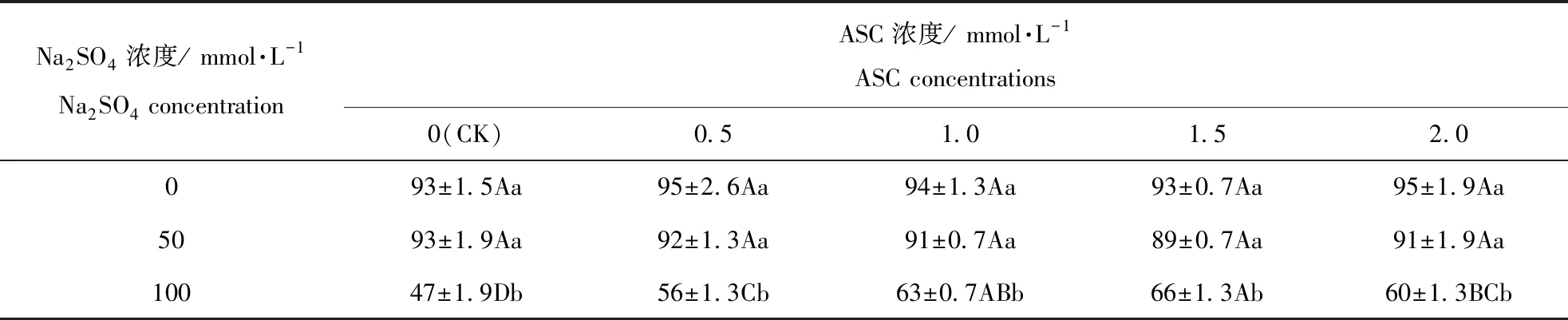
表1 Na2SO4胁迫下ASC引发对燕麦种子发芽率的影响Table 1 Influence of ASC-priming on germination percentage of oat seeds during Na2SO4 stress
注:同行不同大写字母表示差异显著(P<0.05),同列不同小写字母表示差异显著(P<0.05),下同。
Note: Means with the different small letters in same row are significant differences (P<0.05), means with the different capital letters in same column are significant differences (P<0.05), the same below.

表2 Na2SO4胁迫下ASC引发对燕麦种子发芽指数的影响Table 2 Influence of ASC-priming on germination index of oat seeds during Na2SO4 stress
2.3 Na2SO4胁迫下ASC引发燕麦种子平均发芽时间的变化
相同浓度ASC引发时,燕麦种子平均发芽时间随Na2SO4浓度的增大而显著(P<0.05)增加(表3)。在0~100 mmol·L-1的Na2SO4时,燕麦种子平均发芽时间随ASC引发浓度的增大均增加,并均在ASC浓度为2.0 mmol·L-1时显著(P<0.05)高于其它ASC浓度时;Na2SO4浓度为0 mmol·L-1时,浓度为0(CK)和0.5 mmol·L-1的ASC引发下燕麦种子平均发芽时间显著(P<0.05)小于ASC浓度为1.0~2.0 mmol·L-1时;Na2SO4浓度为50和100 mmol·L-1时,浓度为0(CK)mmol·L-1的ASC引发下燕麦种子平均发芽时间均显著(P<0.05)高于ASC浓度为0.5~2.0 mmol·L-1时,并在ASC浓度为2.0 mmol·L-1时显著(P<0.05)小于其余浓度引发时。
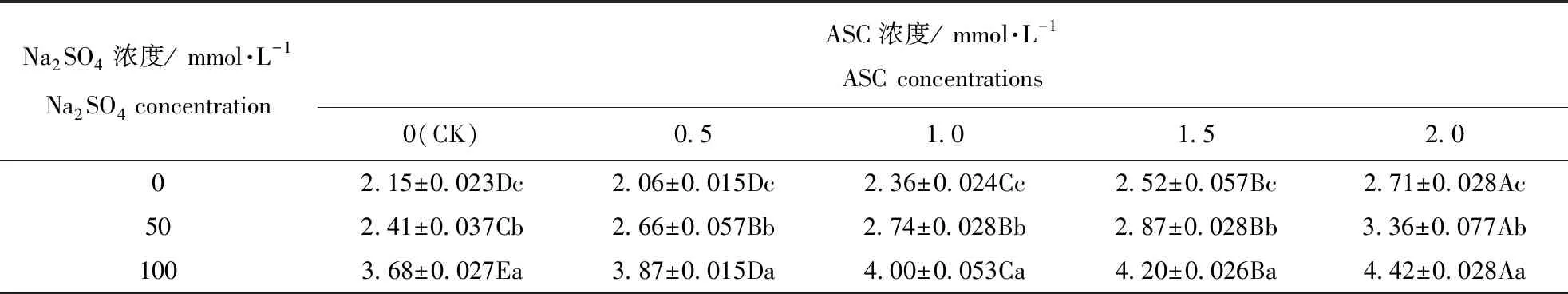
表3 Na2SO4胁迫下ASC引发对燕麦种子平均发芽时间的影响Table 3 Influence of ASC-priming on mean germination time of oat seeds during Na2SO4 stress
2.4 Na2SO4胁迫下ASC引发燕麦种子幼苗活力指数的变化
相同浓度ASC引发时,燕麦种子幼苗活力指数随Na2SO4浓度的增大呈显著(P<0.05)下降趋势(表4)。在0~100 mmol·L-1Na2SO4时,燕麦种子幼苗活力指数均随ASC浓度的增加呈现先升高后下降的趋势,但浓度为0 mmol·L-1的Na2SO4胁迫下,燕麦种子幼苗活力指数随ASC引发浓度的增大而无显著(P>0.05)变化;在50和100 mmol·L-1Na2SO4时,用0(CK)mmol·L-1的ASC引发下燕麦种子幼苗活力指数会显著(P<0.05)小于0.5~2.0 mmol·L-1ASC引发时;在50 mmol·L-1Na2SO4时,1.5 mmol·L-1的ASC引发下燕麦种子幼苗活力指数与在2.0 mmol·L-1的Na2SO4胁迫时无显著(P>0.05)差异,但是显著(P<0.05)大于0~1.0 mmol·L-1的Na2SO4胁迫时时;在100 mmol·L-1的Na2SO4胁迫时,浓度为1.5 mmol·L-1的ASC引发下燕麦种子幼苗活力指数显著(P<0.05)大于其它浓度引发。

表4 Na2SO4胁迫下ASC引发对燕麦种子幼苗活力指数的影响Table 4 Influence of ASC-priming on seedling vigor index of oat seeds during Na2SO4 stress
2.5 ASC和Na2SO4浓度对燕麦种子萌发影响的双因素方差分析
双因素方差分析显示(表5),Na2SO4和ASC浓度对燕麦种子发芽率、发芽指数、平均发芽时间和幼苗活力指数存在极显著(P<0.01)的影响,Na2SO4和ASC浓度的交互作用也极显著(P<0.01)的影响了燕麦种子发芽率、发芽指数及平均发芽时间,并对其幼苗活力指数存在显著(P<0.05)影响。
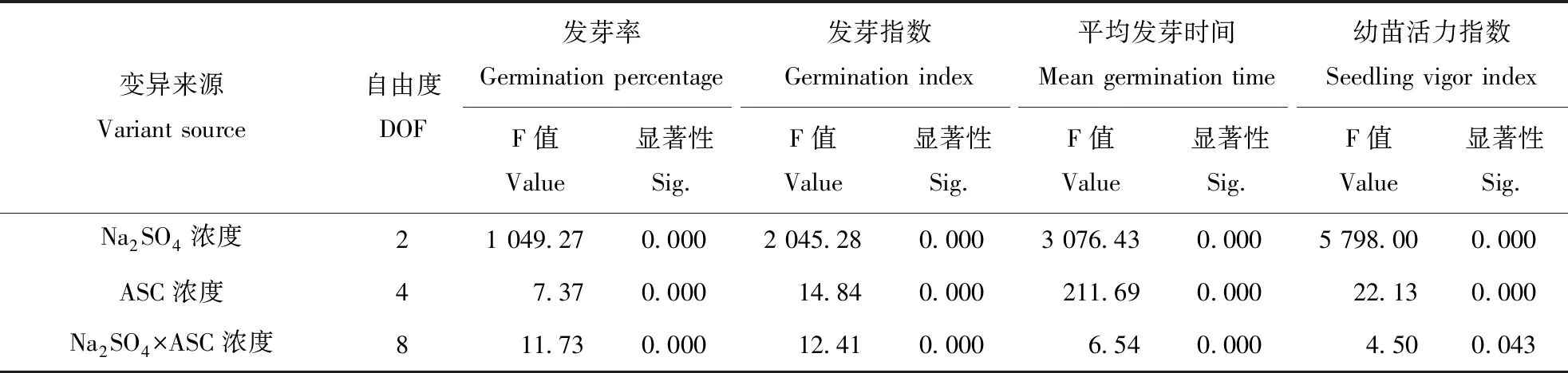
表5 Na2SO4和ASC浓度影响燕麦种子活力的双因素分析Table 5 Bifactor analysis of the concentration of ASC and Na2SO4 on oat seed vigor
3 讨论
盐胁迫会造成燕麦种子萌发及其幼苗生长能力、产量与品质的下降[16,25]。试验结果表明,除50 mmol·L-1的Na2SO4胁迫下,燕麦种子发芽率与其浓度为0 mmol·L-1时差异不显著(P>0.05)外,燕麦种子的发芽率、发芽指数及幼苗活力指数在Na2SO4胁迫下均出现显著(P<0.05)下降,但其MGT则显著(P<0.05)增大,这表明Na2SO4胁迫降低了燕麦种子的活力。刘凤岐等[16]也发现,燕麦种子的发芽率、发芽势、株高及根长在NaCl胁迫下出现显著(P<0.05)降低,并均随NaCl胁迫强度的增加而加强。复合盐碱胁迫还会降低燕麦种子发芽率、发芽势、胚根和胚芽的生长[4]。因此,盐渍化导致的燕麦种子活力丧失是制约其广泛种植的关键因素。
植物ASC既能直接抵御其氧化应激导致的活性氧增加,还能调节其生长、诱导开花、延缓衰老等重要作用[26]。ASC缺乏的转基因水稻(Oryzasativa)会出现生长缓慢、植株矮小、开花延迟、开花数及结实率下降等现象[27]。ASC含量增加会诱导植物根系快速发生细胞分裂,从而促进其伸长[28]。所以ASC既能维持种子的活力水平,又能促进其萌发及幼苗生长[29]。然而,本试验结果表明,在CK条件下,随ASC浓度的增大,燕麦种子发芽率和幼苗活力指数无显著的(P>0.05)变化(表1和4),其平均发芽时间显著(P<0.05)升高(表3),但其发芽指数则逐渐减小,在1.5及2.0 mmol·L-1ASC引发时显著(P<0.05)小于0(CK)及0.5 mmol·L-1时(表2)。这说明在无Na2SO4胁迫的条件下,ASC引发对燕麦种子活力影响不大,但延长了其发芽时间。这可能由于燕麦种子本身活力较高(初始发芽率为100%),而ASC浓度的升高降低了其溶液的水势,导致燕麦种子发生渗透损伤[30]。因此,种子自身活力与萌发条件是决定外源ASC引发技术应用成败的关键。
植物ASC含量与其抗逆性呈正相关,植物内ASC含量增加能有效提高其抗逆性[31]。所以,外源ASC处理能促进植物种子在盐胁迫下的萌发和幼苗生长能力,这已在油菜[32]、燕麦[13]、紫花苜蓿(Medicagosativa)[33]以及黄芩(Scutellariabaicalensis)[34]等植物种子的耐盐性萌发及其幼苗生长中被验证。本试验结果表明,在50 mmol·L-1的Na2SO4胁迫下, ASC引发燕麦种子发芽率与CK差异不显著(P>0.05),且其发芽指数显著降低,但其平均发芽时间和幼苗活力指数均显著(P<0.05)升高,其幼苗活力指数在ASC浓度为1.5 mmol·L-1时达到最大值。这说明ASC引发不能提高燕麦种子在50 mmol·L-1的Na2SO4胁迫下萌发,但能促进其幼苗生长。然而,100 mmol·L-1Na2SO4胁迫时,ASC引发的燕麦种子发芽率、发芽指数及幼苗活力指数都显著(P<0.05)高于CK,并均在1.5 mmol·L-1ASC时达到最大值,但其平均发芽时间也显著高于CK(P<0.05)。这说明ASC引发虽然延长了燕麦种子在Na2SO4胁迫下的萌发时间,但有效地促进其萌发及幼苗生长。尽管外源ASC处理可通过提高植物种子内渗透调节及抗氧化功能以缓解盐胁迫的抑制作用[34,35],但外源ASC引发促进燕麦种子耐盐性萌发的机制是否如此尚有待于深入探讨。
外源ASC浓度与增强植物种子在盐胁迫下的萌发和幼苗生长能力密切相关。研究发现, 20 mg·L-1ASC处理能更好地促进油菜种子在30%海水胁迫时的萌发及幼苗生长[32]。江绪文等[34]则发现0.50 mmol·L-1ASC促进种子萌发及提高其幼苗耐盐性的效果最好。然而,本试验结果表明,不同盐胁迫及ASC引发浓度对燕麦种子发芽率、发芽指数、平均发芽时间和幼苗活力指数的影响差异极显著(P<0.01),而且两者的交互作用对其发芽率、发芽指数和平均发芽时间的影响也差异极显著(P<0.01),对其幼苗活力指数的影响差异显著(P<0.05),这说明外源ASC引发对Na2SO4胁迫燕麦种子活力的影响与两者浓度有关,用1.5 mmol·L-1ASC引发对100 mmol·L-1Na2SO4胁迫下燕麦种子活力的效果最好。因此,应结合燕麦种子的自身活力和胁迫强度选择最佳的ASC浓度予以引发。
4 结论
Na2SO4胁迫降低了燕麦种子活力水平,而ASC引发则可缓解这种不利作用,ASC引发的缓解效果与Na2SO4和ASC浓度密切相关,在100 mmol·L-1的Na2SO4胁迫下采用1.5 mmol·L-1的ASC引发效果最好。因此,ASC引发技术的应用需结合燕麦种子自身活力与盐胁迫强度来谨慎选择其浓度。
