转乙醇酸脱氢酶(GDH)基因棉花的获得及表型鉴定
2019-04-03张树伟张义茹马燕斌李换丽RupertFray韩渊怀
张树伟,张义茹,马燕斌,李换丽,Rupert Fray,韩渊怀*
(1.山西省农业科学院 棉花研究所,山西 运城 044000;2.山西省农业科学院 作物科学研究所,山西 太原 030031;3.山西农业大学 农学院,山西 太谷 030801)
光合作用与光呼吸是植物体内重要的碳同化和碳代谢途径,二者密切联系又互相影响。光合作用碳同化阶段的第一个关键酶,1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)具有双重催化特性,既能催化1,5-二磷酸核酮糖(RuBP)与CO2进行羧化反应起始光合反应碳反应过程,又能催化RuBP与O2进行加氧反应起始光呼吸反应[1~3]。该酶的催化活性依赖于CO2与O2浓度的比值,比值高则促进羧化反应,比值低则促进加氧反应[4, 5]。研究发现植物进行光呼吸伴随着能量的消耗,降低了光合效率,尤其是C3植物,因光呼吸作用较强,可使净光合速率降低25%~30%[6~8]。因此,减少C3植物的光呼吸消耗,可以间接提高光合效率,从而有助于提高作物产量[9]。
乙醇酸脱氢酶(GDH)是一个多聚体,由GlcD、GlcE、GlcF 3个亚基构成。细菌等一些非光合微生物体内存在一个乙醇酸代谢途径,在GDH参与下将乙醇酸转变为乙醛酸,乙醛酸在乙醛酸醛连接酶(GCL)和羟基丙二酸半醛还原酶(TSR)参与下转变为甘油酸,使之在不利环境中正常生长[10, 11]。Kebeish等[12]利用该细菌代谢途径,分别构建了编码GlcD、GlcE、GlcF、GCL和TSR的载体导入拟南芥,在拟南芥中建立一条光呼吸代谢支路。该途径完全利用原先光呼吸代谢途径的中间产物,并将原先在线粒体中释放的CO2变成在叶绿体中释放,从而使细胞中CO2/O2比值增加,促进Rubisco的羧化反应提高了光合作用;获得的转基因拟南芥生长更快,株型更大,总生物量比野生型明显增加。Nölke等[13]构建了含有GDH的载体,用35S 启动子驱动,转入马铃薯中建立光呼吸支路,发现转基因马铃薯不仅株型比对照明显增大,植株总生物量和可溶性糖积累也比对照显著增加。Dalal等[14]将GDH构建于一个载体(DEF2),将GCL和TSR构建于一个载体(GT1),分别导入亚麻荠中建立光呼吸支路,发现转基因株系均实现了减弱光呼吸和增强光合效率;其中独立转基因株系(DEF2)的种子产量比野生型增加50%~57%,全支路转基因株系(DEF2+GT1)的种子产量比野生型增加57%~73%;同时,转基因株系的植被生物量增加,开花结籽到种子成熟的发育期更快。
本试验拟利用上述构建光呼吸支路的思路,克隆大肠杆菌乙醇酸脱氢酶基因GDH,连接含35S强启动子的表达载体上。以陆地棉常规品种为试验材料R15,利用农杆菌介导法将融合载体导入棉花中[15]。利用分子生物学方法筛选阳性转基因植株,并通过表型鉴定及生理检测,探索棉花中建立光呼吸支路来提高光合效率进而提高产量的可行性,为培育新型高产棉花提供新的思路。
1 材料和方法
1.1 试验材料
试验所用材料为陆地棉(Gossypiumhirsutum)常规品种R15,农杆菌菌株为LBA4404,由山西省农业科学院棉花研究所生物技术室提供。乙醇酸脱氢酶基因GDH由英国诺丁汉大学植物科学院提供,载体pBSK(+)抗性Amp,构建的融合基因由35S启动表达。
EasyPure Plant Genomic DNA Ki,EasyPure HiPure Plasmid MaxiPrep Kit购于北京全式金生物技术(TransGen Biotech)有限公司,常用试剂均为国产分析纯。
1.2 棉花遗传转化及再生植株获得
陆地棉R15经浓硫酸脱绒后,于75%乙醇中消毒30 s,双氧水中消毒3~4 h,灭菌水清洗5~6次后,在超净台上播种于萌发培养基。在22 ℃暗处培养1周后,将长出的下胚轴切成0.5~1 cm大小,用于农杆菌浸染。
含外源乙醇酸脱氢酶基因的农杆菌菌株接种于含Rif和Amp的LB液体培养基中[16],28 ℃于恒温摇床200 r·min-1培养过夜。5000 r·min-1离心5 min收集农杆菌体,倒掉上清液,用30 g·L-1葡萄糖溶液悬浮,重复离心收集菌体一次,再用适当体积该溶液悬浮,调节OD600值为0.6~0.8,浸染上述已切成小段的下胚轴材料7~8 min,于22 ℃暗处共培养48 h后,转入含Amp的筛选培养基,于光/暗周期16 h/8 h,恒温22 ℃人工气候室培养。每隔20 d换一次新鲜培养基,长出胚性愈伤组织后转入分化培养基,相同条件下继续培养,每隔20 d换一次新鲜培养基。长出再生幼苗嫁接于温室,取幼嫩叶片提取DNA进行PCR筛选阳性株系,于盛花期人工自交并收获自交种子。
1.3 棉花基因组DNA提取及PCR检测
获得棉花转基因材料种植于山西省农科院棉花研究所转基因试验田,田间常规管理,出苗4周后取主茎嫩叶置于冷冻管中液氮速冻,并于-80 ℃保存。
利用优化过的CTAB法[17]提取基因组DNA,用对应引物进行PCR扩增。具体反应体系(表1)如下:
取5 μL PCR产物于0.8% 琼脂糖凝胶电泳检测并拍照,剩余PCR产物于-20 ℃保存备用。

表1 PCR反应体系Table 1 PCR reaction system
1.4 光合特性测定
在晴朗无风的早晨10:00~11:30,选择棉花打顶前主茎倒4叶,采用LI-6400便携式光合仪(LI-COR,Lincoln,USA)测定叶片的气体交换参数,包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)等,采用开放式气路测定,气温为33~36 ℃。每株系重复3次测定取平均值。
1.5 表型观察及干物质分析
通过PCR检测阳性的转基因棉花不同株系按株行播种于转基因试验田,对照(CK)材料选用受体棉花材料R15,田间常规管理。植株打顶前测量地上部分株高,果枝数及子叶节以上总叶片数。取转基因株系和对照材料倒4叶,分别编号拍照。按编号测定各叶片鲜重,装入牛皮纸信封于烘箱中105 ℃杀青30 min,80 ℃继续烘干至恒重,测定叶片干重,每株系重复3次测定取平均值。
1.6 数据分析
使用SPSS 17.0对所得数据进行统计分析,通过单因素方差分析(One-way ANOVA)检验数据的差异显著性(P<0.05)。
2 结果与分析
2.1 农杆菌介导的棉花转基因及再生苗获得
用含外源基因的农杆菌浸染陆地棉下胚轴外植体,在黑暗共培48 h后,转入含100 mg·L-1Amp的筛选培养基上进行愈伤组织诱导。在该筛选条件下,成功转化的外植体细胞会逐渐形成愈伤细胞,没有转化成功的外植体会褐化死亡(图1A);经过一段时间诱导培养,愈伤细胞会快速增殖形成淡黄色愈伤组织(图1B);愈伤组织经过3~4次继代培养出现胚性愈伤,胚性愈伤组织在分化培养基中持续继代3~4次分化出幼芽(图1C);幼芽继续培养一段时间出现根和叶片形成幼苗(图1D);幼苗在培养基中生长一段时间后嫁接到砧木上在温室继续培养成活。

图1 农杆菌介导的转基因棉花再生株的获得Fig.1 Regeneration of cotton tissue cultures by Agrobacterium-mediated transformation注:A:农杆菌浸染棉花下胚轴诱导愈伤;B:愈伤组织增殖;C:胚性愈伤分化幼苗;D:转基因再生苗植株Note:A: Induction of cotton hypocotyl callus after Agrobacterium infection; B: Callus proliferation; C: Embryogenic callus differentiation seedlings; D: The regeneration of transgenic seedlings
2.2 再生植株外源基因的PCR检测
对转化出幼苗并嫁接成活的再生株系提取基因组DNA,用特异性引物进行片段检测,PCR扩增得到大小约710 bp的特异性条带,该条带与以质粒为模板扩增的片段大小吻合(图2)。
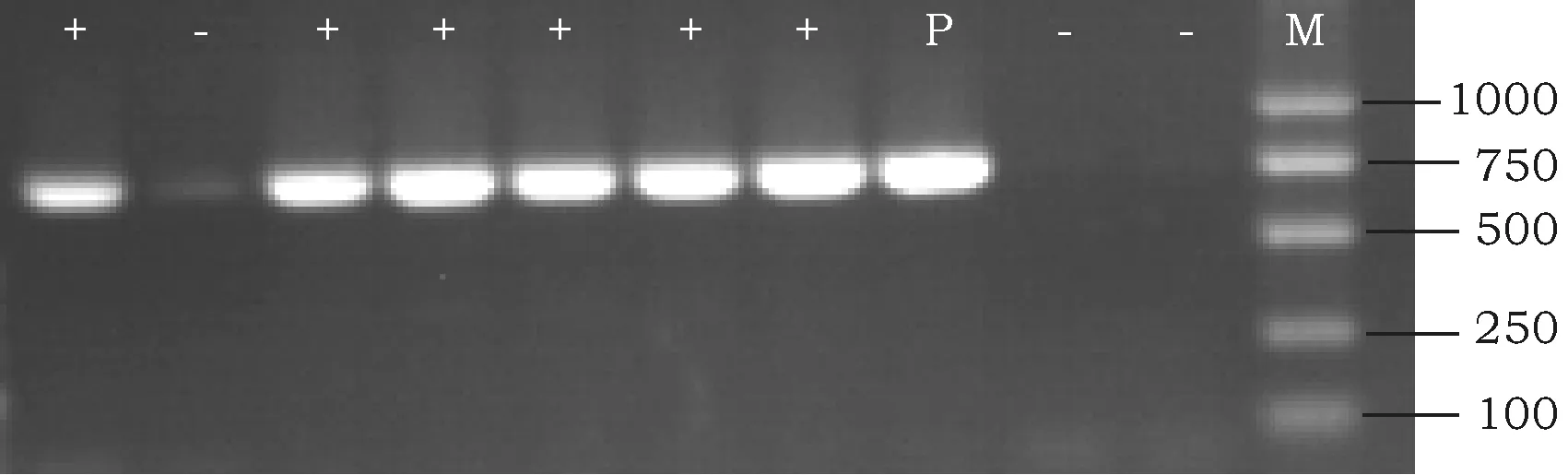
图2 部分转基因棉花PCR检测结果Fig.2 PCR analysis of partial transgenic cotton plantsM:DL2000 DNA Marker; P:质粒Plasmid; +:阳性 Positive;-:阴性 Negative
2.3 植株光合参数分析
与对照相比,转基因株系编号9、17、21、22净光合速率均有不同程度增加,分别提高37.29%、34.09%、35.87%和26.99%;气孔导度在各转基因株系间差异不明显,但比对照明显降低;胞间CO2浓度均比对照降低,分别降低26.56%、14.63%、27.73%和24.56%;蒸腾速率较对照没有显著差异(表2)。

表2 田间光合特性测定Table 2 Determination of photosynthetic parameters of different plants
注:同列不同小写字母表示差异极显著(P<0.05)。下同。
Note:Different lowercase letters show significant difference at the 0.05 level in the same column. The same below.
2.4 植株表型及干物质积累变化
通过转入外源基因在植物体内建立光呼吸支路有望减少能量消耗,预期株型高大,生物量增加[12]。试验结果表明,与对照相比,转基因株系明显株高增加,叶片变大(图3)。编号9和21的株高与对照有显著差异,分别增加16.18% 和13.53%,编号17和22与对照显著性较弱,分别增加12.47% 和10.07%(表3)。植株果枝数和总叶片数与对照比较,均无显著差异。叶片鲜重和干重比CK有不同程度增加,鲜重较CK分别增加21.59%、43.89%、44.25%和29.71%;干重比CK分别增加11.86%、17.79%、17.47% 和11.06%(表4)。

图3 田间表型鉴定Fig.3 Phenotypic identification in the field
3 讨论与结论
C3植物和C4植物由于叶片组织结构不同,其光合作用存在不同的碳固定机制。C4植物中Rubisco羧化性高于氧化性使其光呼吸程度大幅减弱,光合效率显著提高[6, 18]。 抑制植物光呼吸来提高光合效率一直是作物高产研究的重点,但单纯抑制光呼吸并未有效提高光合效率,完全抑制光呼吸甚至会使植物致死[19~22]。研究者们将细菌体内的乙醇酸代谢途径引入拟南芥[12]中建立光呼吸支路,抑制其光呼吸速率,提高了光合效率,且获得的转基因拟南芥株型明显变大,叶面积增加,鲜重和干物质均显著增加。将该代谢途径导入马铃薯[13]中建立光呼吸支路,乙醇酸脱氢酶活性高的转基因株系不仅株型变大,可溶性糖等能量物质积累显著增多,马铃薯块茎的产量也明显增加。利用相似思路在亚麻荠[14]中建立光呼吸支路,转基因株系也实现了光呼吸减弱和光合效率增强,且转基因亚麻荠叶面积变大,油料种子的产量明显增加,氨基酸等多种营养物质含量也明显增多。可见把细菌乙醇酸代谢途径导入C3植物中构建光呼吸支路,可使其光呼吸能量消耗减少,间接提高光合效率,对植物株型、叶面积等产生较大的影响,使植物生物量明显增加。
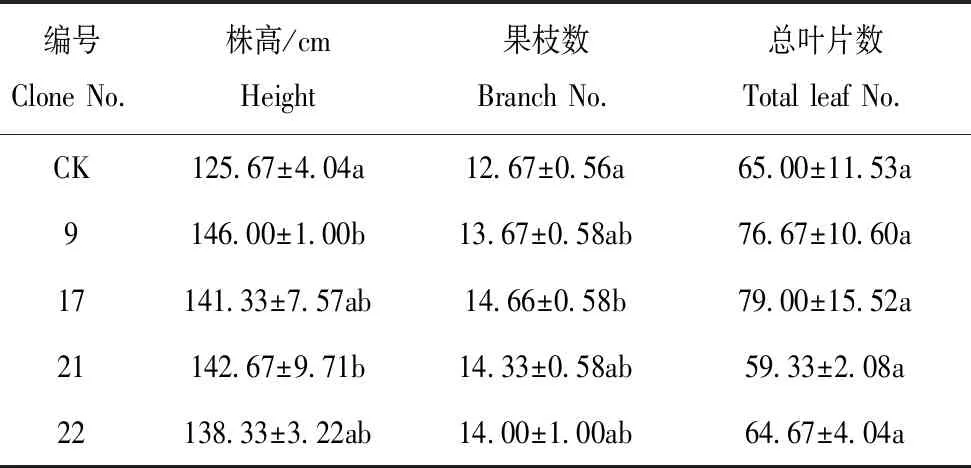
表3 田间性状调查统计Table 3 Statistical analysis of traits in the field
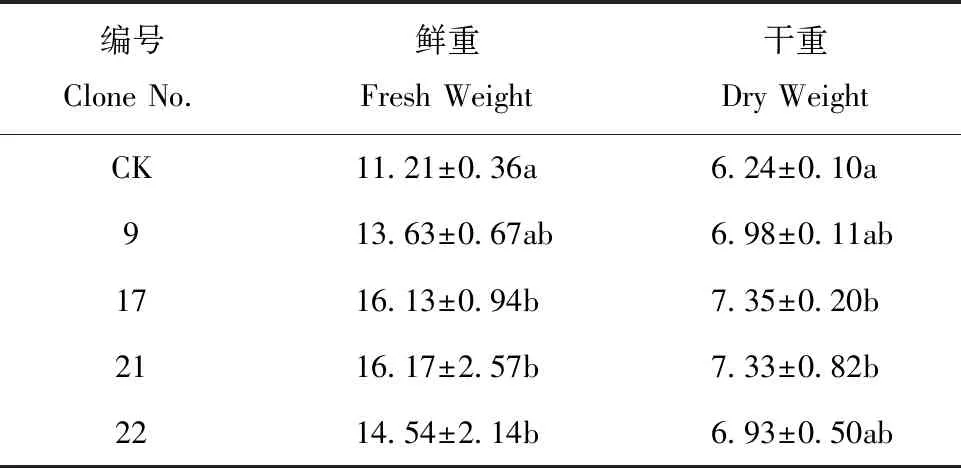
表4 叶片鲜重与干重测定/gTable 4 Determination of fresh and dry weight of leaves
棉花作为C3植物,光合效率受光呼吸影响较严重,通过上述途径改变其光呼吸途径来减弱光呼吸是提高其光合作用率及产量的一种有效办法。本研究将GDH导入棉花受体中,用35S启动子驱动,在棉花植株中构建光呼吸支路。试验结果表明转基因植株净光合效率均比对照提高,而气孔导度和胞间CO2浓度比对照降低,推测光呼吸支路在胞内产生CO2使Rubisco羧化活性增强,胞间CO2被利用导致其浓度降低,而气孔导度降低进一步阻止了胞间CO2浓度的增加。田间转基因植株表现出株高增加,叶片增大特征,同时叶片干物质积累也有显著差异。而果枝数和总叶片数较对照组没有显著差异,这暗示该基因抑制光呼吸减少消耗的能量更多积累到茎干和叶片上使植株高大,而非生长出新叶、新果枝。但田间观察部分转基因株系盛铃期仍有较多花蕾出现,由此推测该基因的导入可能对棉花生殖生长期有影响,需从全生育期角度进一步研究。此外,研究发现不同转基因材料出现高低分离情况,但由于获得转基因植株数量有限,因此不能直观判断是否符合孟德尔遗传分离比,也需要进一步加代获得纯合株系进行深入研究。
本研究将乙醇酸脱氢酶GDH基因导入陆地棉受体,成功获得了转基因再生植株,并通过分子检测筛选出36株阳性转化植株。经田间表型鉴定,发现转基因植株较对照净光合效率提高,株高增加、叶片增大、叶片干物质积累增多。本研究初步探索了一条通过抑制棉花光呼吸来提高光合效率及植株生物量的方法,为今后培育新型高光效棉花及扩充高产棉花种质资源库奠定了基础。
