牦牛皮胶对环磷酰胺致贫血小鼠血象红系参数及脾脏结构的影响
2019-04-03杨红霞王晓喜魏立新杜玉枝
陈 琦,杨红霞,李 雁,王晓喜,魏立新,杜玉枝*
1中国科学院西北高原生物研究所 青海省藏药药理学与安全性评价研究重点实验室,西宁 810000;2中国科学院大学,北京 100049
贫血是一种红细胞数量减少导致组织缺氧的疾病,全球25%的人受其困扰,而且在亚洲人群的发病率最高[1],由于其周期长,病情发展比较缓慢,没有特异性的临床症状,具有极大的隐藏性,对人们的身体健康和生活质量造成严重影响,它对儿童的认知和运动发育产生负面影响,导致普通人群的疲劳和低生产力[2]。
牦牛作为高原特有的牛种,由牦牛的鲜皮经一系列加工制成的皮胶含有丰富的营养成分[3],已有文献发现牦牛皮胶含有20.95%人体必须氨基酸及钙、钠、镁、钾等矿物质元素[4]。而牛皮胶的功效早在《本草纲目》中就有记载——“主治吐血,衄血,下血,血淋,下痢,妊妇胎动血下”,现代研究发现牦牛皮胶对人体的营养性贫血有改善的作用[5]。由环磷酰胺造成的再生障碍性贫血小鼠模型[6]稳定可靠,可作为进一步观察牦牛皮胶的补血功效的疾病模型。观察牦牛皮胶对贫血小鼠脏器系数、血象红系参数及脾脏的形态结构等的影响,为探讨牦牛皮胶的补血机制提供实验基础。
1 材料
1.1 实验药物
环磷酰胺(江苏盛迪医药有限公司生产,生产批号:17090125);牦牛皮:购自青海西宁友谊屠宰场;彩色预染蛋白质分子量标准(上海碧云天生物技术有限公司);甲叉双丙烯酰胺(天津市凯通化学试剂有限公司);过硫酸铵(天津市凯通化学试剂有限公司);三羟甲基氨基甲烷(天津市凯通化学试剂有限公司);TEMED(天津市凯通化学试剂有限公司);SDS(天津市凯通化学试剂有限公司);考马斯亮蓝G250(天津市凯通化学试剂有限公司);阿胶补血颗粒(东阿阿胶股份有限公司,产品批号:1711003)。
1.2 实验动物
SPF级KM小鼠210只,体质量18~22 g,6~8周龄,雌雄各半,所有小鼠在体质量与周龄方面无明显差异,具有可比性;购自甘肃中医药大学科研实验中心,实验动物质量合格证编号:SYXK(甘)2015-0001。
1.3 仪器
电泳仪(BIORAD公司,PowerPac);垂直电泳槽(伯乐生命医学产品有限公司;Mini-PROTEAN Tetra);凝胶成像仪(BIORAD公司,GelDoc 2000);血液细胞分析仪(HORIBA公司,ABX Pentra XL80);电子天平(梅特勒-托利多仪器(上海)有限公司,AL105);超纯水机(四川优普超纯科技有限公司,UPH-I-40L);光学显微镜(Olympus公司,BX41);脱水机(常州市中威电子仪器有限公司,TSJ-Ⅲ);包埋机(常州市中威电子仪器有限公司,BMJ-Ⅲ);切片机(Leica公司,RM2126)。
2 方法
2.1 供试药物的制备
新鲜牦牛皮脱毛脱脂处理后,与蒸馏水以1:10(w/v)的比例,在80 ℃下连续加热搅拌6 h,重复2次,将得到的明胶液体合并,加热浓缩干燥得到牦牛皮胶干粉,其中每1 kg新鲜牦牛皮可得167 g牦牛皮胶干粉。根据实验要求,用蒸馏水溶解牦牛皮胶干粉,分别配制成0.05、0.1、0.15、0.3 g/mL的牦牛皮胶溶液待用。
2.2 SDS-PAGE分析
依照Laemmli等[7]的方法,浓缩胶浓度为5%,分离胶浓度为12%,样品上样量为5 μL。恒压电泳,浓缩胶电压为80 V,分离胶电压为120 V。电泳结束后进行染色,脱色,最后用凝胶成像仪进行成像。
2.3 动物分组
SPF级小鼠210只,雌雄各半,随机分成7组,按中药学药理学研究方法计算给药剂量[8],即空白对照组,模型对照组,牦牛皮胶1 g/(kg·d)给药组,牦牛皮胶2 g/(kg·d)给药组,牦牛皮胶3 g/(kg·d)给药组,牦牛皮胶6 g/(kg·d)给药组,阿胶补血颗粒14.05 g/(kg·d)给药组,每组30只。
2.4 贫血动物模型的建立[8-10]
采用腹腔注射环磷酰胺的方法建立贫血模型,除空白对照组外,其余各组经腹腔注射环磷酰胺80 mg/kg,每日一次,连续4天。空白对照组腹腔注射等量的生理盐水。
2.5 给药剂量与方法
于实验的第5天开始给予受试药物,分别为牦牛皮胶1 g/(kg·d)给药,牦牛皮胶2 g/(kg·d)给药,牦牛皮胶3 g/(kg·d)给药,牦牛皮胶6 g/(kg·d)给药,阿胶补血颗粒14.05 g/(kg·d)给药;各给药组分别连续给药7、14、21天,分别于三个时间点末次给药30 min后,每组各取10只进行眼球后静脉丛取血,血液细胞分析仪分析外周血象红系参数;称取体质量,颈椎脱臼处死后,解剖取出脾脏和胸腺,剥离周围脂肪组织、结缔组织,并用滤纸吸去其表面附着的血液,使用精密电子天平称取脾脏和胸腺的质量,按脏器系数=脏器质量/体质量公式计算脾脏和胸腺系数;取小鼠脾脏,置于4%多聚甲醛中固定、再经脱水、石蜡包埋、切片(约6 μm)、HE染色制作石蜡切片,显微镜下观察脾脏组织结构[11]。
2.6 统计学方法
实验数据用SPSS20.0统计软件进行统计分析,其结果用均数±标准差((x ± s )表示,选用单因素方差分析统计学方法判断结果的显著性,P﹤0.05 表示差异有统计学意义。
3 结果
3.1 牦牛皮胶的分子量分布
由于不同分子量的牦牛皮胶理化性质[12]不同,因此对供试的牦牛皮胶进行了SDS-PAGE分析,图1结果显示了牦牛皮明胶在10~180 kD的分子量范围的SDS-PAGE图谱,可看出被试药物分子量分布广泛,在17~180 kD的范围内均有分布。

图1 牦牛皮明胶的SDS-PAGE图谱 Fig.1 SDS-PAGE pattern of yak skin gelatin M.Molecular weight marker注:M.分子量标记物;A.牦牛皮胶样品。Note:A.gelatin extracted from the Yak skin.
3.2 牦牛皮胶对贫血小鼠一般体征的影响
空白对照组小鼠整个实验过程中皮毛光滑,饮食状况良好,鼻唇颜色淡粉红;造模的第三天起,除空白对照组外各组小鼠的进食量减少,毛蓬竖而且少光泽,耳、眼、尾及四肢的颜色苍白;给予牦牛皮胶和阿胶颗粒后各组小鼠的状况均有改善,逐渐接近空白对照组。
3.3 牦牛皮胶对贫血小鼠脏器系数的影响
表1结果显示,与空白对照组相比,模型组脾脏系数显著升高(P<0.05),提示小鼠在注射环磷酰胺后免疫抑制,脾脏代偿性造血,脾脏体积增大[13],因而脾脏系数增大,说明造模成功。与模型组相比,给药7天,牦牛皮胶1 g/(kg·d)给药组、2 g/(kg·d)给药组、3 g/(kg·d)给药组和阿胶补血颗粒组脾脏系数显著降低(P<0.05);给药14天,牦牛皮胶3 g/(kg·d)给药组和阿胶补血颗粒组脾脏系数显著降低(P<0.05);给药21天,牦牛皮胶2 g/(kg·d)给药组和阿胶补血颗粒组脾脏系数显著降低(P<0.05),说明各浓度牦牛皮胶均能减轻免疫抑制造成的脾脏代偿性造血的状况,且在给药7天时效果最优。
与空白对照组相比,模型组胸腺系数显著降低(P<0.05),提示各组小鼠胸腺萎缩,免疫功能下降,造模成功;与模型组相比,给药7天,牦牛皮胶6 g/(kg·d)给药组和阿胶补血颗粒组胸腺系数均显著升高(P<0.05);给药14天,牦牛皮胶2 g/(kg·d)给药组和阿胶补血颗粒组胸腺系数均显著升高(P<0.05);给药21天,牦牛皮胶1 g/(kg·d)给药组、 2 g/(kg·d)给药组和阿胶补血颗粒组胸腺系数均显著升高(P<0.05),表明各组牦牛皮胶均能使得环磷酰胺造成的免疫功能降低的状况好转,且随给药时间的延长效果越显著。
表1 牦牛皮胶对贫血小鼠脏器系数的影响
注:与空白组相比*P<0.05,**P<0.01;与模型组相比#P<0.05,##P<0.01。
Note:Compare with control,*P< 0.05;**P< 0.01;Compare with model,#P<0.05,##P<0.01.
3.4 牦牛皮胶对贫血小鼠外周血象红系参数的影响
表2及表3结果显示,与空白对照组相比,模型组红细胞数、血红蛋白、红细胞比容、平均血红蛋白量和平均血红蛋白浓度显著降低(P<0.05),说明环磷酰胺造模使小鼠的造血功能抑制,模型建立成功。
与模型组相比,给药7天,1 g/(kg·d)给药组,血红蛋白、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05),2 g/(kg·d)给药组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05),6 g/(kg·d)给药组,平均血红蛋白量显著升高(P<0.01),阿胶补血颗粒组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.01);给药14 d,1 g/(kg·d)给药组,红细胞数、血红蛋白、红细胞比容及平均血红蛋白量显著升高(P<0.05),2 g/(kg·d)给药组和3 g/(kg·d)给药组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05),6 g/(kg·d)给药组,红细胞数、血红蛋白、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05),阿胶补血颗粒组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05);给药21 d,1 g/(kg·d)给药组,红细胞数、血红蛋白及红细胞比容显著升高(P<0.05),2 g/(kg·d)给药组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05),3 g /(kg·d)给药组,红细胞数及平均血红蛋白浓度显著升高(P<0.05),6 g/(kg·d)给药组,平均血红蛋白量显著升高(P<0.05),阿胶补血颗粒组,红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度显著升高(P<0.05)。各给药组的血象红系参数相对模型组均有提高,其中以1 g/(kg·d)给药组的效果最明显,且在给药14天各给药组作用明显。
表2 牦牛皮胶对贫血小鼠血象红系参数的影响
注:与空白组相比*P<0.05,**P<0.01;与模型组相比#P<0.05,##P<0.01。
Note:Compare with control,*P< 0.05;**P< 0.01;Compare with model,#P<0.05,##P<0.01.

表3 牦牛皮胶对贫血小鼠血象红系参数的影响
续表3(Continued Tab.3)
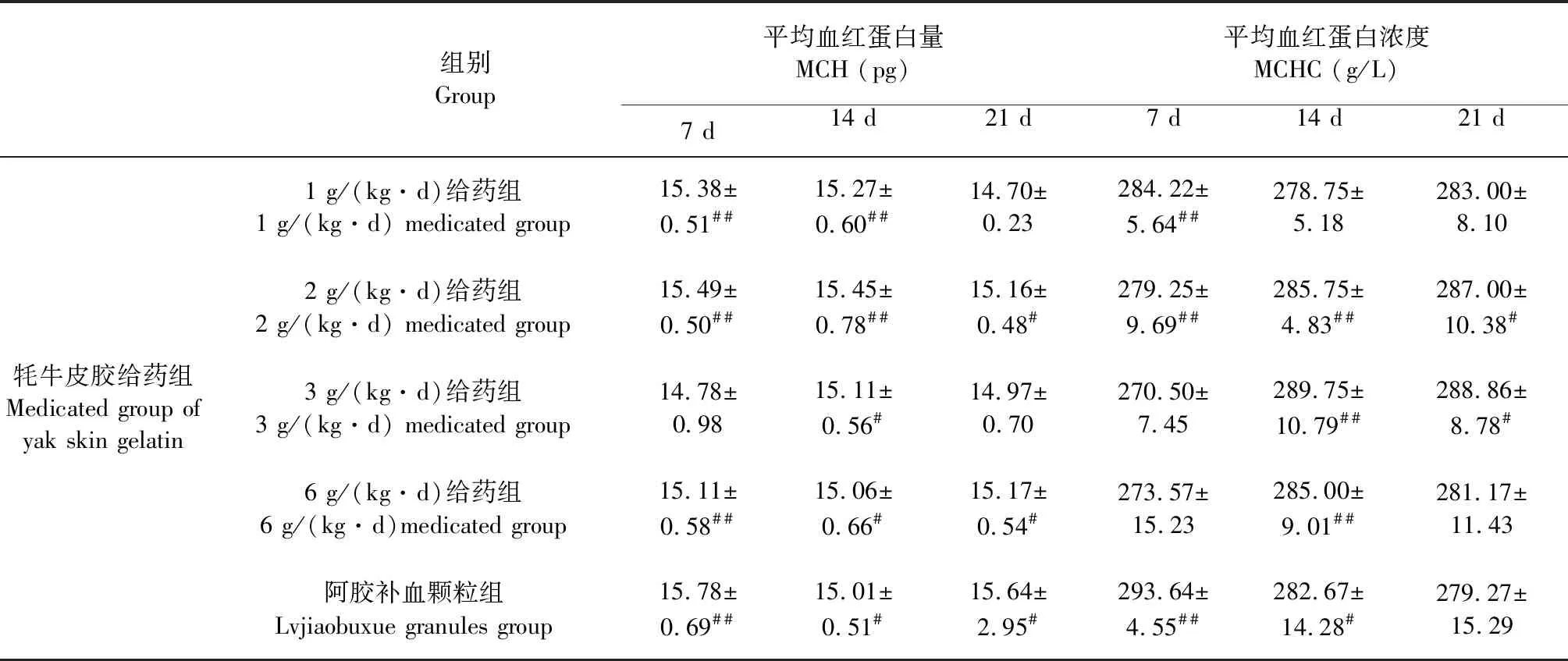
组别Group平均血红蛋白量MCH (pg)平均血红蛋白浓度MCHC (g/L)7 d14 d21 d7 d14 d21 d1 g/(kg·d)给药组1 g/(kg·d) medicated group15.38±0.51##15.27±0.60##14.70±0.23284.22±5.64##278.75±5.18283.00±8.102 g/(kg·d)给药组2 g/(kg·d) medicated group15.49±0.50##15.45±0.78##15.16±0.48#279.25±9.69##285.75±4.83##287.00±10.38#牦牛皮胶给药组Medicated group of yak skin gelatin3 g/(kg·d)给药组3 g/(kg·d) medicated group14.78±0.9815.11±0.56#14.97±0.70270.50±7.45289.75±10.79##288.86±8.78#6 g/(kg·d)给药组6 g/(kg·d)medicated group15.11±0.58##15.06±0.66#15.17±0.54#273.57±15.23285.00±9.01##281.17±11.43阿胶补血颗粒组Lvjiaobuxue granules group15.78±0.69##15.01±0.51#15.64±2.95#293.64±4.55##282.67±14.28#279.27±15.29
注:与空白组相比*P<0.05,**P<0.01;与模型组相比#P<0.05,##P<0.01。
Note:Compare with control,*P< 0.05;**P< 0.01;Compare with model,#P<0.05,##P<0.01.
3.5 牦牛皮胶对贫血小鼠脾脏结构的影响
图2和图3结果显示,空白对照组红髓、白髓界限清楚,脾索内有丰富的淋巴细胞,有较多的脾小体,脾窦无充血;模型组红髓白髓界限不清,淋巴细胞数目和脾小体减少,脾窦充血;给药14天,各给药组可见白髓中淋巴细胞密集,巨噬细胞和巨核细胞明显增多,间质血管扩张充血;给药21天,各给药组可见较多的淋巴细胞,白髓与红髓的界限变清晰。
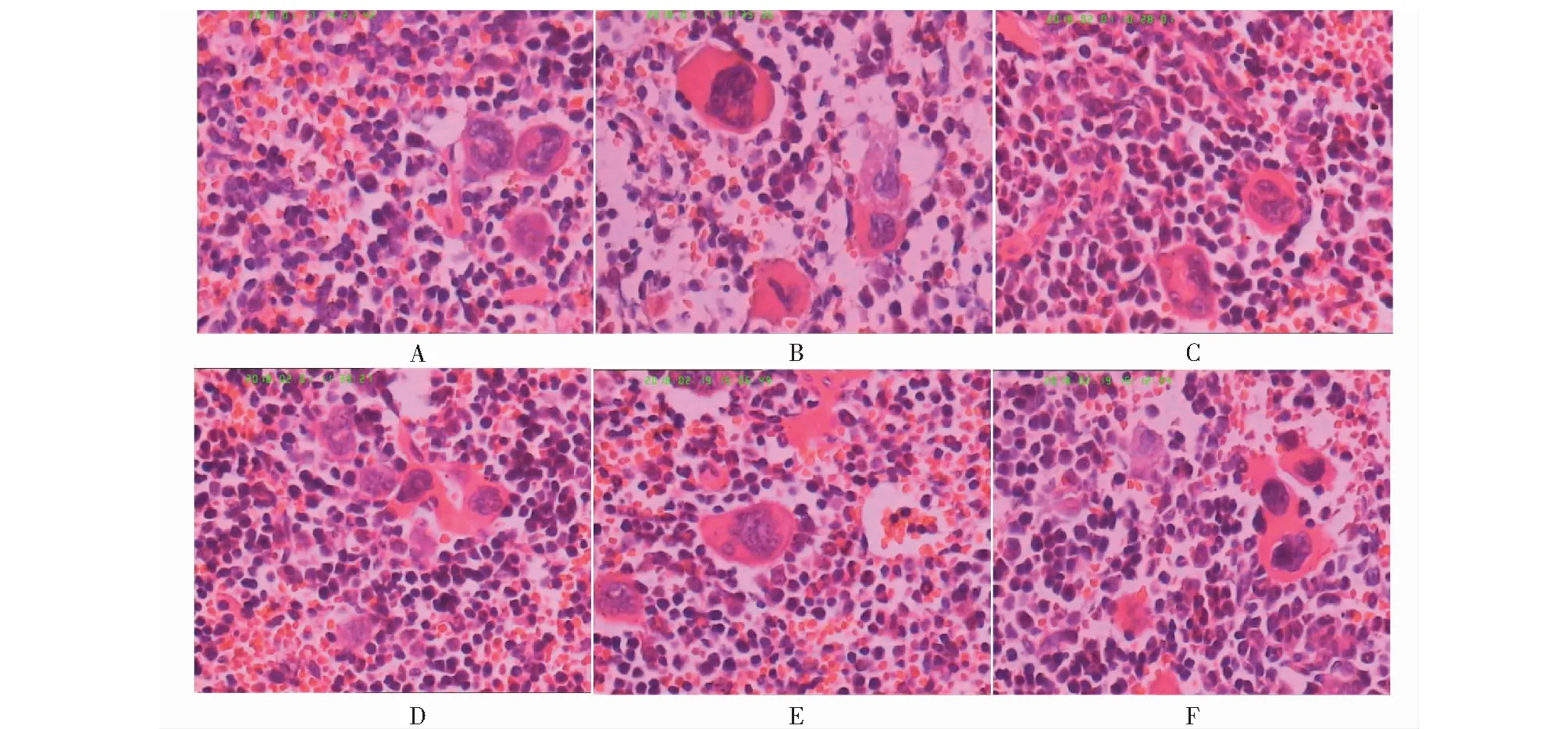
图2 贫血小鼠给药14天脾脏HE染色结果(400×) Fig.2 Results of HE staining of mice with cyclophosphamide-induced anemia for 14 days (400×) 注:A.空白对照组;B.模型组;C.牦牛皮胶1 g/(kg·d)给药组;D.牦牛皮胶2 g/(kg·d)给药组;E.牦牛皮胶3 g/(kg·d)给药组;F.牦牛皮胶6 g/(kg·d)给药组。Note:A.Control group;B.Model group;C.1 g/(kg·d) medicated group;D.2 g/(kg·d) medicated group;E.3 g/(kg·d) medicated group;F.6 g/(kg·d) medicated group.
4 讨论
现代研究已经证实动物皮胶有滋阴补血的功效[14],牦牛皮胶由于它丰富的营养价值,已经作为生物制品用于临床,本实验针对环磷酰胺所致的贫血小鼠的血象红系参数、脏器系数和脾脏的形态结构研究了牦牛皮胶的补血作用。
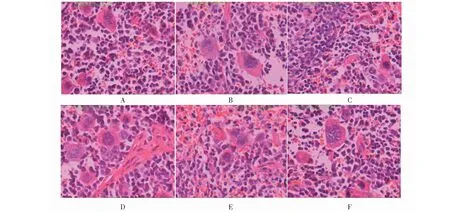
图3 贫血小鼠给药21天脾脏HE染色结果(400×)Fig.3 Results of HE staining of mice with cyclophosphamide-induced anemia for 21 days (400×) 注:A.空白对照组;B.模型组;C.牦牛皮胶1 g/(kg·d)给药组;D.牦牛皮胶2 g/(kg·d)给药组;E.牦牛皮胶3 g/(kg·d)给药组;F.牦牛皮胶6 g/(kg·d)给药组。Note:A.Control group;B.Model group;C.1 g/(kg·d) medicated group;D.2 g/(kg·d) medicated group;E.3 g/(kg·d) medicated group;F.6 g/(kg·d) medicated group.
环磷酰胺作为一种细胞烷化剂,对骨髓细胞有损伤的作用,引起骨髓造血功能降低,进而导致血液中的白细胞、红细胞、血小板等功能成分的降低,造成贫血,同时,环磷酰胺也是一种免疫抑制剂,对机体的免疫器官有损伤的作用[15,16];本研究的实验过程中,随着环磷酰胺给药时间的增加,小鼠精神萎靡,行动迟缓,毛发脱落且没有光泽,进食减少,体重下降,脾脏系数增高,胸腺系数下降,血象红系参数中红细胞数、血红蛋白、红细胞比容、平均血红蛋白量和平均血红蛋白浓度均显著降低,脾脏的正常组织形态被破坏,脾淋巴细胞减少,所有特征符合环磷酰胺致贫血模型的动物特征。
胸腺和脾脏作为重要的免疫器官,是免疫细胞发生、分化、发育和成熟的场所,其系数的变化能体现机体免疫机能的变化[17],给药组小鼠胸腺系数的升高提示牦牛皮胶能逆转环磷酰胺造成的胸腺萎缩的情况,增强机体的免疫功能;同时由于免疫抑制的原因,骨髓造血功能受损,脾脏代偿性髓外造血[18,19],使脾脏的体积增大,脾脏系数升高,牦牛皮胶给药后,脾脏系数的降低说明骨髓造血的功能有一定程度恢复,脾脏的代偿性造血减少。其中除牦牛皮胶6 g/(kg·d)给药组外各给药组在给药7天时均能显著降低胸腺系数,提示牦牛皮胶给药短期内能刺激小鼠的骨髓造血,减弱脾脏代偿性造血。而随给药时间的延长,模型组与空白组差异逐渐减小,说明停用环磷酰胺后小鼠的骨髓造血自行开始恢复;给药组与模型组差异逐渐变小,提示给药周期延长后骨髓造血的恢复同小鼠自然恢复没有差别。除牦牛皮胶6 g/(kg·d)给药组外,其余各给药组在给药21天时均能显著降低胸腺系数,提示牦牛皮胶增强免疫功能的作用需要较长的给药时间,而随给药时间的延长,模型组与空白组差异逐渐减小,说明停用环磷酰胺后小鼠的免疫功能开始恢复,给药组与空白组差异逐渐减小,提示牦牛皮胶给药时间延长时能协同机体自然恢复增强免疫功能直至正常。其中牦牛皮胶2 g/(kg·d)给药组既能恢复免疫功能又能增强骨髓造血功能。
牦牛皮胶给药后,各给药组红细胞数、血红蛋白、红细胞比容、平均血红蛋白量及平均血红蛋白浓度均有升高;随给药时间的延长,模型组与空白组差异减小,但仍有差异,说明停用环磷酰胺后小鼠造血功能逐渐自然恢复,给药组与空白组差异逐渐减小,说明随着牦牛皮胶给药时间延长机体的造血功能也在逐步恢复;其中给药14天时提高贫血小鼠血象红系参数效果显著,提示给药14天补血效果最佳,可拮抗环磷酰胺的骨髓抑制功能。其中牦牛皮胶2 g/(kg·d)给药组在给药7、14、21天时均能升高各血象红系参数,说明该浓度牦牛皮胶补血效果好且持久。
各组贫血小鼠给药后脾脏组织形态逐渐恢复,红髓和白髓的界限逐渐清晰,脾淋巴细胞增多,同时三个不同给药浓度组随给药时间的延长,脾脏的形态结构均逐渐趋近正常,和脾脏系数结果相吻合,都提示牦牛皮胶恢复了机体的免疫功能。
机体的免疫系统和造血系统体系复杂,本研究观察了牦牛皮胶在治疗贫血过程中,对机体的脾脏及血象红系参数的指标影响,其结果可为进一步研究其对免疫系统和造血系统的作用机制和作用方式提供实验依据。
