嗜低温真菌Pseudogymnoascus pannorum次级代谢产物研究
2019-04-03郭永智刘冰语华会明胡友财
郭永智,魏 茜,高 洁,刘冰语,张 涛,华会明,胡友财*
1沈阳药科大学中药学院,沈阳 110016;2中国医学科学院&北京协和医学院药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050
嗜低温真菌(psychrophilic fungi)分布于地球的两极地区、高山多年冻土、冰川、海洋深处等生态系统中,它们长期面临低温、强紫外辐照、频繁的冻融循环、营养物质匮乏、高压等其中一种或多种极端条件的考验[1]。为了适应极端的生存环境,这些真菌形成了特殊的生理代谢特征和化学防御机制,包括冷适应酶的存在、酶活性和代谢速率的改变、胞外多糖及特殊次级代谢产物的生成等[1-4]。近年来,关于极端环境真菌次生代谢产物的研究愈发引起人们的关注,越来越多的具有独特结构的天然产物被从低温真菌中分离得到,许多化合物表现出显著的细胞毒、抗菌、抗病毒和抗氧化等活性[5-7]。
假裸囊菌属真菌(Pseudogymnoascusspp.)是低温环境中常见的真菌类群。Pseudogymnoascuspannorum是假裸囊菌属丝状真菌,主要分布在南极或高山多年冻土中,在-5 ℃的环境中可以生长,最适生长温度为15~18 ℃[8,9]。目前从假裸囊菌属真菌中发现的天然产物非常少[10],而P.pannorum中的次级代谢产物尚无文献报道。本文首次对嗜低温真菌P.pannorum中的次级代谢产物进行分离研究,从其大米发酵产物中分离得到8个化合物,分别为:L-pyroglutamyl-L-phenylalanine(1),(R)-N-acetyl phenylalanine(2),(R)-N-acetyltryptophan(3),methyl 2-hydroxy-4-(3-hydroxy-5-methylphenoxy)-6-methylbenzoate(4),2-hydroxy-4-(2-hydroxy-3-methoxy-5-methylphenoxyl)-6-methylbenzoate(5),vanillic acid(6),1,3,5-三甲氧基苯(7)和亚油酸(8)。其中化合物1和2为首次从天然界分离得到,化合物3~8为首次从假裸囊菌属真菌中分离得到。

图1 化合物1~8的结构Fig.1 Structures of compounds 1-8
1 材料
1.1 仪器与试剂
Jasco P-2000型旋光仪(Jasco公司,日本);Bruker AV-III-500和Bruker AV-III-600 HD型核磁共振谱仪(布鲁克公司,德国);Agilent Technologies 6520 Accurate Mass Q-TOF LC/MS 型质谱仪(安捷伦公司,美国);Waters ACQUITY H-Class QDA超高效液相质谱联用仪(沃特世公司,美国;ACQUITY UPLC BEH色谱柱:1.7 μm,50 mm×2.1 mm,沃特世公司,美国);SSI Series III半制备高效液相色谱仪(科学系统公司,美国;SSI Series 1500 Photo Diode Array Detector检测器;YMC Pack ODS-A色谱柱:C18,5 μm,250 mm×10 mm,YMC公司,日本;Phenomenex Luna Phenyl-Hexyl New Column色谱柱:5 μm,250 mm×10 mm,菲罗门公司,美国);CombiFlash Rf+型中压制备色谱仪(Teledyne Isco公司,美国); MCI CHP 20P/P120填料(三菱化学株式会社,日本);分析纯试剂(乙酸乙酯、丙酮、乙腈、甲醇)购自北京化工厂;色谱纯试剂(甲醇、乙腈)和质谱纯试剂(乙腈、水)购自美国Fisher公司。
1.2 菌种
实验用菌种P.pannorum保藏于中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室。
2 提取与分离
菌株P.pannorum经大米培养基(5 kg)16 ℃培养发酵30天后,将大米发酵物捣碎,加入2倍体积的乙酸乙酯超声提取3次(每次超声2 h),合并提取液,减压浓缩得到乙酸乙酯粗提物56.5 g。
取48.0 g乙酸乙酯提取物采用MCI柱层析分离,以甲醇-水(90∶10,100∶0,v/v)和丙酮进行梯度洗脱,得到组分F1~F3;对组分F1(10.0 g)进行中压快速制备分离(C18柱,25~40 μm,甲醇-水梯度洗脱,5%~100%),得到F1-1~F1-11流份;其中流份F1-2(377.5 mg)经反相制备柱分离(YMC Pack ODS-A柱,乙腈-水等度洗脱,21∶79,0.02% HCOOH,v/v)得到化合物6(5.1 mg)和7(4.6 mg);流份F1-5(211.7 mg)经反相制备柱(YMC Pack ODS-A柱)分离,以乙腈-水(20∶80,0.02% HCOOH,v/v)等度洗脱,得到化合物1(9.3 mg)、2(1.7 mg)和3(2.2 mg);流份F1-8(94.6 mg)采用反相制备柱(YMC Pack ODS-A柱,乙腈-水等度洗脱,59∶41,0.02% HCOOH,v/v)分离,得到化合物4(9.1 mg)和5(6.4 mg)。
另取8.0 g乙酸乙酯提取物进行MCI柱层析分离,以甲醇-水(10%~100%)和丙酮为溶剂系统梯度洗脱,得到11个流份(A~K);对流份I(3.2 g)采用中压快速制备(C18柱,25~40 μm)分离,以甲醇-水溶液(5%~100%)为流动相梯度洗脱,得到化合物8(817.1 mg)。
3 结构鉴定

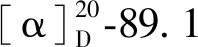

化合物4无色油状;1H NMR (CD3OD,500 MHz)δ:6.30 (1H,d,J=2.0 Hz,H-4),6.24 (1H,d,J=2.5 Hz,H-6),2.47 (3H,s,H-8),6.36 (1H,brs,H-10),6.50 (1H,brs,H-12),6.36 (1H,brs,H-14),2.28 (3H,s,H-15),3.94 (3H,s,CH3O-1);13C NMR (CD3OD,125 MHz)δ:172.8 (s,C-1),109.3 (s,C-2),144.2 (s,C-3),113.3 (d,C-4),163.6 (s,C-5),103.7 (d,C-6),164.9 (s,C-7),23.8 (q,C-8),157.3 (s,C-9),105.7 (d,C-10),159.9 (s,C-11),113.1 (d,C-12),142.2 (s,C-13),113.6 (d,C-14),21.5 (q,C-15),52.4 (q,1-OCH3)。将以上数据与文献对比[17],鉴定化合物4为methyl 2-hydroxy-4-(3-hydroxy-5-methylphenoxy)-6-methylbenzoate。
化合物5无色油状;1H NMR (CD3OD,500 MHz)δ:6.32 (1H,d,J=2.5 Hz,H-4),6.13 (1H,d,J=2.5 Hz,H-6),2.47 (3H,s,H-8),6.69 (1H,d,J=1.5 Hz,H-12),6.44 (1H,d,J=1.0 Hz,H-14),2.26 (3H,s,H-15),3.91 (3H,s,CH3O-1),3.87 (3H,s,CH3O-11);13C NMR (CD3OD,125 MHz)δ:173.0 (s,C-1),108.4 (s,C-2),144.1 (s,C-3),112.4 (d,C-4),164.0 (s,C-5),102.4 (d,C-6),165.2 (s,C-7),23.9 (q,C-8),142.7 (s,C-9),137.7 (s,C-10),150.5 (s,C-11),110.7 (d,C-12),130.3 (s,C-13),115.9 (d,C-14),21.1 (q,C-15),52.3 (q,1-OCH3),56.7 (q,11-OCH3)。将以上数据与文献对比[17],鉴定化合物5为2-hydroxy-4-(2-hydroxy-3-methoxy-5-methylphenoxyl)-6-methylbenzoate。
化合物6白色无定型粉末;1H NMR (CD3OD,500 MHz)δ:7.56 (1H,brs,H-2),6.82 (1H,d,J=8.0 Hz,H-5),7.54 (1H,d,J=9.0 Hz,H-6),3.89 (3H,s,CH3O-3);13C NMR (CD3OD,125 MHz)δ:124.7 (s,C-1),115.8 (d,C-2),148.7 (s,C-3),152.3 (s,C-4),114.0 (d,C-5),125.2 (d,C-6),171.4 (s,C-7),56.2 (q,3-OCH3)。将以上数据与文献对比[18],鉴定化合物6为vanillic acid。
化合物7无色油状;1H NMR (CD3OD,500 MHz)δ:7.33 (3H,s,H-2,4,6),3.88 (9H,s,CH3O-1,3,5);13C NMR (CD3OD,125 MHz)δ:148.9 (s,C-1,3,5),108.4 (d,C-2,4,6),56.9 (q,CH3O-1,3,5)。将以上数据与文献对比[19],鉴定化合物7为1,3,5-三甲氧基苯(1,3,5-trimethoxybenzene)。
化合物8无色油状;1H NMR (CD3OD,500 MHz)δ:5.34 (4H,m,H-9,10,12,13),2.78 (2H,t,J=6.5 Hz,H-11),2.27 (2H,t,J=7.0 Hz,H-2),2.07 (4H,dd,J=13.0,6.5 Hz,H-8,14),1.60 (2H,m,H-3),1.34 (14H,m,7×CH2),0.91 (3H,t,J=6.5 Hz,H-18);13C NMR (CD3OD,125 MHz)δ:178.5 (s,C-1),35.5 (t,C-2),32.8 (t,C-3),30.4 (t,C-4),30.5 (t,C-5,6),30.6 (t,C-7),28.3 (t,C-8,14),129.2 (d,C-9),131.0 (d,C-10,12),26.7 (t,C-11),129.2 (d,C-13),30.9 (t,C-15),26.4 (t,C-16),23.8 (t,C-17),14.6 (q,C-18)。将以上数据与文献对比[20],鉴定化合物8为亚油酸(linoleic acid)。
以上化合物的核磁及其它相关详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
4 体外细胞毒活性筛选
采用CTG发光法将分离得到的化合物(1~8)进行人肝癌HepG-2细胞和人乳腺癌MCF-7细胞的细胞毒活性筛选。
将HepG-2和MCF-7细胞置于75 cm2组织培养瓶中加入含1.5 g/L碳酸氢钠,10%胎牛血清,100 U/mL青霉素和100 U/mL链霉素RPMI 1640培养基,于37 ℃,5% CO2的温箱中培养4天。弃去培养液并用PBS洗涤细胞。加1 mL Trysin-EDTA消化细胞使其达到80%融合。加3 mL DMEM或含FBS的RPMI 1640停止细胞消化。将细胞收集到15 mL离心管中,1 000 rpm离心3 min。弃上清,用3 mL新培养基悬浮成单细胞悬液。于96孔板内接种,每孔100 μL(含3 000个细胞),加筛选的化合物(1~8)和阳性对照药紫杉醇。化合物处理后的细胞在37 ℃下孵育72 h。72 h后,每100 μL培养基加入Cell Titer Glo试剂30 μL。最后,对每块细胞板进行发光检测,结果显示活细胞的ATP水平。
结果表明,化合物1~8对人肝癌细胞HepG-2和人乳腺癌细胞MCF-7未显示细胞毒作用(IC50> 50 μM)。
5 讨论
嗜低温真菌长期生存在低温环境中,为了适应极端的生存条件,它们可能形成特殊的生理代谢特征和特殊的次级代谢产物。P.pannorum为假裸囊菌属嗜低温真菌,本文对其次级代谢产物进行了化学成分的分离研究,共分离得到8个化合物,包括1个非核糖体肽类化合物(化合物1)、2个氨基酸衍生物(化合物2和3)、4个酚酸类化合物(化合物4~7)和1个不饱和脂肪酸(化合物8)。其中,亚油酸(化合物8)为该真菌次级代谢产物的主成分,大量不饱和脂肪酸的形成是否与嗜低温真菌为适应其生存环境而产生的特殊化学防御机制有关有待进一步研究。
