Co-Ce共掺杂对TiO2催化剂室温可见光催化脱硝性能的影响
2019-04-03,,
, ,
(华北电力大学 环境科学与工程系, 河北 保定 071003)
中国NOx污染十分严重,数据显示,2017年中国电力NOx排放量约1.14×109kg,每千瓦时火电发电量NOx排放量约0.25 g[1]。《火电厂大气污染物排放标准》中的规定要求:从2014年1月1日开始,重点地区火电投运机组NOx排放量不得高于100 mg/m3[2]。NOx的控制已成为环境保护和国家经济可持续发展的客观要求,因此,针对燃煤火电厂的脱硝技术已迫在眉睫。
在低温脱硝催化剂的领域,TiO2光催化剂因其具有众多优势而备受关注。此外通过研究发现,对TiO2进行元素共掺的改性可以改善其性能[3]。掺杂元素中,Ce可以改善催化剂储氧性能并增加催化剂表面的酸性位点[4],Co元素也是应用较多、性能较好的一种过渡金属元素[5]。Li等[6]通过浸渍法制备Ce-MNOx/TiO2光催化剂,发现掺杂Ce提高了TiO2表面的氧存储能力并且改善氧的转移速率,因此,其氧化NO的能力增强。Song等[7]采用水解沉淀法制备Co-TiO2光催化剂,研究其光催化性能,发现其对甲基橙降解率高达95%,但其光催化脱硝性能并未研究。李伟等[8]采用浸渍法制备的Ho-Ce-MNOx/TiO2能够提高催化剂的低温脱硝性能。而Co与Ce元素共掺有望实现更低温度下具有较高脱硝效率。
因此,本研究选取金属元素Ce、Co来掺杂TiO2,通过溶胶-凝胶水热法制备Ce-TiO2和共掺Ce-Co-TiO2,并且确定最佳的元素掺杂比,以提高光催化性能、抗中毒能力,并延长催化剂的使用次数,实现节能降耗,降低运行成本。
1 实验部分
1.1 样品的制备
Ce-TiO2的制备:将17 mL的钛酸丁酯逐滴加入快速搅拌的40 mL无水乙醇中,生成溶液A;将40 mL无水乙醇、5 mL冰乙酸、0.209 g硝酸铈和5 mL去离子水加入到分液漏斗中,混合均匀,得到溶液B。室温下将溶液B滴加到溶液A中,慢速搅拌10 min后放入水热合成反应釜内,将反应釜置于烘箱内于160 ℃反应24 h。反应完成后将生成的物质取出置于微波炉中低温烘干约20 min。将干燥后的固体研磨均匀,置于马弗炉中200 ℃煅烧3 h,制得所需TiO2催化剂。
Ce-Co-TiO2的制备仅需将Ce-TiO2制备中的A溶液换成C溶液即可(溶液C:将17 mL的钛酸丁酯逐滴加入快速搅拌下的0.7 g硝酸钴溶解的40 mL无水乙醇中,混合生成。)。
1.2 催化剂的活性评价
光催化脱硝实验在自制的反应装置中进行,实验装置示意图见图1。

图 1 自制光催化反应装置示意图
实验模拟的NO浓度为762和1148 μg/m3。气体经过装置内风扇吹风混合均匀。将20 g活性炭与3 g催化剂迅速置于反应器底部,没有光照条件,暗反应吸附20 min,之后用大气采样器采样,测量暗反应吸附效率。打开光源进行光催化反应,隔20 min取一次样。采样的具体细节为:采样流量为1 L/min,采样10 min,吸收瓶中的吸收液和酸性高锰酸钾均为50 mL。采样后的试样即刻进行吸光度Abs的测量,使用盐酸萘乙二胺分光光度法计算出反应器中NO的浓度,将其和初始空白值进行对比计算,即可得NO脱除效率。
1.3 催化剂的表征
使用SA3100型比表面积和孔隙度分析仪(Beckman Coulter,Inc.)测定样品的比表面积和孔分布;使用TD-3500型的X射线衍射分析仪(丹东通达科技有限公司)检测分析催化剂物相结构表征;表面形貌采用美国FEI公司的QUANTA F250型扫描电子显微镜进行分析;催化剂表面的氨吸附-脱附情况通过北京彼奥德电子技术有限公司的PCA-1200检测仪(NH3-TPD)分析检测;催化剂的元素价态使用EDAX公司的GENESIS型X射线能谱仪(XPS)进行分析。
2 结果与讨论
2.1 催化剂的活性评价
经过大量实验研究,得到最优催化剂的制备条件为:采用溶胶-凝胶水热法,水热反应温度160 ℃,水热反应时间24 h,煅烧温度200 ℃,在以上条件下制备催化剂。在NO浓度为762 μg /m3时掺杂元素对催化性能的影响,结果见图2,高浓度下的催化性能见表1。
图2(a)是不同催化剂的光催化效率的比较。由图2(a)可知,单独掺杂Ce时,在Ce与Ti的物质的量比为1∶100时,催化剂的光催化效率为82.21%,而Co-Ce共掺杂时,在Co、Ce与Ti物质的量比分别为5∶100、1∶100时其光催化效率达到了92.69%,比纯TiO2提高了近50%的效率。图2(b)是不同光照条件下催化剂效率的对比。由图2(b)可知,在光照、催化剂、活性炭均存在时具有最佳的催化活性,效率比没有光照时提高约37%。这说明,掺杂催化剂具有良好的可见光催化性能,与无光照条件的暗反应相比,其催化性能明显提升。由此可见,光照对NO脱除的重要性。
表1表明,即使在较高NO浓度下Co-Ce共掺杂比Zr-Ce和Mn-Ce共掺杂的光催化效率更高。
2.2 BET分析
催化剂的比表面积、吸附量、孔径、孔容等参数见表2和图3。根据IUPAC对吸附脱附回环形状的分类,可以发现Ce(1%)-TiO2、Ce(1%)-Co(5%)-TiO2属于Ⅳ型吸附-脱附等温线,对应于两端开口的圆柱孔内的凝聚和解聚过程,且在0.6-0.9的相对压力下出现由于毛细管凝聚现象而引起的滞后回环,表明样品形成了介孔结构,这与表2中平均孔径测试数据一致。这可能是TiO2的晶粒被Ce抑制,不宜团聚长大,使其比表面积变大;当Co2+进入TiO2晶格时,晶格会产生一定的畸变及应变能,导致催化剂氧空位增加,比表面积变大,脱硝效率提高。

图 2 不同催化剂及光照条件的催化活性

表 1 共掺不同元素的催化效率

表 2 样品表面结构数据
2.3 XRD及SEM分析
图4为三种催化剂的XRD谱图。由图4可知,制备出的催化剂的衍射峰均较为尖锐,催化剂均是结晶完整的锐钛矿型TiO2。此外,Ce3+、Ce4+半径明显大于Ti4+,如果这两种元素进入TiO2晶格,晶胞参数将会发生明显改变,衍射峰将会向小角度偏移,而且衍射峰强度会随掺杂比增加而减小,这表明,Ce掺杂抑制了TiO2晶粒的聚结,因而Ce-TiO2的晶体粒径减小,比表面积变大,催化效率提高[9]。在掺杂Co元素后,Co2+取代TiO2晶格中的Ti4+以形成Co-O-Ti键,使其邻近位置形成氧空位,使得TiO2稳定为锐钛矿型,阻碍其转化为金红石型TiO2[10]。通过Scherrer公式计算得纯TiO2、Ce(1.0%)-TiO2、Ce(1.0%)-Co(5%)-TiO2晶粒粒径分别为13.42、10.88、10.15 nm,与表2测得数据基本相同。

图 3 催化剂的孔径分布及吸附-脱附等温线

图 4 不同类型TiO2的XRD谱图
图5为纯TiO2、Ce(1%)-TiO2、Ce(1%)-Co(5%)-TiO2扫描电镜(SEM)照片。由图5可知,制备的催化剂基本上是球形或类球形,但纯TiO2颗粒团聚度较高,Ce(1%)-TiO2、Ce(1%)-Co(5%)-TiO2颗粒分散度较好,并且分布均匀,掺杂后催化剂的粒径略微减小,因而其比表面积和吸附能力都会增加,这使得掺杂改性后的TiO2性能更为优良。
2.4 UV-vis分析
对商用催化剂和制备出的催化剂进行紫外-可见漫反射吸收光谱分析,处理结果见图6。

图 5 纯TiO2、Ce(1%)-TiO2与Ce(1%)-Co(5%)-TiO2的SEM照片

图 6 紫外可见漫反射光谱谱图
由图6(a)可知, Ce-Co-TiO2催化剂具有最广的光谱吸收范围,因此其具有最高的可见光利用率,最佳的光催化性能。由公式Tauc/David-Mott[11]计算催化剂的禁带宽度。
(ahv)1/n=A(hv-Eg)
(1)
式中,h是普朗克常数;ν是振动频率;α是吸收系数;Eg是能带带隙;A是比例常数;指数n取0.5[12]。计算结果见图6(b),做切线与横坐标交汇,即得出纯TiO2、Ce-TiO2及Ce-Co-TiO2的禁带宽度,分别为2.83、2.54和2.32 eV,均小于商用催化剂的2.92 eV,这更加证明掺杂改性后的催化剂在可见光范围内具有更强的吸收能力。在可见光光照条件下,掺杂Ce的催化剂中Ce3+发生f-f跃迁,致使Ce-TiO2吸收光谱发生红移并使其可见光吸收范围变宽[13],并且此时被Ce替代的Ti较少,与锐钛矿共同作用,具有较高的紫外吸收强度[14];再进行Co元素的掺杂后,使得导带与价带向更低的能带方向移动,使载流子更易受激发而发生跃迁,因此,催化剂会发生更广泛的红移[15]。
2.5 XPS测试分析
对制备所得的纯TiO2、Ce-TiO2、Ce-Co-TiO2催化剂进行XPS元素组成分析,结果见图7。图7(a)为制备的三种催化剂的C 1s谱图,图7(b)为催化剂的Ti 2p谱图,图7(c)为催化剂的O 1s谱图,图7(d)为改性掺杂催化剂的Ce 3d谱图,图7(e)为Ce-Co-TiO2催化剂的Co 2p谱图。
由图7可知,图7(a)和图7 (c)之间最大的差异是纯TiO2催化剂的谱峰位置处于较低能位,而Ce-TiO2和Ce-Co-TiO2的谱峰位置发生向高能位的偏移。由图7(b)可知,掺杂后催化剂的Ti 2p3/2和Ti 2p1/2峰的结合能为458.6和464.3 eV,它们之间的结合能差为5.7 eV,表明Ti元素主要以Ti4+的形式存在。而Ti元素的峰强略有降低,说明+4价的TiO2的形成量降低,与Ti4+相比活性组分相对增加,催化剂活性增强[16]。
由图7(d)可知,Ce 3d谱图主要涉及Ce 3d3/2及Ce 3d5/2谱峰(以字母u和v表示,其中,u3、v3,u1、v1分别表示来源于Ce4+、Ce3+,而u、v及u2、v2是由充满的O 2p轨道跃迁到空的Ce 4f轨道而引起的)[17],由该XPS结果分析可知,Ce掺杂后的催化剂中Ce4+和Ce3+共存,这也证明了Ce4+、Ce3+取代Ti4+进入了TiO2催化剂晶格之中,并且改善了催化剂的性能,这与UV-vis及XRD表征分析结果一致。

图 7 纯TiO2、Ce-TiO2、Ce-Co-TiO2催化剂的XPS谱图
由图7(e)可知,Co 2p3/2及Co 2p1/2的结合能分别约为780.3和796 eV,结合能相差15.7 eV,说明Co元素主要以Co2+的形式存在于催化剂中,并且Co 2p3/2(780.3 eV)高于CoO的标准峰位值(780 eV),这表明在掺杂Co元素之后,其峰位向高结合能方向偏移,可能是样品制备中形成的Co2+并不是堆积在TiO2晶粒表面,而是进入了TiO2晶格内部的原因[18],催化剂的催化性能得以提高。
2.6 NH3-TPD和in-situ DRIFT测试分析
通过NH3-TPD测试分析得出纯TiO2、Ce(1%)-TiO2、Ce(1%)- Co(5%)-TiO2催化剂的表面酸性位分布,其结果见图8。由图8可知,纯TiO2催化剂含有四个脱附峰,而Ce(1%)-TiO2、Ce(1%)- Co(5%)-TiO2催化剂则大致含有五个脱附峰,其中,都有低于200 ℃和高于600 ℃的峰,表明都有弱酸性位点和强酸性位点;最突出的峰型在250-400 ℃,是这三种催化剂NH3脱附的主要酸性中心,属于中强酸位[19]。三种催化剂的峰面积明显表现为纯TiO2、Ce(1%)-TiO2、Ce(1%)-Co(5%)-TiO2依次增大,催化剂的酸量依次增加,表明掺杂Ce元素显著增加了Ce(1%)-TiO2的表面酸位,而掺杂Co元素则进一步增加了催化剂的表面酸位;因此,Ce、Co元素的掺杂使催化剂具有更多的酸量,可以吸附更多的NH3,有利于反应的进行[20]。
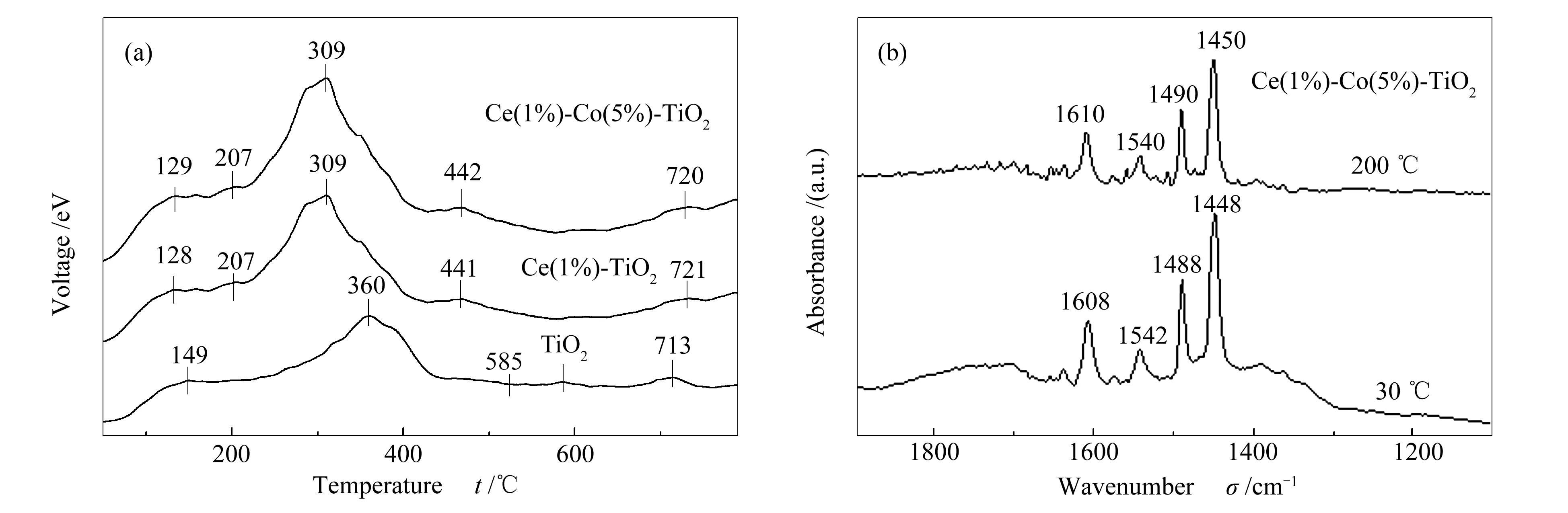
图 8 不同催化剂的NH3-TPD(a)和in-situ DRIFT(b)谱图
图8(b)为对Ce(1%)- Co(5%)-TiO2催化剂的原位红外光谱分析。由图8(b)可知,吡啶吸附在Ce(1%)- Co(5%)-TiO2催化剂上后,在1450和1610 cm-1处出现相对比较强的吸收峰,在这两处附近的吸收峰属于Lewis位酸,在1540 cm-1处出现相对较弱的吸收峰,此处的吸收峰属于Bronsted酸位。充分说明Ce(1%)- Co(5%)-TiO2催化剂存在这两种酸位,可以更好的吸附NH3[21]。
2.7 催化剂抗硫性能及连续使用次数分析
经过实验研究发现,SO2气体会干扰催化剂的光催化性能,但Ce(1%)-Co(5%)-TiO2和Ce(1%)-TiO2(效率都下降6%)的抗干扰能力优于商用催化剂(效率下降10%)。这可能是因为在烟气中存在SO2气体时,催化剂表面的Ce4+会向Ce3+转化,导致其化学吸附氧含量增加[22],增强部分活性位的活性;不过Ce(1%)-Co(5%)-TiO2的抗SO2性能并没有更明显的优势,这可能是由于掺杂Co元素容易在催化剂表面形成Co的硫酸盐导致催化剂中毒,致使Ce(1%)-Co(5%)-TiO2抗SO2中毒能力不能进一步增强[23]。商用催化剂的光催化效率在连续使用三次后低于50%,而Ce(1%)-Co(5%)-TiO2在连续使用九次才低于50%。说明改性共掺TiO2催化剂比商用TiO2催化剂具有更加优良的性能,更长的使用寿命。
2.8 催化剂可见光催化机理分析
根据TiO2光催化的基本原理和实验中得到的NO光催化结果,得到了TiO2光催化氧化NO可能的反应机理:
TiO2+hv→TiO2+e-+h+
(2)
(3)
(4)
h++H2O(ads)→·OH+H+
(5)
NO+2·OH→NO2+H2O
(6)
·O(ads)+NO(ads)→NO2
(7)
4NH3+4NO+O2→4N2+6H2O
(8)
4NH3+2NO2+O2→3N2+6H2O
(9)
4NH3+2NO+2NO2→4N2+6H2O
(10)
根据反应机理可知,光催化氧化过程中可能存在公式(8)、(9)、(10)这三种反应,在这三个反应中,式(10)的反应速率最快,因此,式(10)被认为是光催化反应过程中的主反应。因此,当NO被氧化为NO2,直到烟气中NO2/NO的比为1时,光催化反应具有最大的速率,此时,反应速率会增加一个数量级[9]。因此,式(6)和式(7)中活性物质对NO的氧化效率是影响TiO2光催化氧化NO的因素之一。计算各种催化剂光催化反应中的氧化效率,得到的数据见表3。由表3可知,各种催化剂的氧化率变化与其光催化氧化去除NO的变化规律完全一致,这进一步证明了如果光催化反应中氧化效率提高,则催化剂的光催化去除效率也会随之提高,说明TiO2催化剂确实对NO起到了吸附氧化的作用。
通过表征分析推断出掺杂后的催化剂形成了锐钛矿型TiO2颗粒,催化剂表面酸量增加,因此,吸附在催化剂表面上的H2O增多,H2O可以捕获TiO2光生空穴并转化为·OH自由基,进而提高光生电子与空穴对的分离效率;锐钛矿表面存在氧空位,有更高的氧化效率,通常认为表面羟基氧和表面吸附的O2-是光催化中氧化NO的重要中间体,它能够迅速捕获光生空穴,氧化吸附在表面的NO,减少光生电子和空穴的复合[24-26],延长了光激发载体的寿命,促进光催化反应的进行,最终达到提高催化剂光催化性能的目的。分析UV-vis紫外漫反射谱图也得出相同的结论,Ce(1%)-Co(5%)-TiO2催化剂的禁带宽度明显减小,其对光的利用拓展到了可见光区,因此,提高了光催化效率[26],这也是本实验可以在可见光下进行的重要原因。

表 3 不同类型催化剂光催化反应氧化率
3 结 论
溶胶-凝胶水热法制备出的Ce-Co共掺杂TiO2催化剂具有良好的室温可见光催化活性。与商用催化剂相比,Ce(1%)-Co(5%)-TiO2催化剂对NO的氧化效率和光催化效率都提高了近30%。说明适量掺杂Ce与Co可以提高TiO2对可见光的利用率,使得原本在高温下进行的反应在室温下即可进行,减少了脱除NO时的能源消耗,降低了脱硝成本。
通过多种表征方法研究了TiO2、Ce-TiO2和Ce-Co-TiO2的光催化作用机理。结果表明,适量的掺杂Ce与Co可以增大催化剂的比表面积,进行光催化的面积也随之扩大,并且使其在低温环境下具有更强的吸附性能。Co掺杂后TiO2形成Co-O-Ti键,导致其近邻位置形成氧空位,对锐钛矿型TiO2产生稳定作用,阻碍其向金红石型转变。Ce-Co共掺催化剂的吸收光谱发生了红移,拓宽了可见光吸收范围,提高了对可见光的利用率,提高了催化剂的光催化活性,还降低了催化剂的工作温度,从而使催化剂更加高效节能。
