脂肪因子在运动介导骨免疫调控骨重构进程的机制研究进展
2019-04-03袁子琪李世昌宗博艺
袁子琪,李世昌,孙 朋*,宗博艺
随着骨免疫学的提出,越来越多的研究关注于免疫与骨重构的关系(Zhao et al.,2016)。脂肪组织作为一种骨免疫内分泌器官,分泌脂肪因子通过骨免疫机制作用于骨重构(Ginaldi et al.,2016;Sulston et al.,2016)。脂肪因子作为免疫与骨重构的共调节因素,可以影响免疫细胞、成骨细胞(osteoblast,OB)及破骨细胞(osteoclast,OC)的功能,进而调节骨重构方向(Choi et al.,2017)。研究发现,脂肪因子与骨质疏松、肥胖、类风湿性关节炎等病症密切相关(Opatrilova et al.,2018;Weber et al.,2017)。在骨免疫系统中,脂肪因子可分为促骨吸收性脂肪因子和抗骨吸收性脂肪因子。其中,瘦素(leptin)、内脂素(visfatin)、抵抗素(resistin)等促骨吸收性脂肪因子作用于免疫细胞,上调促炎性细胞因子,如白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,继而上调NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)促进骨吸收(Lee et al.,2018;Ouchi et al.,2011)。而脂联素(adiponectin,ADPN)作为一种抗骨吸收性脂肪因子,能够抑制TNF-α等促炎细胞因子,并诱导IL-1受体拮抗剂(IL-1 receptor antagonist,IL-1 RA)、IL-10等抗炎因子的产生,抑制RANKL并上调骨保护素(osteoprotegerin,OPG)表达,从而抑制骨吸收,促进骨形成(Straub et al.,2015)。分泌型卷曲相关蛋白-5(secreted frizzled related protein 5,sFRP5),抑制Wnt5a(wingless-type MMTV integration site family, member 5a)介导的炎症细胞因子产生。这些脂肪因子的交叉作用可能是肥胖中导致炎症状态以及骨流失的原因之一(Wang et al.,2018)。因此,本文同时也为肥胖与骨质疏松的关系做出一定的解释。运动通过调控脂肪因子水平,进而通过脂肪因子介导的骨免疫影响骨重构。
1 免疫系统对骨重构的调控
免疫系统通过免疫细胞因子调控骨保护素—NF-κB受体活化因子配体—NF-κB受体活化因子(OPG-RANKLRANK)信号系统(图1),进而调控骨重构(Gu et al.,2017;Hajishengallis et al.,2016)。OPG-RANKL-RANK轴 是 调控骨吸收,进而维持骨代谢平衡的重要信号系统(Xu et al.,2016)。RANKL属 于TNF受 体(tumor necrosis factor receptor,TNFR)配体家族,其与RANK结合后,诱导核转录因子激活蛋白1(nuclear transcription factors activate protein 1,AP-1)和T细胞活化核因子(nuclear factor of activated T cells 1,NFATc1)的表达,导致OC前体融合与OC分化,加强骨吸收(Takayanagi,2007)。OPG属于TNF超级受体家族,作为RANKL的假性受体与RANK竞争性结合RANKL,抑制OC分化,进而抑制骨吸收(Criscitiello et al.,2015)。TNF-α、IL-1、IL-6和IL-17等促炎因子加强RANKL-RANK信号级联,促进OC生成,加强骨吸收;IL-4、IL-5、IL-10、IL-18和干扰素-γ(interferon-γ,IFN-γ)等抗炎细胞因子抑制RANKL-RANK结合,上调OPG表达,抑制OC生成,抑制骨吸收(Haumer et al.,2018;Arboleya et al.,2013)。
T细胞活化会导致上述相关免疫细胞因子的产生增加,从而调控破骨细胞的形成。Th1(T help type 1)细胞与Th2(T help type 2)细胞主要通过分泌IFN-γ、IL-4等因子抑制破骨细胞的生成,固有免疫条件下,其可以促进RANK尾部TRAF6降解,进而阻断RANKL-RANK信号级联 (Caetanolopes et al.,2009)。Th17(T help type 17)细胞主要产生IL-17诱导破骨细胞前体RANK的表达,募集并激活巨噬细胞,使其产生IL-1、IL-6、TNF-α等促炎细胞因子,进而上调RANKL的表达,促进破骨细胞的分化和生成(Adamopoulos et al.,2010)。调节性T细胞(regulatory T cell,Treg)分泌抑制破骨细胞生成的细胞因子IL-4,IL-10以及转化生长因子-β(transforming growth factor β,TGF-β),从而抑制骨吸收,促进骨形成(Pacifi ci,2016)。目前关于B细胞与骨代谢的研究较少,但B细胞能分泌OPG,促进成骨细胞的生成和分化, B细胞在雌激素缺乏情况下可增强RANKL表达,导致破骨细胞数量增加。此外,T细胞表达雌激素受体,当雌激素缺乏时T细胞增殖活化,导致IL-6、TNF-α等促OC生成因子增多,是绝经后骨质疏松形成的主要原因之一(潘利平等,2015;Manabe et al.,2001)。研究发现,在骨损伤发生时,巨噬细胞在骨微环境内通过分泌骨形态发生蛋白(bone morphogenetic proteins,BMPs)以及制瘤素M(oncostatin M,OSM),从而促进成骨细胞生成,提示免疫细胞在骨损伤状态下对骨修复产生着重要的作用。(EL-Jawhari et al.,2016;Schlundt et al.,2018)。
除了对骨吸收的调控,免疫系统还通过Wnt信号通路,调控OB介导的骨形成。骨髓微环境中T淋巴细胞表达Wnt10b,Wnt10b通过旁分泌启动成骨细胞Wnt/β-catenin通路(Cawthorn et al.,2012;Wei et al.,2011)。Wnt/β-catenin转导途径属于Wnt经典信号通路,其被激活后诱导OB分泌OPG,并促进骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)向OB分 化(Baron et al.,2013;Kramer et al.,2010)。 最近研究发现,Wnt信号通路能够调控免疫细胞的功能,并在炎症应答中扮演着重要角色(Chae et al.,2018)。血清Wnt5a水平与肥胖程度和血清IL-6水平呈显著正相关,而IL-6、TNF-α的刺激可显著上调Wnt5a在单核/巨噬细胞中的表达(Rauner et al.,2012;Relling et al.,2018)。巨噬细胞以自分泌形式分泌Wnt5a,通过Wnt非经典信号Frz5-CAMKII转录途径诱导IL-6,IL-1β等促炎因子的产生,当肥胖发生时Wnt5a水平升高,提示Wnt5a介导肥胖引起的炎症,并通过炎症细胞因子间接促进骨吸收(Schaale et al.,2011)。Wnt5a是非经典Wnt信号Wnt/Ca2+途径的关键因子,其通过CAMKII-TAK1-TAB2-NLK途径抑制PPARγ,并上调RUNX2表达水平,促进BMSC向OB分化,从而促进骨形成。值得注意的是,最近的研究表明,非经典Wnt信号通路通过Wnt5a与经典Wnt信号通路协同调控骨形成(Okamoto et al.,2014;Takada et al.,2007)。综上所述,Wnt5a作为关键的Wnt通路信号分子,除了促进OB生成外,还可以通过骨免疫机制间接调控骨吸收。
2 脂肪因子对骨免疫系统的调控
脂肪组织分泌大量具有生物活性的蛋白,在肥胖、骨代谢等生理病理状态中发挥重要作用(Alipoor et al.,2018;Junker et al.,2017)。瘦素、内脂素和抵抗素诱导免疫细胞分泌促炎细胞因子,作用于RANKL-RANK轴,促进骨吸收。脂联素拮抗这一过程,起到抑制骨吸收,促进骨形成的作用。sFRP5一方面抑制Wnt5a信号诱导的OB形成,加剧骨吸收;另一方面通过抑制Wnt5a介导的促炎作用,间接抑制骨吸收(表1)。肥胖状态下促炎性脂肪因子水平升高,脂联素和sFRP5水平下降,这些脂肪因子是肥胖导致炎症和骨流失的原因之一。
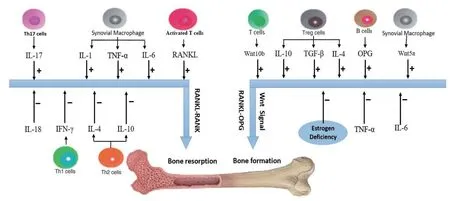
图1 免疫细胞因子调控骨重构的骨免疫机制Figure 1. Schematic Diagram of the Mechanism of Osteoimmunology of Immune Cytokines Regulating Bone Remodeling

表1 脂肪因子种类及其对骨免疫影响Table 1 The Types of Adipokines and Their Effects on Osteoimmunology
促炎性脂肪因子水平在类风湿性关节炎(rheumatoid arthritis,RA)等慢性炎症患者中显著升高(Brentano et al.,2007;Straub et al.,2015),提示其介导炎症所致的骨流失。瘦素刺激外周血液单核细胞与B细胞分泌TNF-α、IL-6等促骨吸收炎性因子,并抑制Treg细胞分泌IL-4等保护性因子(Wong et al.,2007)。此外,瘦素诱导T细胞向Th1细胞分化,Th1细胞通过IFN-γ上调OPG(高超 等,2010)。RA患者血清抵抗素水平与IL-6等炎症因子水平呈正相关(bokarewa et al.,2005)。抵抗素激活NF-κB信号通路,上调外周血单核细胞TNF-α、IL-6以及IL-1β的表达水平(Reilly et al.,2005)。炎症状态下内脂素与患者骨密度(bone mineral density,BMD)呈负相关,内脂素诱导RA患者骨微环境IL-6、IL-8水平提高,促进RANKL-RANK结合加剧骨吸收(Moschen et al.,2010;Oki et al.,2010)。脂联素是外周血中浓度最高的脂肪因子(Pal et al.,2018)。脂联素抑制M1型巨噬细胞活化,促进M2型巨噬细胞增殖,从而抑制促炎细胞因子产生(Stolarczyk ,2017)。此外,脂联素诱导单核/巨噬细胞、Treg细胞产生抗炎因子IL-4、IL-10及IL-1RA,抑制RANKL-RANK级联(Wolf et al.,2004;Yokota et al.,2000)。最近发现,脂联素可能具有促炎作用,促进RA等炎症状态下的骨流失(Junker et al.,2017),有待于进一步研究。由于Wnt5a对骨代谢的调控具有双向性,sFRP5作为Wnt5a信号的阻断剂对骨重构的调控也具有双向性。sFRP5与Fz蛋白受体竞争性结合Wnt信号分子,抑制Wnt5a介导的经典/非经典Wnt信号,然而骨髓脂肪组织sFRP5水平与BMD呈正相关,sFRP5阻断Wnt5a激活的Wnt信号,抑制骨微环境Wnt5a介导的促炎作用,间接促进骨形成(Chen et al.,2017;Schaale et al.,2011)。此外,炎症状态下sFRP5通过阻断Wnt5a/Ror2通路下调RANK表达,从而抑制OC生成,抑制骨吸收(Maeda et al.,2012;Martineau et al.,2017)。
3 运动对脂肪因子的调控
长期运动能够抑制促骨吸收性脂肪因子水平,上调抗骨吸收性脂肪因子,进而调控免疫微环境,通过骨免疫机制抑制骨吸收,促进骨形成(图2)。已有研究证明,长期运动显著提高脂联素水平,降低瘦素、内脂素及抵抗素水平(表2),并伴随身体质量指数(body mass index,BMI)、体脂百分比等肥胖评价指数下降。已有研究表明,急性中、小强度运动对脂肪因子水平无显著性影响;急性大强度运动使脂肪因子产生暂时性变化。国内外鲜见运动对sFRP5影响的研究,但有研究表明,血清sFRP5水平与肥胖程度呈负相关,适宜运动可能通过减轻人体肥胖程度,从而提高sFRP5水平。但目前关于运动对sFRP5的影响机制尚不清楚。

图2 脂肪因子影响骨重构的骨免疫机制Figure 2. Adipokines Affect Bone Remodeling through the Mechanisms of Osteoimmunology

表2 运动对脂肪因子的影响Table 2 Effect of exercise on adipokines
3.1 运动对脂肪因子的慢性影响
长期运动有效抑制体内瘦素水平(Fedewa et al.,2018)。Nadia 等(2013)研究表明,6个月中等强度自行车训练显著降低血清瘦素水平,并上调外周脂联素水平。Azizi等(2011)对24名女受试者进行8周中等强度有氧运动,结果显示,运动组血浆瘦素水平显著降低。另有研究表明,持续5周高强度间歇训练也可以降低体内瘦素水平(Caldeira et al.,2018)。Amir等(2013)的研究中,健康女性受试者进行8周中等强度有氧运动后,血浆抵抗素水平显著降低。Jones等(2009)对超重青少年受试者实施了32周中等强度有氧运动训练,结果显示,受试者血浆抵抗素水平与体脂百分比较运动干预之前显著降低。柏友萍等(2013)的研究中,30名超重/肥胖大学生进行8周中等强度有氧运动后,受试者血浆抵抗素水平显著性下降。值得注意的是,上述研究中瘦素、抵抗素水平的降低均伴随着BMI、体脂百分比等肥胖评价指数的下降。Seo等(2011)对10名中年肥胖妇女进行12周的组合运动,运动干预后受试者血清内脂素水平显著降低。Choi等(2007)对48名中年女性进行12周有氧运动训练,结果与Seo的研究结果一致——血清内脂素水平降低,伴随受试者BMI、腰臀比等肥胖指标下降。Lee等(2010)对11名肥胖女性大学生进行了12周的中等强度有氧运动训练,结果显示,干预前受试者血清内脂素水平显著高于健康女大学生,而干预后血清内脂素水平显著降低,提示长期运动可以降低血浆内脂素水平。
Wang等(2015)对绝经后肥胖/超重妇女受试者进行热量摄入控制(20周),并随机分出48名在热量控制的同时进行20周中等强度有氧运动训练,结果显示,运动组血清脂联素水平高于控制组,提示长期有氧运动可以改善循环脂联素水平。Kondo(2006)对8名年轻肥胖女性受试者进行了7个月中等强度的运动训练,研究显示受试者脂联素水平较受试前显著升高。Racil等(2013)将受试者分为运动组和对照组,其中运动组分为大强度间歇运动组和中等强度间歇运动组,持续12周,运动干预后,大强度间歇运动组血清脂联素水平显著高于中等强度间歇运动组,提示大强度运动或大强度间歇运动可能是改善循环脂联素水平的最佳运动方式。Racil、Kondo与Wang的研究中,脂联素水平的升高均伴随着肥胖指标的下降,提示虽然多种组织分泌脂肪因子,但是脂肪因子水平与脂肪比例高度相关。综上,长期运动能够抑制瘦素、内脂素和抵抗素水平,上调脂联素水平,并伴随肥胖指标下降。
3.2 运动对脂肪因子的急性影响
Weltman等(2000)对27名健康男性受试者进行一次性30 min中等强度运动,结果显示,血清瘦素水平无显著性变化。Sari等(2007)研究表明,一次性中等强度运动不会引起外周瘦素水平变化。Jamurtas等(2006)的研究中,9名受试者进行一次性45 min中等强度有氧运动,研究结果显示,运动后的48 h内,受试者血浆脂联素及抵抗素水平未发生显著变化。Yahya等(2014)的研究中,14名中年肥胖男性受试者进行一次性中等强度跑步运动,持续时间40 min,结果显示,受试者运动前后的血浆抵抗素水平无显著性变化。Ghanbari等(2010)的研究表明,急性大强度无氧运动会使血浆内脂素水平显著提高。该研究中,6名健康年轻男性进行7组冲刺跑,结果显示,在一次性大强度无氧运动后血浆内脂素、胰岛素以及葡萄糖水平均有显著性的增高,但是在运动结束45 min后,除了乳酸之外的各项指标均恢复至基础水平。有研究对9名赛艇运动员进行2 h亚最大强度划船训练,结果显示,血浆内脂素、瘦素水平在运动后30 min显著降低(Jurimae et al.,2009),这可能与内脂素为满足能量需求参与胰岛素敏感性调节有关。Punyadeera等(2005)的研究中,10名受试者按照50%V.O2max强度进行2 h自行车运动,结果显示,运动前后血浆脂联素水平无显著差异。Jurimae等(2005)对8名赛艇运动员进行6.5 km最大强度赛艇训练,结果发现,在运动后即刻,受试者血浆脂联素水平未发生显著性变化,而在运动结束后30 min,血浆脂联素水平上升至显著差异水平。Ferguson等(2004)的研究中,16名受试者进行1 h 65%V.O2max的急性运动,结果显示,运动前后的血清脂联素水平未发生显著变化。综上,急性中/小强度运动对脂肪因子水平均无显著影响;而一次性大强度运动使外周瘦素水平降低,内脂素和脂联素水平升高,然而这种变化可能属于暂时性影响。此外,能量代谢需求变化也是脂肪因子产生相应变化的原因之一。
4 总结与展望
长期运动能够下调瘦素、内脂素、抵抗素水平,提高脂联素水平,进而抑制促骨吸收免疫细胞因子水平,上调OPG表达水平,并抑制RANKL,抑制破骨细胞活性,促进骨形成,抑制骨吸收。急性中、小强度运动不会影响脂肪因子水平,急性大强度运动会对瘦素、脂联素、内脂素造成短暂影响,运动后短时内便恢复至基础水平。长期运动可能通过改善脂代谢从而提高sFRP5水平,然而运动具体调节机制尚不清楚。以前研究认为,肥胖通过增加机械应力信号从而起到骨保护作用,而近期研究发现,肥胖可能增加骨质疏松风险。本研究对肥胖与骨质疏松关系进行梳理,当肥胖症发生时,人体促骨吸收性脂肪因子水平上调,加剧炎症的同时促进骨吸收;而抑制骨吸收的脂肪因子如脂联素与肥胖呈负相关,导致炎症的加剧,抑制骨吸收的作用减弱,两者共同导致了肥胖炎症的发展以及骨质疏松的发生。在不同强度运动的干预下,可能会引起骨吸收和骨形成平衡的差异,其具体机制尚不完全清楚。此外,更多的研究集中在骨髓脂肪组织与肿瘤骨转移,以及骨相关疾病的关系,但是骨髓脂肪组织对骨代谢等生理病理状态的影响,以及运动调节机制尚不清楚,有待于进一步探索。
