猪流行性腹泻病毒云南流行毒株分离与鉴定
2019-04-01孙显国毕峻龙左庆威杨贵树尹革芬
孙显国, 毕峻龙,2, 赵 谦, 蓝 睿, 左庆威, 杨贵树, 尹革芬*
(1.云南农业大学 动物医学院, 云南 昆明 650201; 2.楚雄州动物疫病预防控制中心, 云南 楚雄 675000)
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcineepidemic diarrhea virus, PEDV)引起猪的一种急性、高度传染性肠道疾病,多冬季爆发。近年来,在比利时、日本、墨西哥、加拿大、泰国等多个国家和中国多个地区均报道了该病的流行。PEDV的发生给养殖业造成巨大经济损失,虽然疫苗的应用有效地控制了该病发生,但直至目前该疫情在云南地区仍有不同程度的流行[1]。
PEDV属于冠状病毒,病毒粒子核酸为线性单股正链RNA,基因组核酸具有感染性,病毒基因组在胞浆中进行复制。主要的结构蛋白有纤突蛋白(Spike,S)、膜蛋白(Membrane,M)、核衣壳蛋白(Nucleocapsid,N)和小膜蛋白(small Membrane,E)[1]。S蛋白是位于病毒粒子表面的糖基化纤突蛋白[2],S基因编码分子量20~32 kDa,由1 383个氨基酸组成[3]。S基因是PEDV基因组中最可变的基因之一,目前在我国流行的PEDV毒株S基因具有特征性变异,根据这一特征性变异可区分流行毒株和经典毒株,并为疫苗的选择提供理论依据[4]。2016年冬季以来,流行性腹泻在云南省多个猪场暴发流行并呈现新的流行特征,接种过猪流行性腹泻疫苗的猪也未能幸免,高发病率和高致死率给猪场造成重大的经济损失。针对当前流行的猪流行性腹泻,试验从云南某猪场采集了20份仔猪腹泻粪便样品进行检测,对阳性样品进行病毒分离和对PEDV S基因的克隆测序分析,以便于进一步了解和掌握PEDV在云南省的流行状况,有助于控制和预防PED,并为新疫苗的开发和疫苗的选择提供参考。
1 材料与方法
1.1 样品来源
20份仔猪腹泻粪便样品于2017年5月采自云南某猪场。
1.2 样品处理
将RT-PCR检测出的阳性样品经处理后加入M199培养基及双抗(青链霉素)4℃过夜,次日于4℃ 10 000 r/min离心10 min取上清液,上清液用0.22 μm的过滤膜过滤后分装,于-80℃保存备用。
1.3 试剂
细胞株:Vero细胞(非洲绿猴肾细胞),购于中国科学院昆明细胞库;M199、胎牛血清(fetal bovine se,FBS)、青霉素-链霉素双抗、0.25%胰酶购于gibco公司;核酸提取及PCR及qPCR相关试剂试剂:RNAiso Plus购于大连宝生物公司;qPCR:IScriptTM cDNA Synthesis Kit、反转录试剂:SsoFastTM EvaGreen Supermix购于BIO-RAD公司;IFA试剂:多聚甲醛、Triton X-100、脱脂奶粉、DAPI等购于上海碧云天公司;抗淬灭剂购于invitrogen公司;鼠源抗猪PEDV单抗购于美国vmrd公司(货号:S1D12);FITC标记的羊抗鼠二抗购至invitrogen公司(货号:A11001),pMD18-T 及 T4 Linkase 均购自 TaKaRa 公司。
1.4 样品检测
按照RNA提取试剂盒提取样品中总RNA,利用反转录试剂盒制备cDNA。以总RNA为模板利用引物对样品进行PEDV的RT-PCR 检测(表1),产物经1%的琼脂糖凝胶电泳检测。

表1 PEDV扩增引物序列Table 1 PEDV amplification primer sequences
1.5 病毒的初步分离
选取PEDV RT-PCR检测阳性样品作为分离病毒的病料。将处理过的阳性病料悬液,接种至6孔细胞培养板中已长满的单层Vero细胞,同时按30 ng/mL浓度添加胰酶,置于37℃ 5%CO2感染作用1.5 h,1.5 h后弃去其中的液体,再加入含10 ng/mL浓度胰酶的M199培养基至3 mL,置于37℃ 5%CO2培养,逐日观察并记录细胞的变化情况。如果4~5 d仍无病变,收毒,冻融3次,将上代细胞培养物按上述方法继续传代,每代细胞盲传物均用RT-qPCR检测病毒载量。
1.6 间接免疫荧光(IFA)鉴定病毒
预先将Vero 细胞在96孔细胞培养板中培养,待细胞长至80%左右时开始接毒。每孔保证病毒液100 μL,37℃感染作用1.5 h后将培养基换成含胰酶的M199 培养基,置于37℃、5%CO2的细胞培养箱中继续培养。同时,设立试验组(接毒组)和对照组(不接毒)。接毒48 h后对病毒进行IFA 鉴定,在荧光倒置显微镜下观察检测结果。
1.7 病毒感染力的滴定
Vero细胞在96孔细胞培养板中正常培养,待细胞长至80%左右时开始接毒。将毒力稳定的第15代病毒进行连续10倍稀释,从10-1~10-10。吸取每一稀释度的病毒液100 μL,加入到96孔细胞培养板中,每一稀释梯度的病毒液接种6个细胞孔,37℃感染作用1.5 h后将培养基换成含30 ng/mL胰酶的M199培养基,置于37℃ 5%CO2的细胞培养箱中继续培养。逐日观察细胞病变(CPE)情况,直至终点,用Reed-Muench两氏法计算TCID50。
1.8 病毒S基因的遗传进化分析
分别以流行性腹泻经典毒株CV777(AF353511)和流行毒株CH-CCC(KT388421)为参考模板,利用Primer 3.0设计S基因引物(表1)并进行RT-PCR扩增,然后对S基因进行分子克隆和测序。将测序结果用DNAstar软件对序列进行拼接分析比较,利用MEGA 7.0对从GenBank中下载的参考株S基因序列作同源性和系统进化分析,参考株信息见表2。
表2 PEDV参考毒株Table 2 PEDV reference strains
2 结果与分析
2.1 送检样品RT-PCR检测
从图1可知,在粪便样品中扩增出429 bp片段,与预期目的片段长度一致,提示猪群中存在PEDV感染。
2.2 病毒分离
从表3可知,第一代细胞培养物RT-PCR的CT值为21.09,病毒含量较少,直到第十五代细胞培养物RT-PCR的CT值为12.14,往后代次的细胞培养物CT值稳定在11.32左右,提示病毒在细胞上已经能够稳定生长,结果提示已初步分离获得PEDV。此外,细胞盲传至15代时出现了典型的细胞病变(CPE):细胞圆缩、聚集,最后细胞发生裂解(图2)。

注:MDL-1000 Marker;1:PEDV阴性对照电泳结果;2: PEDV阳性对照电泳结果; 3~11:PEDV阳性样品电泳结果。Note: MDL-1000 Marker; 1, Electrophoresis results of PEDV negative CK; 2, Electrophoresis results of PEDV positive CK; 3-11, Electrophoresis results of PEDV negative sample.
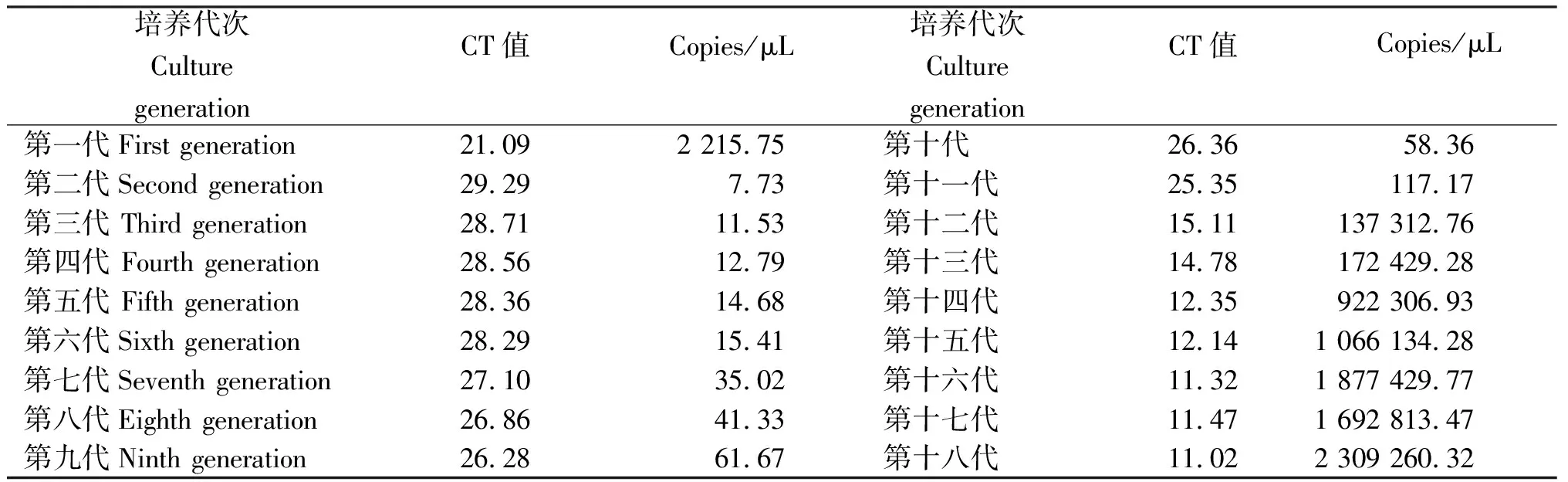
表3 RT-qPCR检测各代细胞培养物的病毒载量Table 3 Viral load of cell cultures from each generation by RT-qPCR

图2 第15代分离病毒接种Vero细胞24 h后的CPEFig.2 CPE of Vero cells inoculated with virus isolated from the fifteenth generation 24 h later
2.3 病毒IFA鉴定
将第18代的分离毒接种于Vero细胞,48 h后进行间接免疫荧光检测。结果表明,分离毒株能与商品化的PEDV单抗发生阳性反应,出现特异性绿色荧光(图3),进一步证明所分离病毒为PEDV,命名为YNDH-2017株。
2.4 PEDV YNDH-2017株感染力滴定
逐日观察细胞生长状态,记录细胞病变情况,细胞CPE变化主要有细胞圆缩,聚集。随着病毒浓度的降低,细胞CPE程度逐渐减弱(图4),病毒稀释了10-6~10-7倍以后进行细胞接毒,细胞无CPE。用Reed-Muench两氏法计算得分离株的TCID50为10-4.85/0.1 mL。

图3 分离病毒的间接免疫荧光检测Fig.3 Indirect immunofluorescence assay of the isolated viruses
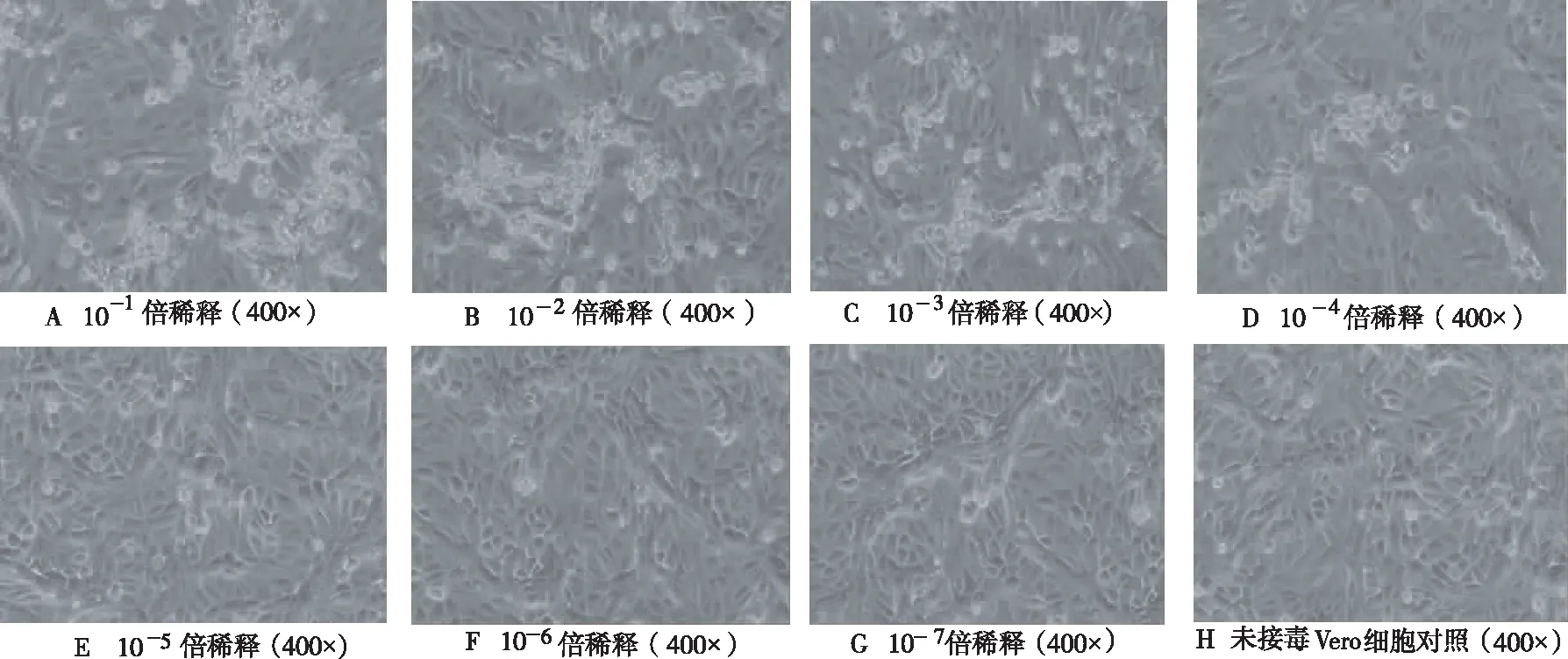
图4 不同浓度病毒接种Vero细胞24 h后的CPEFig.4 CPE of Vero cells inoculated with virus with different concentration 24 h later
2.5 PEDV YNDH-2017株S基因全序列的扩增
从图5可知,电泳结果同预期目的片段588 bp、984 bp、1 000 bp、1 064 bp和1 075 bp大小相符。扩增片段进行克隆测序后,将获得的S基因片段用DNAstar软件对序列进行拼接分析比较,经测序拼接结果表明该基因全长为4 158 bp,编码1 386个氨基酸。将YNDH-2017与国内外参考毒株同源性比较发现,与经典毒株CH-S株和疫苗CV777株的同源性为92.8%和93.1%,与日本83P-5株同源性为93.4%,与美国colorado-2013同源性为98%,与云南的YN144(KT012232)株和YN1(KT012227)株同源性分别为97.9%和98.1%,与流行毒株CH-CCC株同源性为98.2%(图6),表明成功获得PEDV YNDH-2017 S基因全序列。
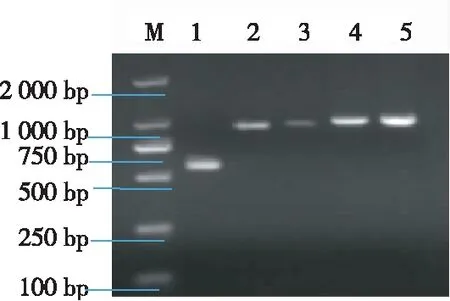
注:MDL-2000,标记物; 1-5, S1-S5基因的电泳结果。Note:MDL-2000, Marker; 1-5, Electrophoresis results of PEDV S1-S5 genes.

注:黑色框为试验分离毒株。Note: The strain within a black frame represents the test isolated strain.
2.6 PEDV YNDH-2017株S基因进化树
从图7可知,分离获得的YNDH-2017株S基因与目前国内流行PEDV分离株CH-CCC和云南省流行YN-1株和YN144株在同一分支上,亲缘关系较近;而与经典疫苗毒株CV777株在两个大的分支上,亲缘关系较远。表明,云南省分离株YNDH-2017株与目前国内流行的PEDV毒株有较近亲缘性。
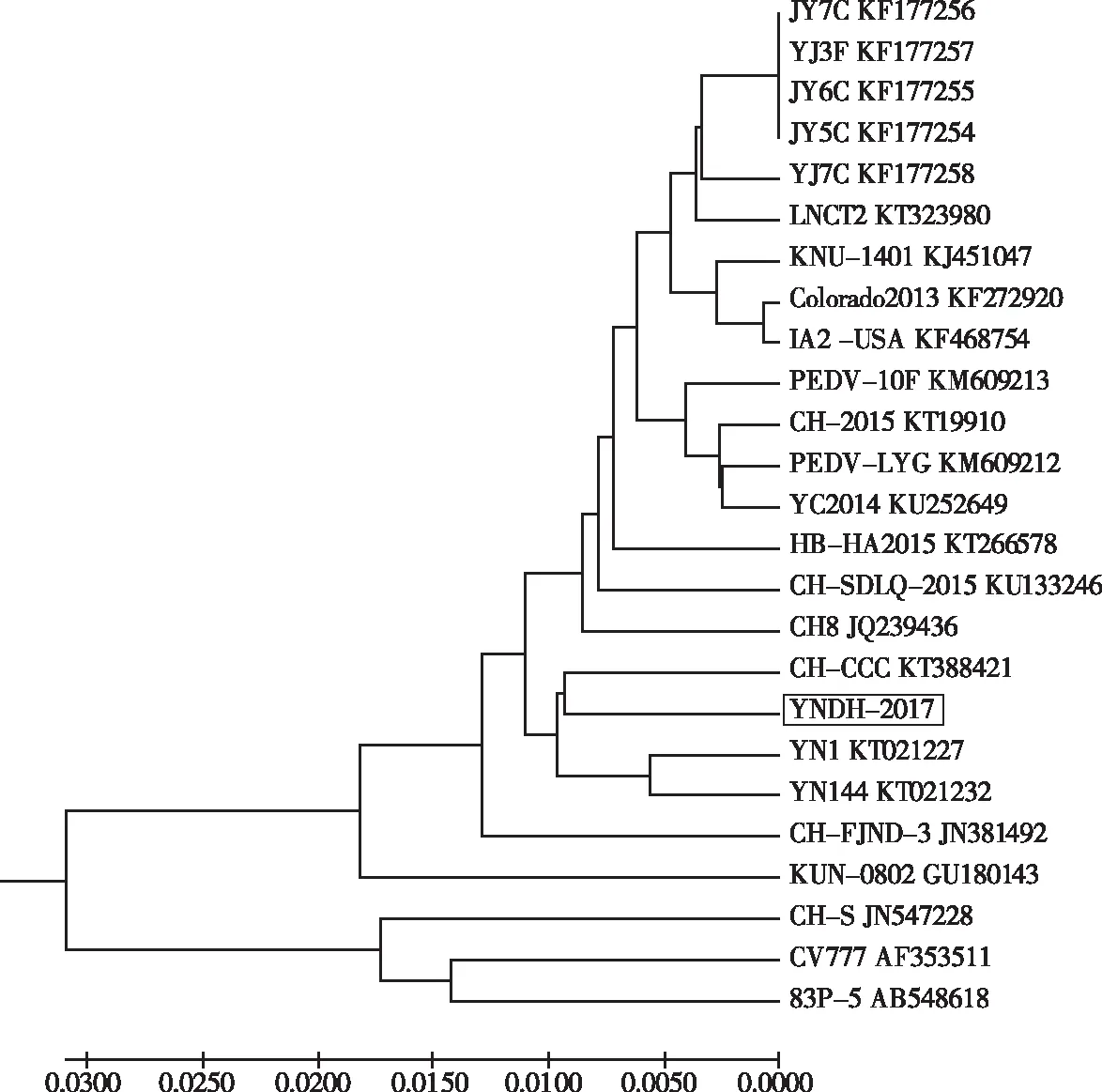
注:黑色框为试验分离毒株。
Note: The strain within a black frame represents the test isolated strain.
图7YNDH-2017分离株S基因进化树
Fig.7 Phylogenetic tree of S gene from YNDH-2017 strain
2.7 PEDV YNDH-2017株S基因氨基酸位点变异分析
扩增获得的PEDV YNDH-2017株S基因全长为4 158 bp,编码1 386个氨基酸,与疫苗毒株CV777相比,试验分离的毒株YNDH-2017在氨基酸59~62 位连续性插入4个氨基酸,氨基酸140位缺失1个氨基酸,在氨基酸163~164 位连续性缺失2个氨基酸(图8)。以上氨基酸的变异与近年我国地方流行毒株变化趋势一致。
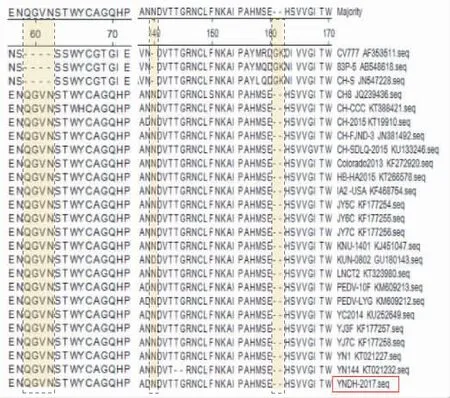
注:图中虚线部分代表氨基酸缺失和插入位置,黑色框代表试验分离病毒株。Note: The broken line represents the location of amino acid deletion and insertion. The strain within a black frame represents the test isolated strain.
3 结论与讨论
PEDV是危害养猪业健康发展的主要肠道病毒之一。近年来,国内外不少学者对PEDV 感染情况进行了研究,并认为PEDV在不断地发生变异。因此,为确定2017 年云南某猪场发生仔猪腹泻疫情的病原,利用RT-PCR检测PEDV,并把所得阳性样品进行处理后,利用Vero 细胞进行分离培养,通过IFA试验鉴定,确定所获得的毒株为PEDV毒株,命名为YNDH -2017。相比于其他冠状病毒,猪流行性腹泻病毒的细胞培养相对比较困难。直到1982年宣华[3]等将分离到的毒株在胎猪肠组织原代单层细胞内培养才取得成功。1988年瑞士的HOFMANN[4]首次报道了在细胞培养液中加入适量胰酶,病毒可在Vero细胞上传代培养,这是因为猪流行性腹泻病毒具有依赖胰酶的特性,在胰酶的激活作用下,猪流行性腹泻病毒的病毒粒子会释放出来并发挥作用。因此,在没有胰酶的条件下,PEDV在细胞中进行传代比较困难[5]。试验中,将分离的PEDV毒株在添加适当胰酶浓度的Vero细胞上盲传至15代可观察到典型的细胞病变,细胞形成圆缩,聚集,最后细胞发生裂解[6],提示PEDV已经在Vero细胞上增殖,将第15代的分离毒株接种于Vero细胞,48 h后进行间接免疫荧光检测,分离毒株能与商品化的PEDV单抗发生反应,出现特异性绿色荧光[7],进一步证实了在Vero细胞上成功分离到PEDV;并且在Vero细胞上培养至72 h细胞病变达80%以上,随着病毒在细胞上的传代次数的增加,病毒对细胞的适应性也随之增强,病毒滴度也相应升高[8],TCID50为10-4.85/0.1 mL。
PEDV的结构基因中,S基因编码的S蛋白是位于病毒粒子表面的纤突糖蛋白,在病毒侵入宿主细胞时,识别靶细胞受体,使病毒与细胞膜融合[9];此外,PEDV的主要中和抗原表位和受体结合域位于S蛋白区,因此S蛋白是研发PEDV疫苗的首要目标蛋白[6,10]。有研究报道,通过对中国南方地区PEDV毒株的S基因进行测序分析发现,这些毒株与泰国毒株亲缘关系较近,但与经典疫苗毒株CV777株及国内早期毒株存在较大差异[11]。S基因是PEDV最容易发生变异的基因,S基因的氨基酸存在着典型的缺失和插入模式,被认为是区别经典毒株和流行毒株的分子标记[12],所以根据S基因变异情况能在一定程度上反映出不同PEDV 株的遗传变异情况及亲缘关系[13-14]。试验对云南省分离的YNDH-2017株进行S基因同源性比较,分离的YNDH-2017株与经典毒株CH-S株和疫苗毒株CV777株的同源性为92.8%和93.1%,与日本经典83P-5株同源性为93.4%,与美国colorado-2013同源性为98%,与云南的YN144(KT012232)株和YN1(KT012227)株同源性为97.9%和98.1%,与流行毒株CH-CCC株同源性为98.2%。与国内外参考毒株S基因比较并绘制进化树,结果显示分离获得的YNDH-2017株S基因与目前国内流行的PEDV分离株亲缘关系较近,与云南省流行毒株YN1株,YN144株和CH-CCC株在同一分支,说明分离株 YNDH-2017株是目前国内流行的PEDV毒株。分离毒株YNDH-2017株S基因序列与经典疫苗毒株CV777株和流行毒株CH-CCC株比对,结果显示与早期病毒株CV777和CH/S等相比YNDH-2017株在氨基酸59~62位存在59QGVN624个氨基酸的插入,在氨基酸140位存在140N 1个氨基酸的缺失,在氨基酸163~164 位存在163NI1642个氨基酸的缺失,这一突变特征与当前已报道的一些新的流行病毒株的突变特征一致,进一步说明试验分离得到的YNDH-2017株是目前流行的PEDV毒株,为更好的了解和掌握PEDV在云南的流行状况和对PED疫苗的选择提供理论参考。
