NOD/Ltj小鼠Ⅰ型糖尿病不同发病阶段细胞免疫状态研究①
2019-04-01陈冬志赵会娟尹晓琳刘嘉琳侯明辉
陈冬志 赵会娟 尹晓琳 刘嘉琳 孟 明 侯明辉
(河北大学医学院,保定 071000)
非肥胖型糖尿病(Non-obese diabetic,NOD)小鼠作为一种自发性人类1型糖尿病动物模型,其遗传背景清楚,与人类T1D在免疫学特征、病理过程和临床特征等多个方面具有相似之处,是研究T1D的主要动物模型[1,2]。通过对血糖、尿糖的监测及胰岛病理的观察,我们初步证实雌性NOD小鼠T1D发病集中在22~26周龄,至30周龄,累积发病率可达70%。尽管T1D被认为是主要由T细胞介导的器官特异性自身免疫性疾病,但多种免疫细胞参与了T1D的发生和发展[3-5]。本研究进一步对NOD小鼠在未发病、发病初期、发病末期不同发病阶段相关免疫器官中CD4+T和CD8+T 细胞、Th细胞及其亚群、iNKT细胞及其亚群、致炎性和抑炎性细胞因子以及相关转录因子进行系统观察,以期了解NOD小鼠不同发病阶段细胞免疫功能状态。
1 材料与方法
1.1材料
1.1.1实验动物 雌性NOD/Ltj 实验小鼠,日龄35~42 d(北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2014-0004。饲养于清洁的SPF 级动物室,室温(23±2)℃,相对湿度(50±5)%,所有小鼠均自由摄食、饮水。实验动物严格遵守《实验动物保护条例》进行处理,动物处理程序经过河北大学医学部伦理委员会认证。
1.1.2主要试剂及仪器 PE-T-selected-CD1d tetramer购自MBL International,Woburn,MA公司;FITC-Anti-MouseTCR-β(553170)、Percp-CyTM5.5-Mouseanti-T-bet(561316)、Alexa Fluor647Mouse Anti-PLZF(563490)购自BD公司; Foxp3/Transcription Factor Staining Buffer购自eBioscience;α-半乳糖神经鞘胺醇(α-Galcer)购自ENZO Life Sciences;微量样本多指标流式蛋白定量技术(CBA)Th1/Th2/Th17细胞因子检测试剂盒(560485)、RPMI1640培养液购自Wisent公司;血糖仪购自三诺生物传感股份有限公司;血糖试纸购自三诺生物传感股份有限公司;尿糖试纸购自花都高尔宝生物技术有限公司;CD4-FITC、CD8-PE抗体、FACS Calibur细胞仪购自BD Pharmin-gen(CA,USA);低温低速离心机购自Beckman Coulter(CA,USA)。
1.2方法
1.2.1动物分组 雌性NOD/Ltj小鼠100只,适应性饲养1周。每周检测2次尿糖,尿糖阳性的小鼠禁食不禁水8 h后断尾取血,血糖仪检测空腹血糖,连续2次血糖值≥11.1 mmol/L 即诊断为T1D发病模型鼠。根据实验目的,随机选取集中发病周龄段且符合要求的实验动物30只,每组10只。实验动物分3组,分别为未发病组(观察期内未发病)、发病初期组(鉴定发病1周内)、发病末期组(发病后4~5周)。所有实验动物观察至30周龄。
1.2.2组织取材 无菌环境下取小鼠外周血、胰腺、胸腺、脾脏、肝脏、腹股沟淋巴结。
1.2.3FACS检测外周血、肝脏、胸腺、腹股沟淋巴结中CD4+T、CD8+T细胞频率 收集各组小鼠全血(每只120 μl)于流式管。过淋巴细胞分离液分离得到各组织淋巴细胞悬液,取1×106个细胞,100 μl PBS重悬。加入Percp-CD3、FITC-CD4、PE-CD8抗体各5 μl,4℃避光孵育20 min。外周血样品加红细胞裂解液1 ml,避光8 min,观察澄清透亮后离心弃上清。所有样品PBS洗涤2 次,重悬,加PBS定容500 μl,流式细胞仪Calibur上机检测,FlowJo软件进行数据分析。
1.2.4流式细胞技术检测脾脏、肝脏中Th亚群(Th1、Th2、Th17) 分离小鼠各组织,研磨制成单细胞悬液,淋巴细胞分离液分离淋巴细胞,PBS 清洗后细胞计数。细胞密度调整为1×106~10×106个/ml接种于12孔培养板,培养条件:含10%胎牛血清的RPMI1640 培养基(含双抗),加入终浓度为50 ng/ml PMA,1 μg/ml IO,4 μl/6 ml GolgStop(含Monensin)刺激5 h。培养后离心重悬计数。每支样品管中加入细胞106个。加预冷CytofixTMbuffer,充分重悬细胞,室温避光孵育10 min细胞固定。stain buffer 清洗2次,加入1 ml 1×Perm/WashTMbuffer,避光孵育15 min细胞透化。每支样品管加入50 μl 1×Perm/WashTMbuffer和20 μl cocktail,室温避光孵育30 min。1×Perm/WashTMbuffer 清洗2次,500 μl stain buffer重悬细胞,流式检测。
1.2.5FCM检测外周血、脾脏、肝脏、胸腺、腹股沟淋巴结中iNKT细胞频率及iNKT1/iNKT2细胞亚群比率 收集各组小鼠全血(每只120 μl)于流式管。淋巴细胞分离液分离得各组织淋巴细胞悬液,取1×106个细胞,100 μl PBS重悬。加入FITC-TCR-β、PE-α-G-tet抗体各5 μl,4℃避光孵育30 min。外周血样品加红细胞裂解液1 ml,避光8 min,澄清透亮后离心弃上清。所有样品PBS洗涤2 次,100 μl PBS重悬,每管加1 ml Foxp3 Fixation/Permeabiliz-ation working solution,避光4℃孵育30 min,加2 ml 1×Permeabilization Buffer,室温500 g,5 min离心弃上清后重悬样品,透化固定后加入Percp-CyTM5.5Mouseanti-T-bet、Alexa Fluor647Mouse Anti-PLZF各5 μl室温避光孵育30 min,每管加入2 ml 1×Permeabilization Buffer,400 g,5 min室温离心弃上清。PBS定容至500 μl,流式细胞仪检测。
1.2.6CBA检测脾脏、肝脏、腹股沟淋巴结中淋巴细胞培养上清细胞因子水平 分离获得各组织中淋巴细胞,细胞密度调整为2×106个/ml置于12孔培养板中,无血清RPMI1640 培养基重悬细胞,加入PMA(50 ng/ml)、IO(1 μg/ml)进行刺激,细胞培养箱中培养24 h,离心得培养上清。应用 CBA 细胞因子试剂盒检测各组织培养上清中IFN-γ、TNF-α、IL-2、IL-4、IL-6、IL-17A、IL-10水平。梯度稀释标准品。依不同浓度标准品形成的标准曲线作为质控指标。混合捕获微球,每个实验管中加 50 μl 捕获微球,标准品管中加50 μl梯度稀释好的标准品,每个样本管加入50 μl 样本,加入50 μl PE 检测试剂,室温避光孵育2 h。每管加入1 ml洗液,离心弃上清,每管加 300 μl洗液重悬,流式细胞仪检测。
1.2.7Western blot检测转录因子 PLZF、T-bet、GATA-3、ROR-γt表达量 取胸腺、脾脏、肝脏组织各0.1 g,匀浆处理。抽提试剂提取蛋白。蛋白预处理后依次进行灌胶与上样,电泳,转膜。PVDF膜浸在5%脱脂牛奶中,于37℃摇床封闭2 h。按照抗体说明书建议比例,用一抗稀释液将anti-GAPDH、anti-T-bet/Tb21、anti-GATA3、anti-PLZF、anti-ROR-γt抗体以1∶1 000稀释,与PVDF膜4℃孵育过夜。TTBS液清洗。用抗体稀释液将Goat anti-Rabbit IgG 以1∶1 000进行稀释,与PVDF膜室温孵育1 h。TTBS液清洗。发光液与PVDF膜充分接触2 min。荧光化学发光检测仪检测各组胸腺PLZF表达情况,脾脏、肝脏中T-bet、GATA3、ROR-γt表达情况。采用 Image J 软件记录各个蛋白的 ID 值(灰度值),以GAPDH为内参,目的蛋白的相对表达量=目的蛋白的 ID 值/GAPDH ID 值。

2 结果
2.1CD4+T、CD8+T 细胞频率变化 与未发病组比较,发病初期组CD4+T细胞频率在脾脏、肝脏、胸腺、腹股沟淋巴结中均显著增加(P<0.05);与发病初期组比较,发病末期组CD4+T细胞频率在肝脏、胸腺、腹股沟淋巴结及外周血中均显著降低(P<0.05);与未发病组比较,发病初期组CD8+T细胞频率在脾脏、胸腺中显著增加,在腹股沟淋巴结中显著降低(P<0.05),与发病初期组比较,发病末期组CD8+T细胞频率在肝脏、胸腺中均显著降低,在腹股沟淋巴结中显著增加(P<0.05)。见图1。
2.2Th1/Th2/Th17细胞亚群的变化 在脾脏,与未发病组和发病初期组比较,发病末期组Th1亚群显著增加(P<0.05),Th2、Th17细胞亚群三组两两比较差异均无统计学意义(P>0.05);在肝脏,与未发病组和发病初期组比较,发病末期组Th1亚群显著增加(P<0.05),与发病初期组比较,发病末期组Th2、Th17亚群比例显著增加(P<0.05),见图2、3。
2.3iNKT细胞频率变化 与未发病组比较,发病初期组肝脏、腹股沟淋巴结中iNKT细胞频率均显著增高(P<0.05);与发病初期组比较,发病末期组外周血、肝脏中iNKT细胞频率均显著降低(P<0.05);脾脏、胸腺iNKT细胞频率三组两两比较差异均无统计学意义(P>0.05),见图4。
2.4iNKT细胞亚群变化 与未发病组比较,发病初期组和发病末期组胸腺iNKT1亚群比例均显著增加,iNKT2亚群比例均显著降低(P<0.05);脾脏、肝脏、腹股沟淋巴结iNKT1及iNKT2亚群比例三组两两比较差异均无统计学意义(P>0.05)。与iNKT1亚群比较,iNKT2亚群在三组小鼠的脾脏、肝脏、腹股沟淋巴结中均较低(P<0.05), 在未发病组胸腺中,与iNKT1亚群比较,iNKT2亚群比例较高(P<0.05),图5,表1、2。
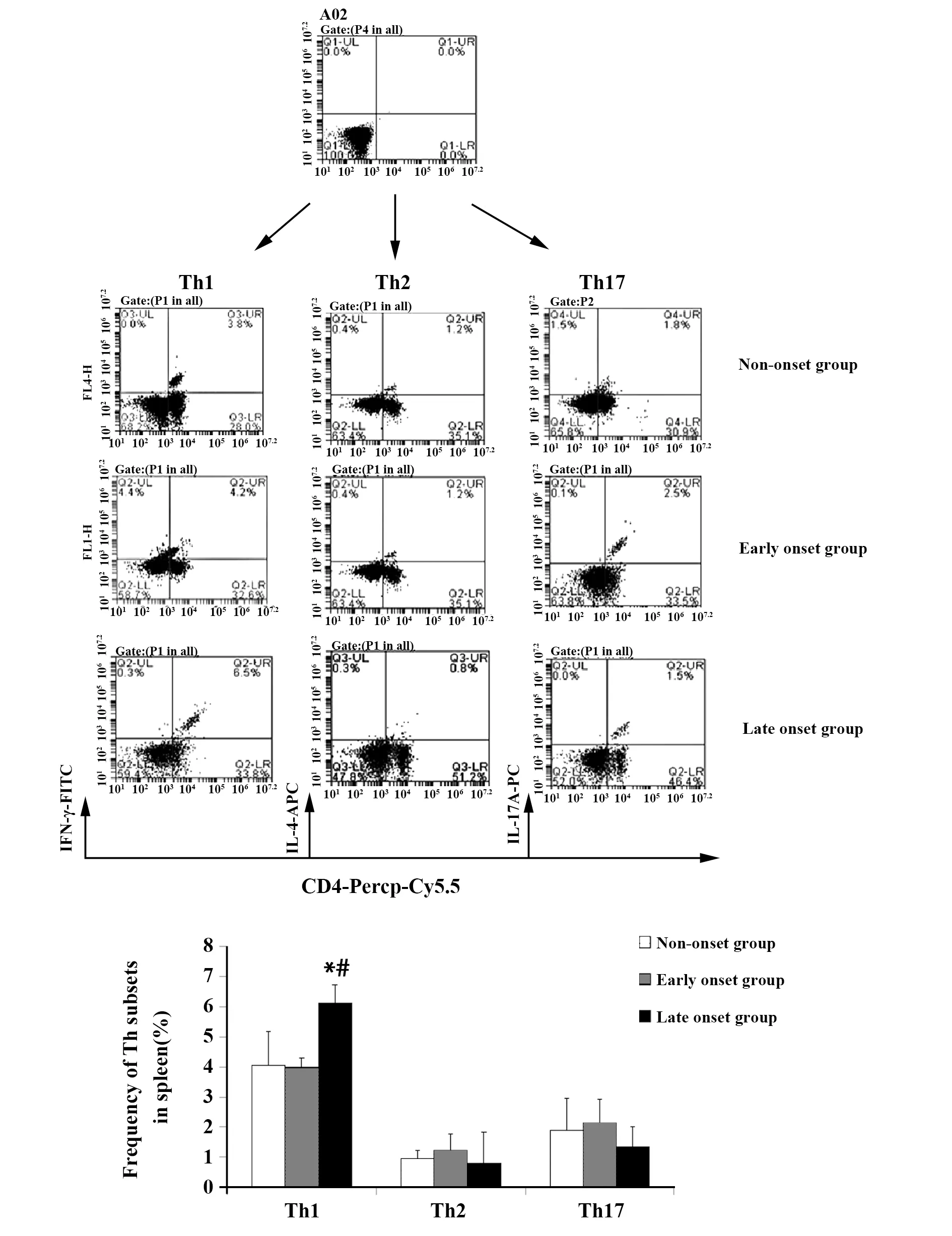
图2 各组小鼠脾脏Th亚群细胞频率(%)Fig.2 Mean frequency of Th subsets of each group in spleen(%)

图1 不同组别不同组织中CD4+T、CD8+T细胞频率Fig.1 Frequency of CD4+T and CD8+T cells in different tissues of different groups
2.5细胞因子水平 在脾脏和腹股沟淋巴结中致炎性细胞因子(IFN-γ、TNF-α、IL-2、IL-6、IL-17A)、抑炎性细胞因子(IL-4、IL-10)水平在发病初期较未发病组和发病末期组均显著升高(P<0.05);IFN-γ/IL-4比值表明, 发病初期较未发病组和发病末期组均显著升高(P<0.05)。在肝脏中致炎性细胞因子(IFN-γ、TNF-α、IL-2、IL-6、IL-17A)水平随小鼠病情进展逐渐升高,两两比较差异均有统计学意义(P<0.05);抑炎性细胞因子(IL-4、IL-10)水平在发病初期最高,发病末期显著降低(P<0.05)。IFN-γ/IL-4比值表明,随小鼠病情进展比值逐渐增大,且两两比较差异均有统计学意义(P<0.05)、图6~8,表3~5。

图3 各组小鼠肝脏Th亚群细胞频率(%)Fig.3 Mean frequency of Th subsets of each group in liver(%)
2.6转录因子表达量 胸腺:转录因子PLZF相对表达量,三组两两比较差异均无统计学意义(P>0.05)。脾脏:与未发病组和发病初期组比较,发病末期组T-bet相对表达量显著增加(P<0.05);GATA-3和ROR-γt相对表达量,三组两两比较差异均无统计学意义(P>0.05)。肝脏:与未发病组和发病初期组比较,发病末期组 T-bet相对表达量显著增加(P<0.05);与未发病组和发病末期组比较,发病初期组GATA-3 和ROR-γt相对表达量显著降低(P<0.05),图7~9。
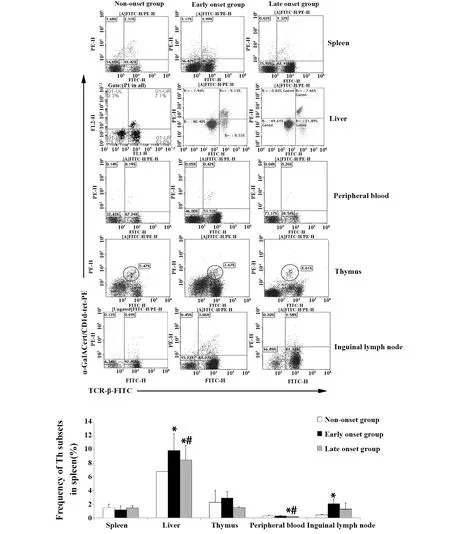
图4 不同组别不同组织中iNKT细胞频率Fig.4 Frequency of iNKT cells in different tissues of different groups
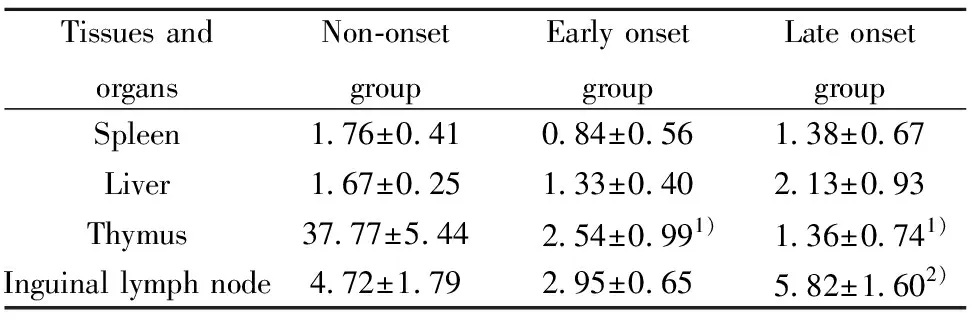
表2 各组小鼠iNKT2细胞比例(%)Tab.2 Ratio of iNKT2 cells in mice of each group(%)
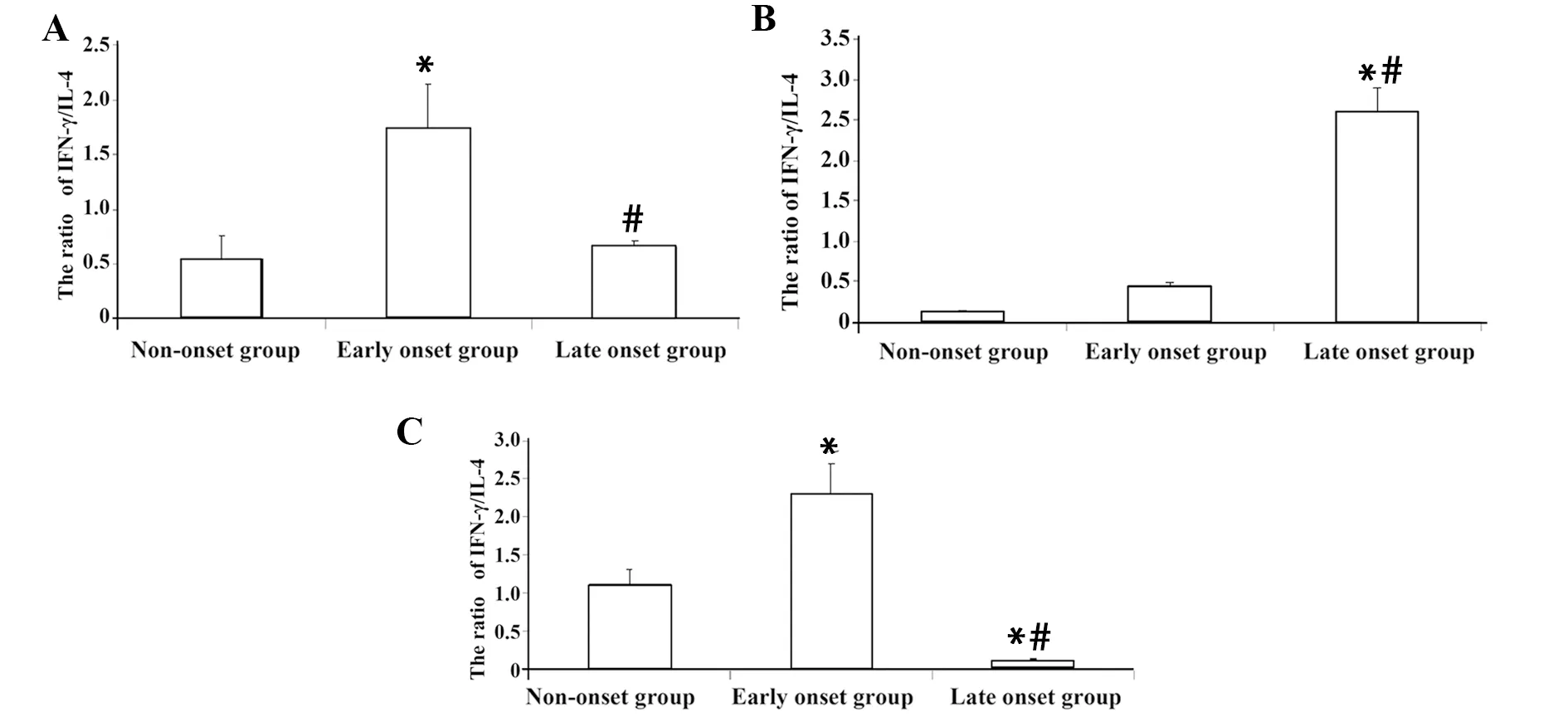
图6 各组织淋巴细胞培养上清中细胞因子IFN-γ/IL-4比值Fig.6 Ratio of IFN-γ/IL-4 in lymphocyte culture of each tissue
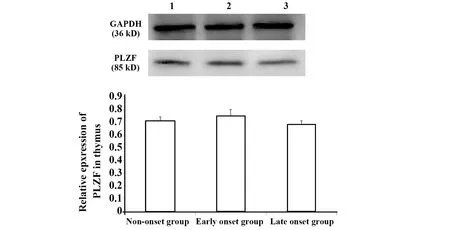
图7 胸腺中PLZF相对表达量Fig.7 Expression of PLZF in thymus
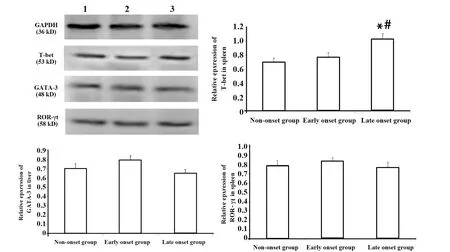
图8 脾脏中T-bet、GATA-3、ROR-γt相对表达量Fig.8 Expression of T-bet,GATA-3,ROR-γt in spleen.

表3 脾脏淋巴细胞培养上清中细胞因子含量(pg/ml)Tab.3 Cytokine content of lymphocyte culture in spleen(pg/ml)

表4 肝脏淋巴细胞培养上清中细胞因子含量(pg/ml)Tab.4 Cytokine content of lymphocyte culture in liver(pg/ml)

表5 腹股沟淋巴结淋巴细胞培养上清中细胞因子含量(pg/ml)Tab.5 Cytokine content of lymphocyte culture in inguinal lymph node(pg/ml)
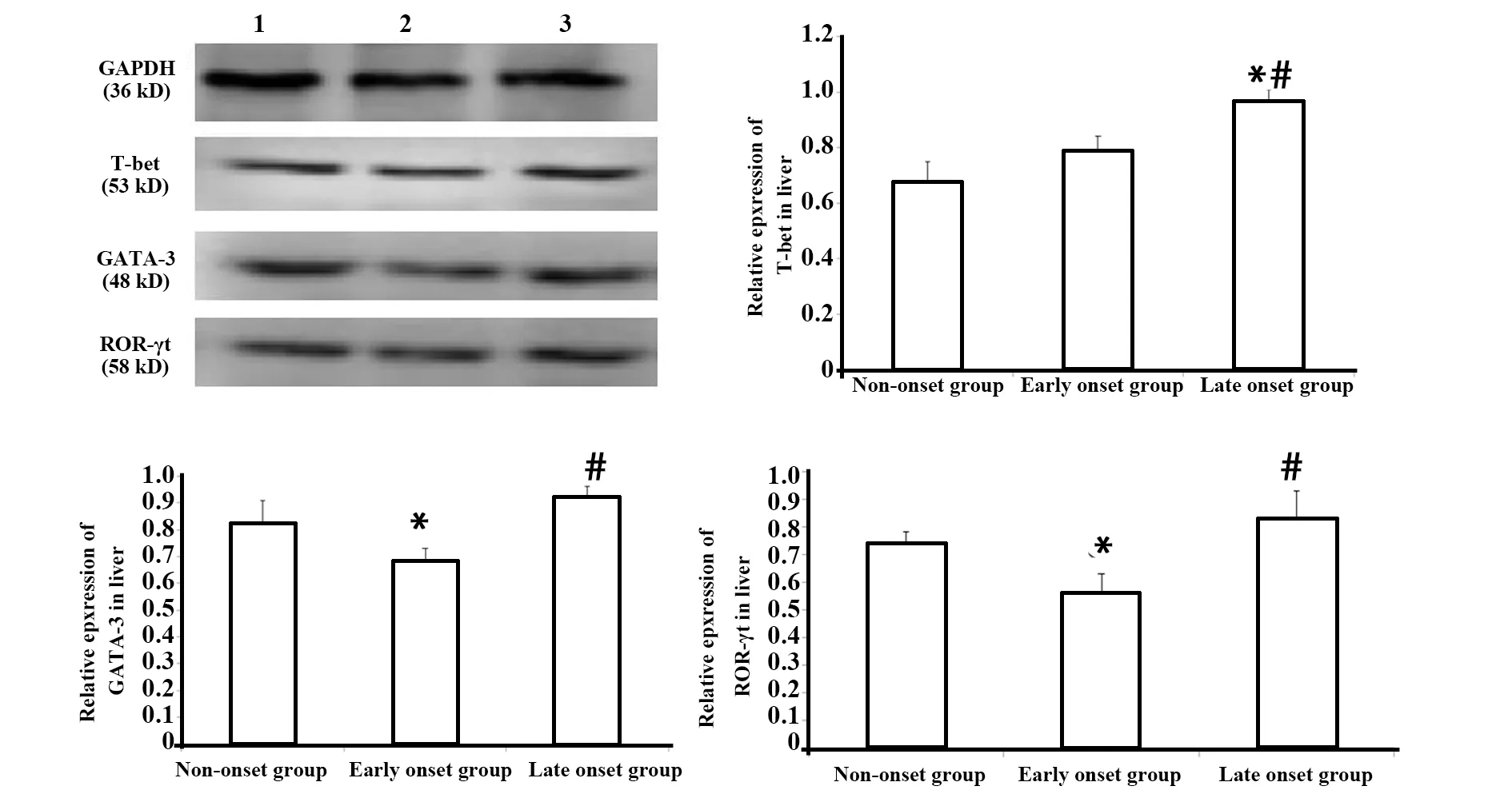
图9 肝脏中T-bet、GATA-3、ROR-γt相对表达量Fig.9 Expression of T-bet,GATA-3,ROR-γt in liver
3 讨论
以往的研究表明,针对胰岛β细胞自身抗原的CD4+T和CD8+T细胞的活化是T1D发生、发展的关键[6]。我们首先检测了相关免疫器官及外周血中CD4+T和CD8+T细胞频率,发现与未发病组比较,发病初期组CD4+T细胞频率在脾脏、肝脏、胸腺、腹股沟淋巴结中均显著增加(P<0.05),发病末期与发病初期组比较,CD4+T细胞频率在肝脏、胸腺、腹股沟淋巴结及外周血中均显著降低(P<0.05);与未发病组比较,发病初期组CD8+T细胞频率在脾脏、胸腺中显著增加(P<0.05),发病末期与发病初期组比较,CD8+T细胞频率在肝脏、胸腺中均显著降低,说明发病初期CD4+T和CD8+T细胞的增加特别是CD4+T细胞的增加是导致胰岛炎重要的免疫基础。末期CD4+T和CD8+T细胞频率的下降与T1D能量代谢障碍造成免疫器官功能下降有关。但与未发病组比较,发病初期组腹股沟淋巴结中CD8+T显著降低(P<0.05),而发病末期却显著增加(P<0.05),这一结果值得进一步研究。
Th亚群的失衡被认为是T1D发生的重要免疫学机制[7,8]。进一步检测Th1/Th2/Th17细胞亚群结果显示:在脾脏、肝脏中,与未发病组和发病初期组比较,发病末期组 Th1亚群比例显著增加(P<0.05)。在脾脏中Th2、Th17细胞亚群三组两两比较均无显著性差异(P>0.05)。在肝脏中,与发病初期组比较,发病末期组Th2、Th17亚群水平显著升高(P<0.05)。在NOD小鼠发病末期表现出显著的自身免疫异常和代谢紊乱,虽然Th2亚群比例在发病末期也有增加,但发挥促炎作用的Th1、Th17型细胞尤其是Th1型细胞仍然占据主导地位,这种促炎和抑炎的平衡状态被打破是导致炎症加剧的一个关键因素。
近年来研究发现,iNKT细胞在自身免疫性疾病中有重要作用,且与T1D的发生发展密切相关[9,10]。iNKT细胞是一群兼具NK功能和T细胞特点的新型免疫调节细胞,具有恒定的TCR 链(人Vα24-Jα18/Vβ11;鼠类Vα14-Jα18/Vβ8.2,7,2),介导先天性免疫和获得性免疫[11]。根据其分泌的细胞因子iNKT细胞又可主要分为iNKT1、 iNKT2、 iNKT17三个亚型。iNKT细胞活化后可迅速分泌大量Th1、Th2型细胞因子,调控免疫细胞分化和免疫反应类型[12,13]。已有报道T1D患者的iNKT 细胞数量低于健康人,NOD 小鼠中的iNKT 细胞也低于正常。当iNKT 细胞数量恢复时,T1D 发展受到抑制[14]。近年来Shamin 等[15]的研究认为iNKT 对T1D 进展有促进作用,有关iNKT在T1D发病中的作用仍存在争议[16,17],iNKT细胞在T1D的发生发展过程中的作用仍未得到明确的阐述。
比较三组iNKT细胞频率发现:发病初期组肝脏、腹股沟淋巴结中iNKT细胞频率较未发病组显著增高(P<0.05),与发病初期组比较,发病末期组外周血、肝脏中iNKT细胞频率显著降低(P<0.05),进一步比较iNKT细胞亚群比例发现:发病初期和发病末期组胸腺iNKT1亚群比例较未发病组显著增加(P<0.05),而iNKT2亚群比例却显著降低(P<0.05)。在脾脏、肝脏、腹股沟淋巴结中三组iNKT亚群比例均无显著性差异(P>0.05)。在发病早期iNKT细胞频率的增加以及胸腺iNKT1/iNKT2亚群比例的翻转,提示了iNKT细胞在NOD鼠发病早期可能加速了病情的进展,而介导这一作用的主要是iNKT1细胞。当然,还需要进一步观测iNKT其他亚群以明确参其是否参与了T1D发生发展。
对细胞因子的检测发现:在脾脏和腹股沟淋巴结中无论是致炎性细胞因子(IFN-γ、TNF-α、IL-2、IL-6、IL-17A)还是抑炎性细胞因子(IL-4、IL-10)在发病初期组较未发病组和发病末期组均显著升高(P<0.05); IFN-γ/IL-4比值表明,发病初期组较未发病组和发病末期组均显著升高(P<0.05)。在肝脏中致炎性细胞因子(IFN-γ、TNF-α、IL-2、IL-6、IL-17A)水平随小鼠疾病进展逐渐升高(P<0.05);抑炎性细胞因子(IL-4、IL-10)水平在发病初期最高,发病末期显著降低(P<0.05);IFN-γ/IL-4比值表明,随小鼠疾病进展比值逐渐增大,在发病末期达高峰(P<0.05),表明炎症参与了NOD/Ltj小鼠自发T1D的病理生理过程。
PLZF是调控iNKT细胞分化发育的必需转录因子,在一定程度上反映了iNKT细胞的发育情况[18]。T-bet、GATA-3、ROR-γt分别是Th1、Th2、Th17型细胞分化过程中重要的转录因子[19]。对上述转录因子的检测发现:在胸腺中PLZF相对表达量三组两两比较差异均无统计学意义(P>0.05),和不同病理状态下胸腺中iNKT细胞频率变化的趋势一致。在脾脏和肝脏中与未发病组和发病初期组比较,发病末期组T-bet相对表达量显著增加(P<0.05);在脾脏中GATA-3和ROR-γt相对表达量,三组两两比较差异均无统计学意义(P>0.05)。在肝脏中与未发病组和发病末期组比较,发病初期组GATA-3 和ROR-γt相对表达量显著降低(P<0.05)。转录因子表达量和Th亚群变化趋势相符,进一步验证了Th亚群的检测结果。