114例男性乳腺癌临床病理特征及预后分析
2019-03-30徐文婷彭菲刘君
徐文婷,彭菲,刘君
(1.天津肿瘤医院空港医院综合内六科,天津,300000;2.邵阳学院附属第二医院甲乳外科,湖南 邵阳,422000 3.天津肿瘤医院乳腺二科,天津,300000)
男性乳腺癌是一种极少见的特殊类型乳腺癌,在乳腺癌中所占比例<1%,在男性恶性肿瘤中所占比例<1%[1]。近年男性乳腺癌发病率呈现上升趋势,研究显示其发病率在25年内上升了26%[2]。不同地区发病率存在很大的差异,其中非洲的发病率最高,欧美国家次之,亚洲发病率最低[3]。男性乳腺癌的生物学特性及治疗原则均参考女性乳腺癌,但二者之间存在差异。目前国内关于男性乳腺癌的研究多为小样本回顾性研究。因此,本研究回顾性分析2000年1月到2014年12月期间天津医科大学肿瘤医院收治的114名男性乳腺癌的临床病理资料及预后情况,以探讨影响男性乳腺癌预后的因素。
1 资料与方法
1.1 临床资料
收集2000年1月至2014年12月期间就诊于天津医科大学肿瘤医院的114名男性乳腺癌。所有患者均接受手术治疗,排除既往有转移性疾病或恶性肿瘤病史。收集患者的临床病理、治疗情况和随访预后资料。随访时间从术后第一天到肿瘤复发、转移或死亡日期结束,随访截止日期为2017年6月20日。
1.2 统计学分析
数据分析采用SPSS20.0软件进行统计学分析。生存分析用Kaplan-Meier法进行Log-rank检验,多因素生存分析运用Cox风险比例模型进行。P<0.05认为差异具有统计学意义。
2 结果
2.1 临床病理特征
114例男性乳腺癌患者的临床病理特征见表1。本组发病年龄11~86岁,中位58岁,发病年龄≤60岁者71例(62.3%),发病时间1周~5年,23例(20.1%)有恶性肿瘤家族史。114例患者均因为发现乳腺肿块来就诊,7例患者伴乳头溢液(其中6例呈血性溢液,1例为无色透明溢液),31例伴乳头凹陷或缺如,13例伴患侧皮肤红肿。肿物位于乳晕区为69例(60.5%)。全部患者均经病理诊断,浸润性导管癌为主要类型,共87例(76.3%)。其他包括:乳头状癌10例,黏液腺癌8例,腺样囊性癌3例,乳头Paget病1例,富脂质性癌1例,髓样癌1例,分泌型癌2例,浸润性小叶癌1例。组织学分级:Ⅰ级6例(7.1%),Ⅱ级69例(81.2%),Ⅲ级10例(11.8%)。全组肿瘤最大直径范围为0.6~8.5cm,其中T131例(27.2%),T266例(57.9%),T39例(7.9%),T48例(7.0%)。有腋窝淋巴结转移 40例(38.5%),数目1~48枚不等。根据第7版AJCC乳腺癌TNM分期系统进行临床分期:Ⅰ期24例(21.1%),Ⅱ期66例(57.9%),Ⅲ期23例(20.2%),Ⅳ期1例(0.8%)。其中106例进行了雌激素受体检测(estrogen receptor,ER)及孕激素受体检测(progesterone receptor,PR),ER(+)94.3%(100/106),PR(+)90.6%(96/106),ER 和/或 PR(+)95.3%(101/106)。84例进行人类表皮生长因子受体2检测(human epidermal growth factor-2,HER-2),阳性率为19.0%(16/84),49例行p53检测,阳性率为28.6%(14/49),68例行Ki-67检测,阳性率为33.8%(23/68)。
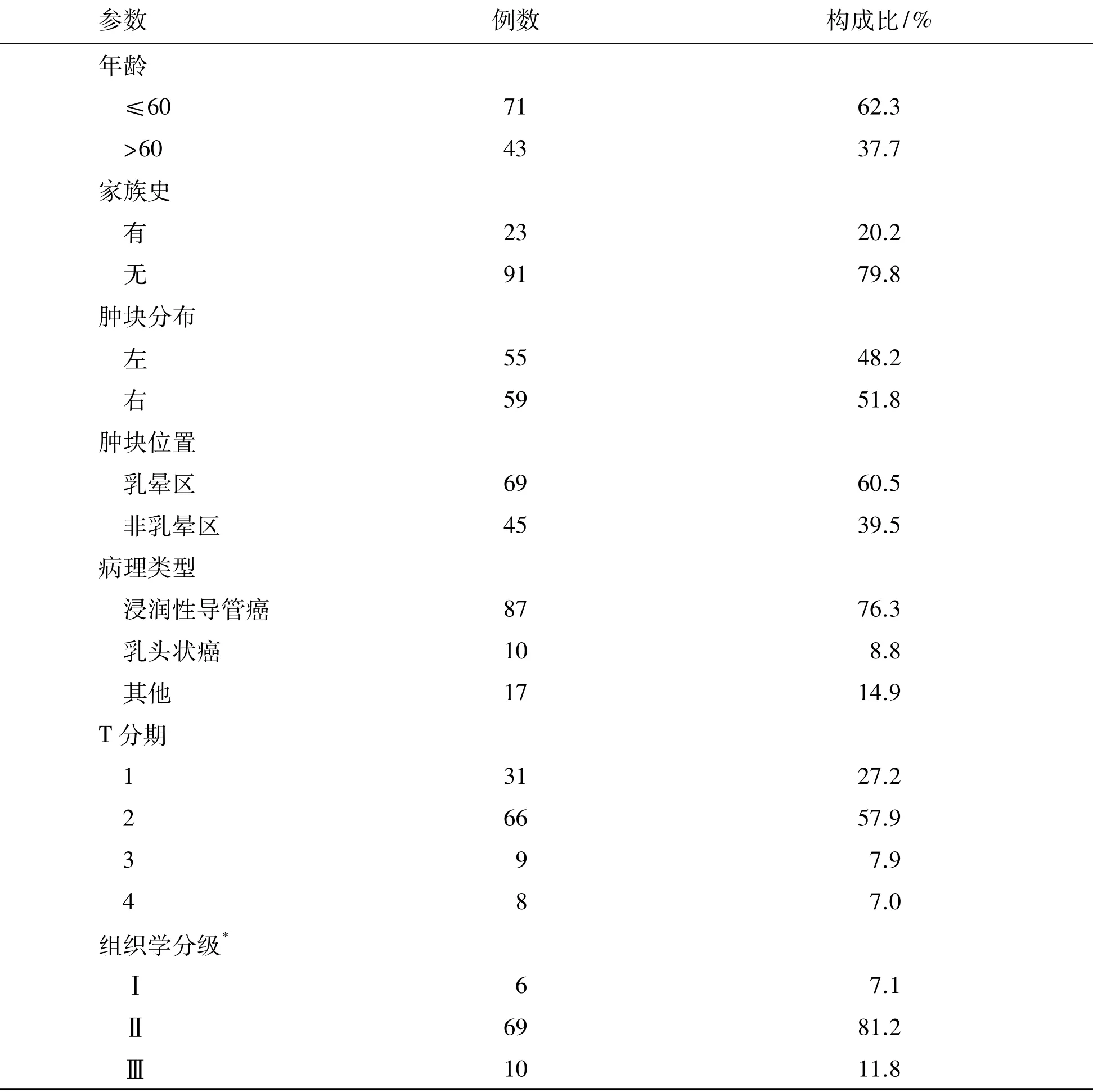
表1 114例男乳腺癌的临床病理特征Table 1 The clinicopathological characteristics of 114 male patients with breast cancer
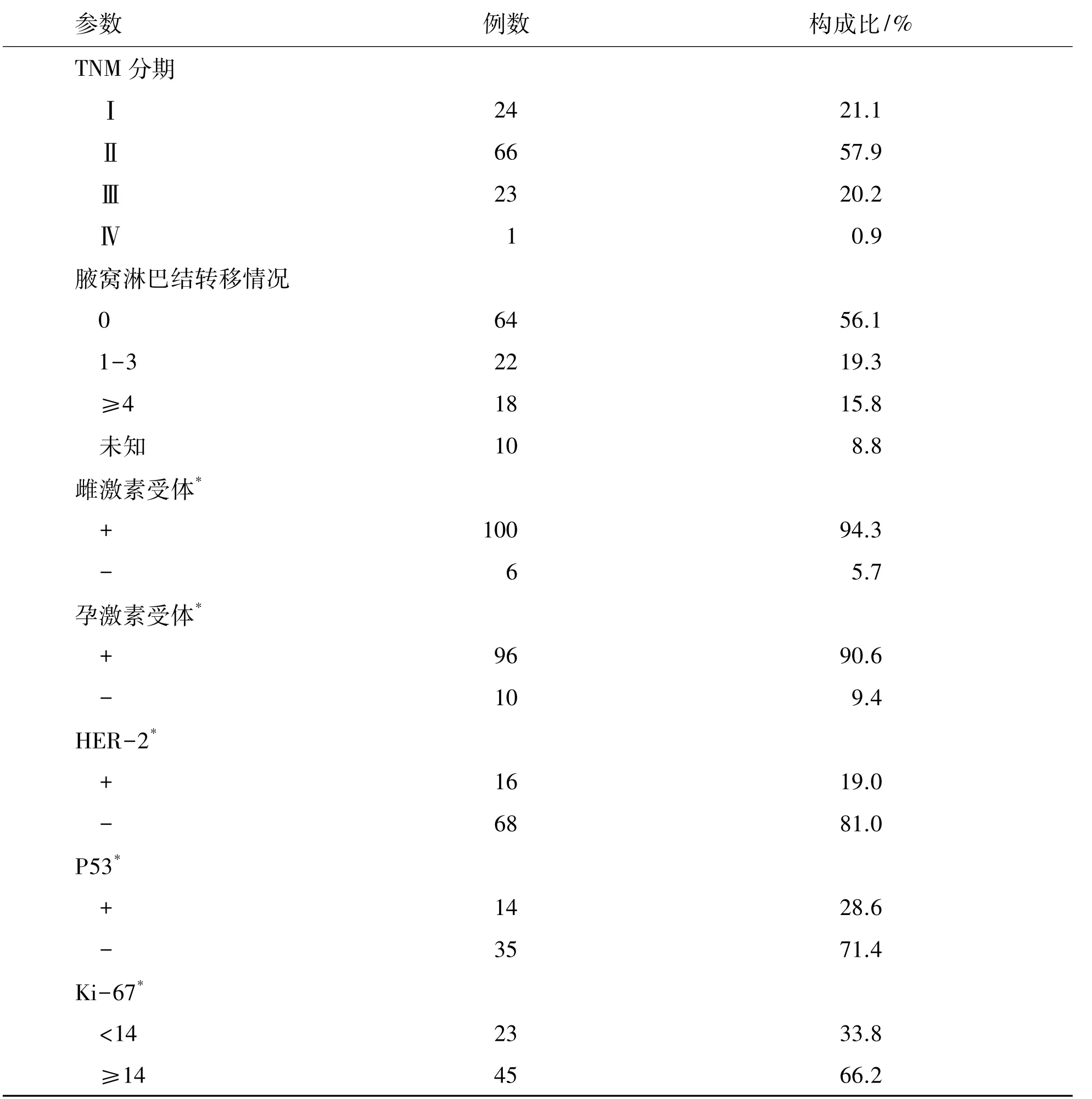
续表
2.2 治疗情况
全组114例治疗情况见表2,均接受手术治疗,其中55例(48.2%)行传统乳腺癌根治术,48例(42.1%)行乳腺癌改良根治术,5例(4.4%)仅行全乳切除术,6例(5.3%)行局部肿物扩大切除术。3例(2.6%)接受新辅助化疗,104例(91.2%)接受术后辅助化疗,2~8周期,中位6周期。26例(22.8%)接受术后辅助放疗,部位包括胸壁和锁骨上区。72例激素受体阳性患者接受内分泌治疗,占全部受体阳性病人的71.3%,其中63例接受他莫西芬(tamoxifen,TAM)治疗,9例接受芳香化酶抑制剂(aromatase inhibitors,AIs)治疗。内分泌治疗时间1~5年不等,中位治疗时间4年。

表2 114例男性乳腺癌的治疗情况Table 2 Therapeutic information of 114 male patients with breast cancer
2.3 局部复发及转移情况
114例随访时间为5~191个月,中位48个月。随访期间,全组9例局部复发,27例出现远处转移,另78例无病生存。远处转移中肺转移17例,骨转移16例,肝转移8例,脑转移2例,少见转移部位为软组织和肾上腺。其中有11例同时或相继出现多器官远处转移。
2.4 生存情况
全组5 年无病生存率(disease-free survival,DFS)51.8%,5 年总生存率(overall survival,OS)61.9%。按照T分期,T1、T2、T3及T4期患者5年DFS分别为68.1%、57.3%、13.3%及0%,5年OS分别为83.6%、63.2%、25.9%及0%。按照内分泌治疗药物,TAM和AIs两组的5年DFS分别为77.1%、11.1%,5年OS分别为80.0%、33.3%,差异有统计学意义(P<0.05)。
2.5 预后的单因素及多因素分析
单因素分析结果显示,肿瘤大小、临床分期、是否进行内分泌治疗(P<0.05)是影响男性乳癌5年DFS及OS的预后因素,腋窝淋巴结状况(P<0.05)是影响男性乳癌5年DFS的预后因素,而与发病年龄、家族史、肿瘤位置、组织学分级、ER状态、HER-2状态、Ki-67状态、手术方式、是否化疗、放疗无关(P>0.05),见表3。将上述单因素分析中有统计学意义的变量纳入多因素分析中,肿瘤大小及是否行内分泌治疗(P<0.05)是影响男性乳腺癌5年DFS和5年OS的独立预后因素。见表4。
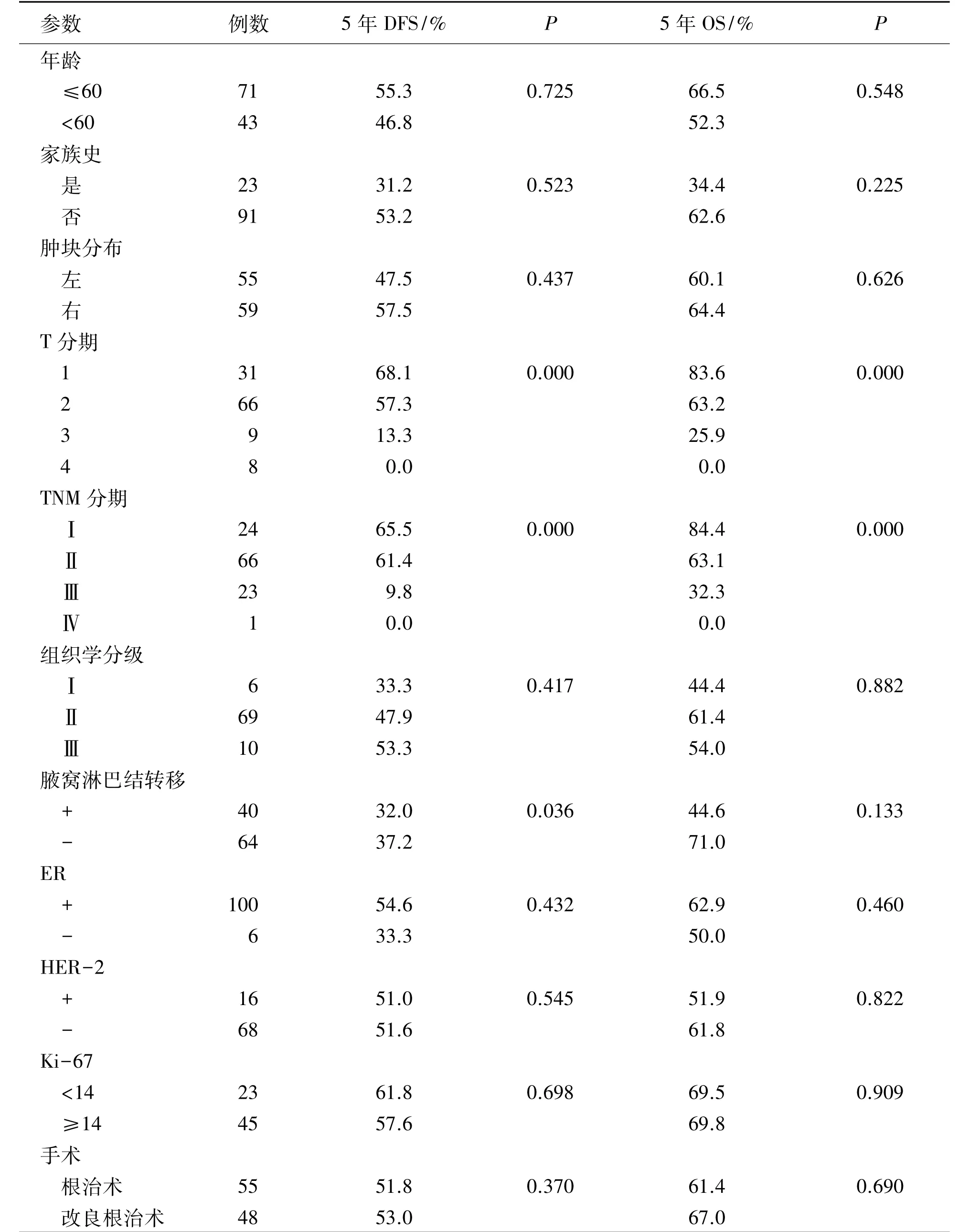
表3 114例男性乳腺癌5年OS和DFS的单因素分析Table 3 Univariate analysis of prognostic factors affecting five-year overall survival(OS)and disease-free survival(DFS)of male patients with breast cancer

续表
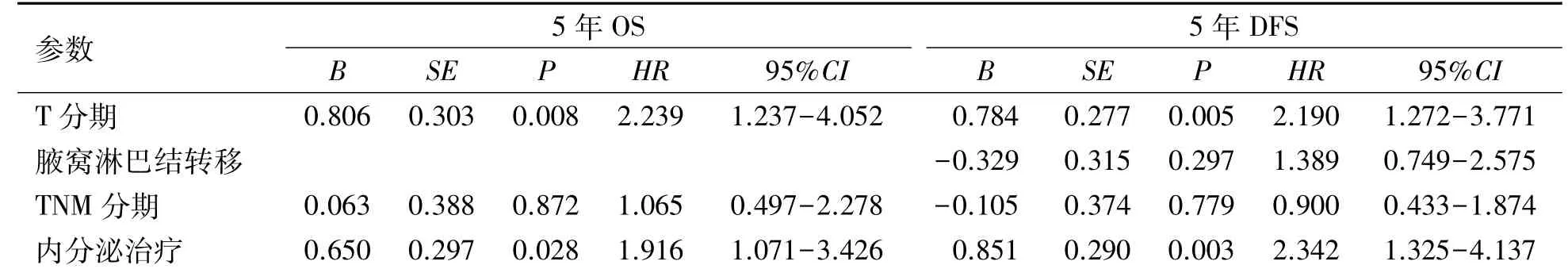
表4 影响男性乳腺癌5年OS和DFS的COX多因素分析Table 4 Multivariate analysis of prognostic factors affecting five-year overall survival(OS)and disease-free survival(DFS)of male patients with breast cancer using COX regression model Variable
3 讨论
男性乳腺癌是一种极少见的特殊类型乳腺癌,但近年男性乳腺癌的发病率呈上升趋势,并随着年龄逐渐增加[4-5]。有研究显示,国外男性乳腺癌的平均发病年龄约为65~67岁,比女性晚5~10年[6-7],国内男性乳腺癌的平均发病年龄在50~60岁,与女性乳腺癌的发病年龄频数分布呈现双峰的特点不同,MBC的发病率随着年龄逐渐升高[8-9]。本研究结果显示,114例MBC患者平均发病年龄58.9岁,与既往研究结果相同。研究显示,约20%MBC患者有乳腺癌家族史,一级亲属中患乳腺癌的男性罹患乳腺癌的风险将增加2倍[10]。本组患者中有乳腺癌家族史的患者共23例,占20.2%,与文献报道一致,且有乳腺癌家族史患者的5年无病生存率及总生存率均低于无乳腺癌家族史患者,但差异无统计学意义。有研究表明,男性乳腺癌与女性乳腺癌具有相似的临床病理特征,其中浸润性导管癌最常见(64.0%~93.0%),其次浸润性乳头状癌(2.6%~5.0%),浸润性小叶癌相对罕见[11]。全组浸润性导管癌87例(76.3%),浸润性乳头状癌10例(8.8%),浸润性小叶癌1例(0.9%),与文献报道类似,MBC浸润性小叶癌的比例远低于女性乳腺癌10%的比例,这可能是由于男性乳腺组织以导管成分为主,缺少小叶组织。以往研究表明,T分期和腋窝淋巴结转移是影响女性乳腺癌的重要预后因素,这也适用于男性乳腺癌[12-13]。本研究发现,就诊时的肿瘤大小是影响MBC预后的独立危险因素,是否存在腋窝淋巴结转移是影响男性乳癌5年无病生存的预后因素,就诊时肿瘤越大,有腋窝淋巴结转移,预后越差,与既往研究结果一致。MBC患者 ER、PR表达率高于 FBC,为75%~90%[14]。本组患者ER、PR阳性率分别为94.3%、90.6%,与文献报道接近。本研究发现,激素受体阳性患者的生存率较激素受体阴性的患者高,但差异不具有统计学意义,可能与病例数较少有关。
目前男性乳腺癌的治疗尚无定论,对于MBC的治疗原则均借鉴FBC[15]。外科手术是治疗早期男性乳腺癌的主要手段之一[16]。有研究表明,乳腺癌根治术和改良根治术对MBC局部复发率和远期生存率的影响无显著差异[17],本研究显示,MBC行乳房改良根治术及根治术的五年生存率分别为61.4%、67.0%,无统计学差异,与文献报道一致。辅助化疗是FBC治疗的重要手段,但对于MBC辅助化疗的相关研究尚不完善,既往有研究指出化疗可以改善男性乳腺癌患者的预后,并可降低局部复发和远处转移风险[18-19]。本研究显示,接受辅助化疗的MBC患者的生存率高于未化疗者,但因两组患者例数相差悬殊,未见统计学意义。目前尚无确切证据证明放疗可以提高男性乳腺癌的无病生存率及总生存率,本研究中接受术后放疗者和未接受者预后无差异。既往研究表明,由于MBC受体阳性率较高,因此内分泌治疗在MBC辅助治疗及姑息治疗中发挥主要作用。内分泌治疗可使MBC的5年DFS从47%提高至53%,5年OS从62%提高到75%[20]。有研究建议,内分泌治疗可作为激素受体阳性MBC出现复发及转移性MBC的一线治疗方案[21]。TAM和AI是FBC内分泌治疗的重要药物,TAM是雌二醇竞争性拮抗剂,能与雌激素竞争结合,形成不易解离的药物受体复合物,进而阻止雌激素促进肿瘤细胞的生长,同时还可以上调转化生长因子β,并特异性地抑制蛋白激酶C,均对肿瘤细胞有抑制作用。有研究显示TAM可以提高男性乳腺癌患者的生存率[22]。AI的机制是竞争性抑制或不可逆结合芳香化酶活性位点,使芳香化酶失活,从而降低体内雌激素水平。而AI在提高FBC患者DFS和OS方面的显著优势并未在MBC患者中得到充分体现[23],这是因为男性体内80%的雌激素是由芳香化酶转化雄激素而来,20%则由睾丸直接分泌,AI抑制芳香化酶活性降低雌激素水平的同时,会反馈性升高体内卵泡刺激素(follicle-stimulating hormone,FSH)和睾酮的水平,从而削弱AI降低MBC体内雌激素水平的效果。Eggemann等研究表明,与AI相比,TAM可将MBC的死亡风险降低1.5倍,对于TAM治疗激素依赖型的MBC效果更优[24]。本研究结果显示,114例MBC患者中72例接受了内分泌治疗,且接受内分泌治疗患者的5年无病生存率及总生存率分别为67.7%及71.7%,明显高于未接受内分泌治疗患者的30.5%及49.5%,差异有统计学意义,而多因素分析结果也表明,是否接受内分泌治疗是影响MBC患者无病生存率和总生存率的独立预后因素。本研究将接受内分泌治疗的患者分为TAM和AIs两组,发现AIs组5年DFS和OS均远低于TAM组,有统计学差异。内分泌治疗对于MBC获益明显,推荐使用TAM,而AIs疗效差。近期研究显示,联合使用TAM和AIs可防止或延缓耐药性的产生,从而使患者的受益率增加[25]。该结论有待大样本随机对照研究加以证实。
综上所述,男性乳腺癌发病率低,发病年龄晚,预后差,病理类型以浸润性导管癌为主,激素受体阳性率高,内分泌治疗受益明显,治疗药物推荐TAM。肿瘤大小及是否内分泌治疗是影响MBC预后的独立危险因素。因此早发现、早诊断及完善的综合治疗,尤其是内分泌治疗(首选TAM)是改善预后的关键。
