绝经前乳腺癌化疗致闭经相关因素分析及绝经评估的研究
2019-03-29谢贤和
吴 卿, 谢贤和
乳腺癌是全球女性最常见的恶性肿瘤之一。在中国,乳腺癌的发病率呈逐年上升趋势,居女性癌症发病之首,以绝经前妇女居多[1]。辅助化疗能延长早期乳腺癌患者的生存时间,尤其是年龄<50岁者[2];但化疗造成的卵巢功能损害能使部分乳腺癌患者发生暂时性或永久性闭经,称为化疗致闭经(chemotherapy-induced amenorrhea,CIA)。CIA是绝经前乳腺癌患者化疗后最常见的并发症之一,常带来不孕、高脂血症、骨质疏松、围绝经期综合症、心血管疾病等一系列副作用,严重影响了妇女的生活质量。对于激素受体阳性的乳腺癌患者,规范、准确的内分泌治疗不但经济方便,而且可显著提高疗效[2]。内分泌治疗的药物选择与患者是否绝经(卵巢功能永久性丧失)密切相关[3]。判断女性是否达绝经状态,仅仅依据月经状态是不恰当的,需要同时结合性激素水平的变化。本研究拟观察辅助化疗对早期绝经前乳腺癌妇女月经的影响,探讨CIA的发生及其影响因素,通过检测血性激素水平,初步了解化疗后卵巢功能的变化规律及CIA与绝经之间的关系,为乳腺癌妇女优化内分泌治疗用药提供临床依据。
1 对象与方法
1.1对象 收集笔者医院2013年2月-2017年2月收治的300例新发绝经前乳腺癌女性患者,年龄中位数48岁(32~59岁)。所有患者均接受根治性手术(包括改良根治术及保乳根治术)和至少4个周期的辅助化疗(包括新辅助化疗)。化疗方案包括含蒽环类药物的化疗方案、含紫杉类药物的化疗方案以及含蒽环类和紫杉类药物在内的化疗方案。其中,发生CIA者204例(68.0%),未发生CIA者96例(32.0%),性激素水平达绝经状态者68例(22.7%)(表1)。
排除标准:(1)初始治疗或随访过程中反映月经状况的信息缺失;(2)随访过程中行双侧卵巢切除术或子宫切除术;(3)化疗期间或结束后使用促性腺激素释放激素或类似物;(4)既往接受过化疗、放疗、内分泌及靶向治疗等抗肿瘤治疗;(5)合并可能导致性激素水平异常的疾病,如肝硬化等。
1.2方法 从病历资料中收集患者的信息,包括年龄、病理类型、肿块分期、腋窝淋巴结转移数、激素受体情况、人表皮生长因子受体-2(human epidermal growth factor receptor-2, HER-2)表达情况、化疗方案、是否接受放疗、内分泌治疗、曲妥珠单抗靶向治疗等;同时收集患者的血性激素水平[卵泡刺激素(follicuke stimulating hormone, FSH)、黄体生成素(clutenizing, LH)、雌二醇(estraoliol, E2)],检测方法采用电化学发光法(表2)。血性激素的检测时间间隔>1月,FSH和E2水平连续测定至少3次达绝经后水平者判断为达绝经状态。化疗后月经的变化等信息通过门诊就诊记录、电话随访获得。随访截止时间为2017年10月1日,随访时间中位数为21月(8~56月)。
1.3统计学处理 数据采用SPSS 19.0统计软件进行分析。采用ROC曲线、Fisher精确概率检验及卡方检验确定各因素与CIA之间的关系。使用Kaplan-Meier生存分析统计CIA发生时间与性激素达到绝经水平时间的差异,P<0.05为差别具有统计学意义。
2 结 果
2.1年龄与CIA的单因素分析 年龄与CIA的发生具有统计学意义(P<0.001),曲线下面积(area under the curve,AUC)0.899(95%CI:0.863~0.935)。年龄影响CIA的最佳临界值为43岁(图1)。

图1 年龄与CIA相关性分析的ROC曲线Fig 1 The ROC curve of correlation between age and CIA
2.2其他临床病理特征与CIA的相关性分析 CIA 的发生与肿块分期、腋窝淋巴结转移数、病理类型、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER-2状态无关(P>0.05),与化疗方案、是否接受放疗、曲妥珠单抗靶向治疗、内分泌治疗无关(P>0.05,表3)。

表1 研究对象的一般情况
CIA:化疗致闭经; HER-2:人表皮生长因子受体-2; T1:肿瘤最大径≤2 cm; T2:2 cm<肿瘤最大径≤5 cm; T3:肿瘤最大径>5 cm; T4:任何大小的肿瘤直接侵犯胸壁或皮肤.

表2 性激素参考值范围
2.3CIA与绝经的关系
2.3.1不同年龄组的月经状态 300例中,发生CIA者204例(68.0%),未发生CIA者96例(32.0%),未发生CIA患者的年龄中位数为38岁(25~52岁)。发生CIA者中,99.0%(202/204)为≥35岁女性,1.0%(2/204)为<35岁女性;112例(54.9%)在化疗结束后月经恢复,月经恢复的中位时间为6.7月(3.0~11.3月)。年龄≤45岁的患者较年龄>45岁的患者更容易恢复月经(91.4%vs35.8%)(P<0.001)。随访中发现,发生C1A者中有68例(33.3%)血性激素水平达到绝经后状态;与年龄≤45岁者比较,绝经更多见于年龄>45岁者(1.4%vs50.0%),差别有统计学意义(P<0.001)。至随访结束,24例(11.8%)患者发生CIA但性激素水平未达绝经状态(表4)。
2.3.2CIA与绝经的关系 在Kaplan-Meier分析中,CIA发生在化疗后2.6月(95%CI:2.331~2.869),明显早于血性激素达绝经水平的时间13.6月(95%CI:12.574~13.826),且差别具有统计学意义(2.6月vs17.2月,P<0.001,图2)。在46~50岁年龄组中,CIA发生在化疗后与性激素达到绝经水平的时间比较,差别有统计学意义(P<0.001,图3A)。在>50岁年龄组中,CIA的发生时间仍明显早于性激素达绝经水平的时间(1.9月vs12.1月,P<0.001,图3B)。
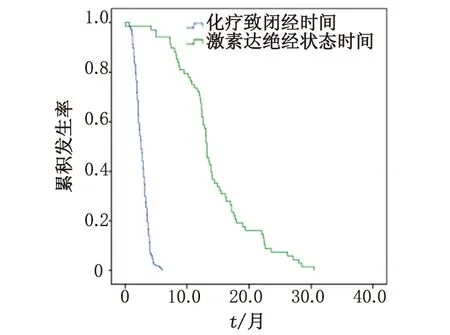
CIA:化疗致闭经.图2 CIA的发生时间与性激素达到绝经水平时间的差异Fig 2 The interval between CIA and menopause

临床病理因素n总nCIA(%)肿块分期 T110269(67.6) T2171117(68.4) T31611(68.8) T4117(63.6)腋窝淋巴结转移数 012687(69.0) 1~39865(66.3) 4~95236(69.2) ≥102416(66.7)病理类型 非特殊浸润性癌285192(67.4) 其他1512(80.0)ER和(或)PR阳性 是236157(66.5) 否6447(73.4)HER-2 阳性10476(73.1) 阴性196128(65.3)化疗方案 含蒽环类5736(63.1) 含紫衫类87(87.5) 含蒽环和紫衫类235161(68.5)放疗 是8358(69.9) 否217146(67.3)曲妥珠单抗治疗 是3019(63.3) 否270185(68.5)三苯氧胺治疗 是232159(68.5) 否6845(66.2)
CIA:化疗致闭经; ER:雌激素受体; PR:孕激素受体; HER-2:人表皮生长因子受体-2; T1:肿瘤最大径≤2 cm; T2:2 cm<肿瘤最大径≤5 cm; T3:肿瘤最大径>5 cm; T4:任何大小的肿瘤直接侵犯胸壁或皮肤.

表4 不同年龄组的月经状态
CIA:化疗致闭经.

A:46~50岁患者; B:>50岁患者.图3 患者发生CIA与性激素达绝经水平时间的差异Fig 3 The interval between CIA and menopause
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,每年约有120万例新增乳腺癌,有50万人死于乳腺癌。其中,约1/3新发乳腺癌患者的年龄<50岁[4-6]。近10年来,中国主要城市的乳腺癌发病率增长了37%,死亡率增长了38.9%。与西方女性相比,中国女性乳腺癌发病年龄早10~15年,发病高峰为40~49岁,占患者总数的34.5%[7]。
目前,越来越多乳腺癌患者从辅助化疗中获益,尤其是年龄<50岁者[5]。一方面,化疗通过直接的细胞毒作用杀死可能残留的肿瘤细胞;另一方面,化疗损伤抑制了卵巢功能、降低了雌激素水平,起到了内分泌的治疗作用。然而,化疗造成的卵巢功能损害常使部分乳腺癌患者发生暂时性或永久性闭经,称为CIA。CIA的发生受到多种因素的影响,其中较为确定的是年龄,它是CIA发生的独立危险因素。CIA对生存的影响尚有争议,多数研究认为,CIA可以延长乳腺癌患者的生存时间,改善预后[8-9],但同时可能给患者的生活带来一系列不良影响,如骨质疏松、性生活质量下降、绝经期症状、不孕等[10-11],以及由此给女性患者带来的精神上和心理上的双重压力。对于激素受体阳性的乳腺癌患者,规范、准确的内分泌治疗可显著提高疗效。而内分泌治疗的药物选择与患者绝经状态是密切相关的。因此,明确绝经前乳腺癌患者CIA发生的影响因素、是否绝经及相关预测指标对于后续辅助内分泌治疗的用药选择有重大临床意义。
迄今为止,几乎所有研究对于年龄与CIA的关系有一致的定论,年龄是CIA发生的独立影响因素,它不受化疗方案、化疗剂量或其他因素的影响。年龄对月经的影响终归是化疗药物对卵巢的损伤。卵巢属于化疗敏感器官,卵巢储备的卵泡数随着年龄的增长逐渐减少,年龄较大者接受化疗后卵泡更容易耗竭,卵巢功能更容易受细胞毒药物的影响[12-13]。Rosendahl等的研究显示,CIA在不同年龄组的发生率不同,在25~39岁组、40~44岁组、45~49岁组,CIA的发生率分别为32.1%,73.3%及92.4%;而在50~57岁组,CIA的发生率高达98.2%[14]。Jeruss等的研究报道了>40岁的早期乳腺癌患者在接受术后辅助化疗后,CIA的发生率比年龄≤40岁者高[15]。Sonmezer等的研究发现,22%~56%的年龄≤40岁的CIA患者出现了月经恢复正常,而年龄>40岁的CIA患者中仅有11%[16]。李惠平等的研究报道,初始化疗年龄≤40岁的乳腺癌患者CIA的发生率为15.88%,恢复率为58.82%;初始化疗年龄>40岁者CIA的发生率为84.11%,恢复率为15.55%;其中,年龄>45岁者CIA的发生率为91%,恢复率仅为10.86%[17]。Swain等对绝经前乳腺癌患者化疗后月经情况进行了相关研究,<40岁的CIA患者中有45.3%出现了月经恢复,40~50岁者月经恢复的只有10.9%,而>50岁者仅3.2%[18]。以上研究都说明了CIA的发生和恢复与患者的年龄关系密切。随着年龄的增长,CIA发生的风险增加,闭经后再恢复月经的可能性减少。
本研究通过ROC曲线分析了年龄与CIA的发生具有相关性,并且明确了年龄影响CIA的最佳临界值为43岁。300例患者中,CIA的发生率为68.0%(204/300),恢复率为54.9%(112/204),月经恢复的中位时间为6.7月(3.0~11.3月)。随着年龄的增长,CIA的发生率随之增加。本研究还发现,多数年龄≤45岁患者的月经在发生CIA后又逐渐恢复;而大多数45岁以上的患者发生CIA后仍然维持闭经状态直到性激素水平达到绝经后状态,仅少数患者恢复月经。随访发现,在CIA患者中,血性激素达绝经后水平在两个年龄组分别为1.4%及50.0%。由此可见,患者初始化疗的年龄是影响CIA发生及月经恢复的重要因素,同时可以作为预测CIA发生、月经恢复或绝经的重要指标。≥45岁的女性较<45岁者更容易出现CIA,且月经恢复可能性低;而≤45岁者,通过化疗诱导闭经并直接过渡到绝经状态的可能性较小,而恢复月经或维持闭经状态的可能性大。
目前,放化疗结束后序贯使用内分泌治疗是激素受体阳性乳腺癌患者的基本治疗原则。本研究中,232例(77.3%)患者化疗后序贯使用三苯氧胺(tamoxifen,TAM)进行内分泌治疗。化疗后序贯TAM内分泌治疗对CIA发生率的影响存在争议。部分研究显示,使用TAM者CIA的发生率高于未使用TAM者,且具有显著性差异[10,18-20]。分析其原因可能在于使用TAM后,血浆中E2的浓度增高,阻断了下丘脑-卵巢的反馈回路,影响雌激素的进一步合成,引起血浆雌激素水平下降,从而导致患者的月经状况出现变化。部分研究报道,化疗后序贯使用TAM内分泌治疗的绝经前乳腺癌患者CIA的发生率与未使用TAM者无显著性差异[21-23]。本研究结果发现,化疗后序贯使用TAM辅助内分泌治疗与CIA的发生不具有相关性(P>0.05)。
辅助内分泌治疗是激素受体阳性的早期乳腺癌患者术后的标准治疗方案,可降低其死亡率和复发率[24-25]。TAM是绝经前乳腺癌患者的首选内分泌治疗药物;但对于绝经后乳腺癌患者而言,芳香化酶抑制剂(如阿那曲唑、来曲唑、依西美坦)则取代TAM成为更优的内分泌治疗用药[26-27]。因此,明确乳腺癌患者是否绝经是非常重要的。本研究在Kaplan-Meier分析中发现,CIA的发生时间明显早于性激素达绝经水平的时间(2.6月vs13.6月),且差别具有统计学意义(P<0.001)。在46~50岁和50岁以上两个年龄组中,CIA的发生与性激素达绝经水平的时间间隔分别为14.6和10.2月。这一事件间隔为临床上出现CIA的乳腺癌患者绝经状态的判断提供了重要的参考价值。
值得一提的是,CIA的发生虽然有可能改善乳腺癌患者的预后,但同时也给乳腺癌患者带来了精神上和生理上的双重压力。CIA患者因卵巢功能过早丧失,导致雌激素分泌减少,影响女性的生育功能、性功能,引发潮热、失眠等绝经期症状,出现骨质疏松和心血管等相关事件,严重影响了患者的生活质量[28]。对于年轻的乳腺癌患者来说,治疗后高质量的生活和长期无病生存同样重要。化疗及其他辅助治疗的选择关系到患者的长期生存及生活质量。因此,对于CIA未恢复的高危患者若达到绝经状态,可以考虑使用芳香化酶抑制剂进行内分泌治疗;对于CIA有可能恢复的高危患者可进一步使用卵巢抑制剂;而对于年轻有生育要求的女性患者,可以进行卵巢保护,避免CIA带来的严重副作用,从而提高患者的生活质量。
