Ac-SDKP调节Rac1信号抑制皮肤肌成纤维细胞的转化和迁移
2019-03-29张巧丹李世峰
王 姗, 张巧丹, 李世峰, 徐 洪, 杨 方, 杨 洁
研究表明,转化生长因子β1(transforming growth factor,TGF-β1)介导的皮肤成纤维细胞迁移和向肌成纤维细胞转化是影响损伤修复和伤口愈合的重要因素,同时其异常活化也是介导瘢痕疙瘩形成的重要机制之一[1-2]。Rho GTP酶家族之一Ras相关的C3肉毒素底物(Ras related C3 botulin substrate 1, Rac1)能够调控细胞迁移,也是参与Rho介导的肌成纤维细胞转化和促进瘢痕形成的关键调控因子之一[3]。课题组前期研究发现,N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartyl-lysyl-proline,Ac-SDKP)能够抑制TGF-β1活化和阻断Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled-coil-forming protien kinase,ROCK)信号转导通路,进而发挥拮抗肌成纤维细胞转化和改善矽肺纤维化的作用[4]。本研究通过原代培养大鼠皮肤成纤维细胞,旨在观察Ac-SDKP通过阻断Rac1抑制皮肤成纤维细胞迁移和向肌成纤维细胞转化的作用及其机制。
1 材料与方法
1.1材料 DMEM培养基(美国Gibco公司);胎牛血清(fatal bovine serun,FBS)(德国PAA公司);Ac-SDKP(瑞士Bachem AG公司);TGF-β1、兔抗心肌蛋白相关转录因子(myocardin-related transcription factor, MRTF-A)(美国Sigma公司);兔抗α-SMA、兔抗Ⅰ型胶原(collagen type Ⅰ, ColⅠ)及兔抗GAPDH(美国Abcom公司);兔抗Rac1(美国Epitomics公司);兔抗血清应答因子(serum response factor, SRF)(中国Bilworld公司)。二步法通用型免疫组织化学试剂盒(PV6000,北京中杉金桥生物技术有限公司);二抗山羊抗兔IgG(美国KPL公司);ECL显色试剂盒(美国GE公司)。
1.2方法
1.2.1细胞培养与分组 出生1~2 d的乳鼠[中国医学科学院医学实验动物研究所,动作合格证号:SCXK(京)2010-0007]断颈处死,消毒,剪开颈背部的皮肤并分离,PBS浸洗后剪成2 mm×10 mm细条,置于0.25%的Dispase酶中,4 ℃冰箱中消化过夜。次日PBS洗1次,眼科镊分离皮肤组织的真皮和表皮,PBS浸洗1次,将真皮剪成1 mm3的组织块。采用组织贴壁法,置于37 ℃培养箱,在含有10% FBS的低糖DMEM培养条件下进行细胞培养。取第2代细胞进行实验。实验分组:空白对照组,无血清培养基培养;TGF-β1诱导组,无血清培养条件下,加入终浓度为100 nmol/L的TGF-β1诱导;Ac-SDKP预处理组,无血清培养条件下,先给予100 nmol/L的Ac-SDKP预处理1 h,再给予TGF-β1诱导。
1.2.2划痕实验检测细胞迁移能力 将第2代细胞种植于6孔板,待细胞生长至融合状态时,用100 μL的无菌枪头以6点的方向划痕,PBS冲洗除去细胞碎片后,按实验设计分组刺激24 h后,倒置显微镜下观测划痕愈合。
1.2.3免疫细胞化学法检测α-SMA及Rac1的表达 参照文献[5]中的细胞爬片制备方法,固定,高压修复,一抗(1∶150)4 ℃孵育过夜,37 ℃孵育二抗30 min,镜下控制DAB显色和复染,脱水透明,中性树胶封固。
1.2.4Western-blot法检测α-SMA,SRF,MRTF-A,ColⅠ及Rac1蛋白的表达 提取总蛋白,BCA试剂盒测量蛋白浓度后,按照20 g蛋白/泳道上样,常规电泳和电转,5%牛血清白蛋白封闭,一抗(1∶1 000)4 ℃过夜,二抗(1∶5 000)室温孵育1 h,电化学发光(electrochemiluminescence, ECL)法显色,伯乐凝胶成像系统采集图像,采用Image Pro Plus 6.0图像分析软件对蛋白条带进行积分光密度(integral optical density, IOD)值定量分析,所得指标与相应内参的比值作为该蛋白的相对表达量。

2 结 果
2.1Ac-SDKP对TGF-β1介导的皮肤成纤维细胞Rac1表达的调节作用 免疫细胞化学检测结果显示,TGF-β1诱导组的细胞体积明显增大,细胞核内Rac1棕褐色阳性表达明显,而Ac-SDKP预处理组可明显抑制Rac1的阳性表达(图1)。Western-blot检测结果显示,与空白对照组比较,TGF-β1诱导组的Rac1蛋白表达上调2倍,给予Ac-SDKP预处理后,Rac1表达下调至TGF-β1诱导组的18.75%,差别具有统计学意义(P<0.05,图2,表1)。
2.2Ac-SDKP对TGF-β1介导的皮肤成纤维细胞迁移能力的调节作用 倒置显微镜下观察显示,与空白对照组比较,TGF-β1可以明显促进乳鼠成纤维细胞向划痕空白区域迁移生长,给予Ac-SDKP预处理后再接受TGF-β1诱导,则可显著降低细胞迁移,差别具有统计学意义(P<0.05,图3)。
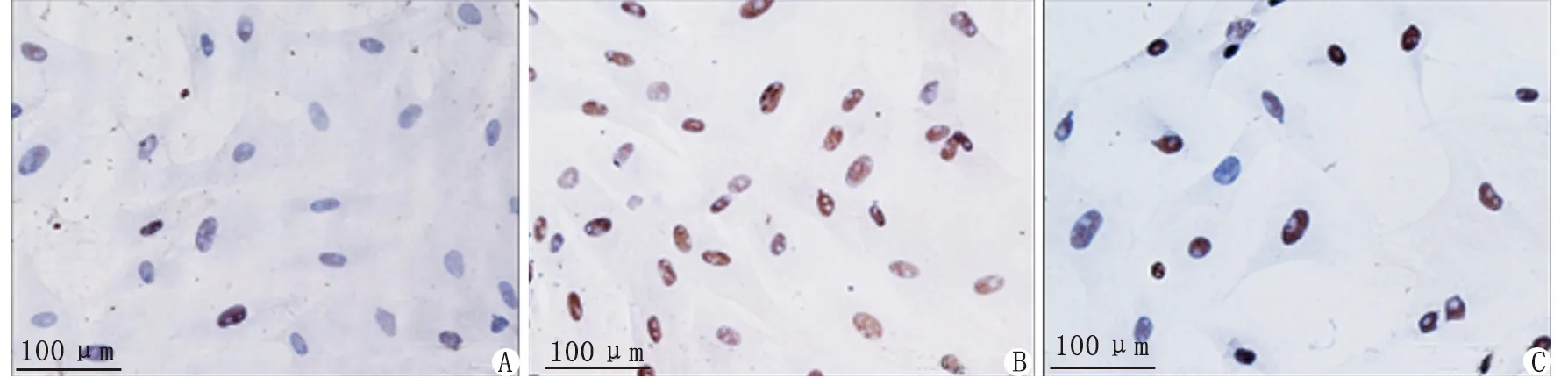
A:空白对照组;B:TGF-β1诱导组;C:Ac-SDKP预处理组.图1 皮肤(肌)成纤维细胞Rac1的表达Fig 1 The expression of Rac1 in skin (myo)fibroblasts
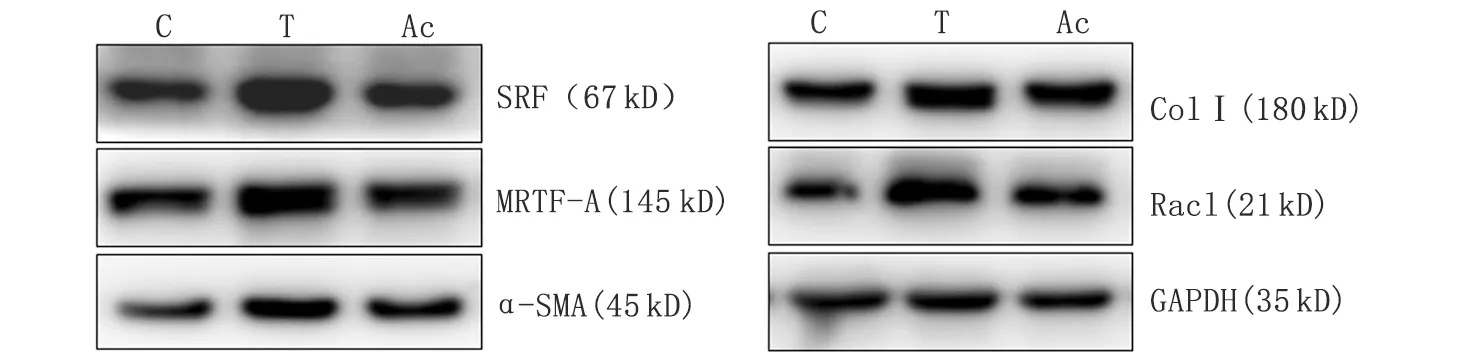
C:空白对照组;T:TGF-β1诱导组;Ac:Ac-SDKP预处理组.图2 皮肤(肌)成纤维细胞Rac1,α-SMA,SRF,MRTF-A及Col Ⅰ的定量表达Fig 2 The expression of Rac1,α-SMA,SRF,MRTF-A,Col Ⅰ in skin (myo)fibroblasts

分 组α-SMASRFColⅠMRTF-ARac1空白对照组0.70±0.101.08±0.240.98±0.330.82±0.270.97±0.05TGF-β1诱导组1.26±0.09☆1.83±0.03☆1.96±0.15☆1.44±0.48☆2.08±0.69☆Ac-SDKP预处理组0.72±0.10☆#1.24±0.49☆#1.40±0.17☆#0.75±0.09☆#0.39±0.17☆#
TGF-β1:转化生长因子-β1;α-SMA:α平滑肌肌动蛋白;Col Ⅰ:Ⅰ型胶原. 与空白对照组比较,☆:P<0.05;与TGF-β1诱导组比较,#:P<0.05.

A~C:倒置显微镜下观察. A:空白对照组(C组);B:TGF-β1诱导组(T组);C:Ac-SDKP预处理组(Ac组); D:3组细胞迁移面积比较,与空白对照组比较,☆:P<0.05;与TGF-β1诱导组比较,#:P<0.05.图3 皮肤(肌)成纤维细胞划痕实验Fig 3 Wound healing test of skin (myo)fibroblasts
2.3Ac-SDKP对TGF-β1介导的肌成纤维细胞转化的调节作用 免疫细胞化学检测结果显示,TGF-β1诱导后,细胞内的α-SMA强阳性表达,呈纤丝状平行交叉排列,给予Ac-SDKP干预后,α-SMA表达明显减弱(图4)。Western-blot检测结果显示,对照组的α-SMA,SRF,MRTF-A及ColⅠ表达水平均较低,给予TGF-β1刺激后,各蛋白的表达水平分别上调至对照组的1.8,1.69,1.76和2倍;而Ac-SDKP预处理组与TGF-β1诱导组比较,α-SMA,SRF,MRTF-A及ColⅠ分别下调至57%,68%,52%及71%(图2,表1)。以上差别经统计学分析,均有统计学意义(P<0.05)。

A:空白对照组;B:TGF-β1诱导组;C:Ac-SDKP预处理组.图4 皮肤(肌)成纤维细胞α-SMA的表达Fig 4 The expression of α-SMA in skin(myo)fibroblasts
3 讨 论
瘢痕疙瘩是皮肤损伤愈合中,由于胶原合成代谢机能异常和持续亢进,引起瘢痕组织过度生长的一种病理性过程。病理性瘢痕不但影响美观,而且显著影响患者的生理机能和生活质量[1-2]。目前针对病理性瘢痕尚无较好的治疗方案。对瘢痕疙瘩的治疗一直是皮肤科和整形外科的难点之一。
研究表明,TGF-β1在介导正常损伤修复和病理性瘢痕的发生、发展中起重要作用。体内外研究均显示,TGF-β1能够显著促进人皮肤成纤维细胞α-SMA和胶原蛋白表达上调,促进其迁移能力提高,导致瘢痕组织胶原沉积和病理性挛缩[6-8]。Rac1蛋白在正常的皮肤损伤愈合中,能够促进成纤维细胞迁移和伤口收缩[9]。近来研究发现,Rac1在硬皮病患者的成纤维细胞中可调节N-甲酰肽受体介导活性氧生成[10],针对Rac1的阻断能够抑制来源于硬皮病患者的成纤维细胞胶原的合成和肌成纤维细胞的分化[11],提示Rac1在成纤维细胞中的高表达可能是其分泌胶原和促进肌成纤维细胞分化的重要机制之一。本研究也发现,TGF-β1能够显著促进皮肤成纤维细胞Rac1蛋白表达,同时Ⅰ型胶原和肌成纤维细胞的相关指标SRF,MRTF-A和α-SMA表达显著上调,并伴有成纤维细胞迁移能力的提高,提示Rac1可能参与了对皮肤成纤维细胞迁移能力和肌成纤维细胞转化的调控。
笔者所在课题组多年来围绕Ac-SDKP抗纤维化作用进行了系列研究,发现Ac-SDKP对成纤维细胞的增殖、肌成纤维细胞分化和上皮-间质转化的抑制,是其抗器官纤维化作用的主要机制[12-13]。研究发现,Ac-SDKP能够通过促进血管生成、诱导上皮再生等机制促进大鼠皮瓣移植的存活率[14]。国内研究也显示,Ac-SDKP能够抑制人真皮成纤维细胞增殖,以及Ⅰ型和Ⅲ型胶原mRNA的表达,还能够抑制成纤维细胞分泌TGF-β1[15-16],提示Ac-SDKP具有潜在的抑制病理性瘢痕的作用。本研究结果显示,Ac-SDKP能够抑制TGF-β1诱导的肌成纤维细胞分化和迁移能力的提高,同时抑制了Rac1蛋白的表达。这些结果将为系统研究Ac-SDKP的抗器官纤维化效应机制,以及作为潜在的抗纤维化药物提供进一步的理论和实验依据。然而,本研究仍存在一些局限性,由于缺乏信号抑制剂,或是Rac1沉默或过表达的对照组,因此,很难明确判断Ac-SDKP对Rac1起到何种调节作用。此外,目前仅从体外研究发现Ac-SDKP对病理性瘢痕的潜在作用机制,但缺乏体内研究的进一步论证。这也将是课题组未来研究的重点方向之一。
