绿色低耗下高纯度莫尔盐的制备
2019-03-29温艳丽吴静静黄建国笪贤怡
温艳丽,高 旭,吴静静,黄建国,笪贤怡
(鞍山师范学院,辽宁 鞍山 114000)
莫尔盐又称硫酸亚铁铵,在实验室中分为以下两步制备:第一步是使铁和硫酸反应生成硫酸亚铁;第二步是将后者与硫酸铵按照物质的量比为1∶1反应,利用复盐的溶解度比生成它的正盐都要小的原则,经过水浴蒸发、浓缩、结晶得到莫尔盐。
我们用废铁屑做原料来代替还原性铁粉来铁制备硫酸亚铁铵,铁资源被重复利用,体现低耗性。废铁屑中的S、P、C等杂质和硫酸反应时生成H2S、HP3等酸性有毒气体,在原来的敞开式的实验装置中被直接排放到空气中,不仅造成环境污染,而且还会危害实验人员的健康,我们将原来的实验装置改闭路回收式来吸收尾气,并利用废铁屑除油后所得的碳酸钠溶液吸收尾气,体现了低耗性和绿色性。在绿色低耗的基础上,我们又对得到高纯度、高产率的莫尔盐的条件进行探索。
1 实验部分
1.1 药品及仪器
药品:废铁屑、Na2CO3溶液 (质量分数为10%)、H2SO4溶液 (3mol/L)、HCl溶液 (3mol/L),KSCN溶液(质量分数为0.25)、 (NH4)2SO4(分析纯)、NH4Fe(SO4)2·12H2O(分析纯)、无氧蒸馏水。
仪器:25mL比色管、电子分析天平、布氏漏斗、蒸发皿、表面皿、比色架、恒温水浴锅、蒸馏瓶、酒精灯、冷凝管、铁架台、广口瓶、烧杯。
1.2 实验原理
铁和硫酸反应,生成硫酸亚铁铵。
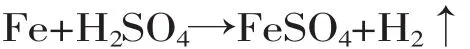
硫酸亚铁和硫酸铵混合,生成莫尔盐晶体。

1.3 实验步骤
1.3.1 废铁屑除油
我们用废铁屑做原料来制备莫尔盐,但其常带有油污,除去油污的具体操作为:取10g铁屑于锥形瓶中,加入一定量质量分数为10%的Na2CO3溶液,然后在酒精灯上加热10min,并不断摇晃,用倾析法除去碱液,最后,蒸馏水倾析法将除油后的铁屑洗至中性,干燥后备用。
1.3.2 制备硫酸亚铁
原来敞开式实验装置造成环境污染,进而改为闭路回收式吸收尾气,实验装置如图1。
取2g干燥后的铁屑放入圆底烧瓶中,加入10ml 3mol/L的硫酸,待反应完毕,趁热用布氏漏斗抽滤。
用废铁屑净化除油后所得的Na2CO3做废气吸收液,提高药品利用率,体现低耗性。此实验装置密闭性好,废气经Na2CO3吸收液吸收转变为无害物质,实验室再无刺激性气味,改善了环境条件,体现了绿色性。加热过程中水分几乎不流失,不需要添加水分,同时也不会造成有硫酸亚铁晶体析出导致过滤损失而影响最终产率。
1.3.3 制备莫尔盐
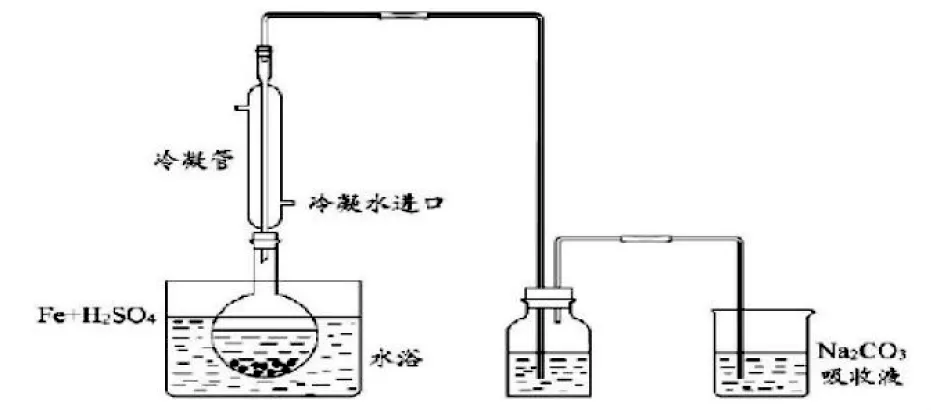
图1 硫酸亚铁制备装置
根据溶液中硫酸亚铁的量,称取硫酸铵,配置成硫酸铵的饱和溶液。将后者加到硫酸亚铁溶液中 (调节溶液pH,使之接近于1),水浴蒸发,浓缩至表面出现晶膜即停止加热,缓慢冷却,即得莫尔盐晶体,减压过滤除去母液,并尽可能地吸干。把晶体转移到表面皿上晾干,称重,计算产率。
1.3.4 确定产品纯度
取1g莫尔盐于25mL比色管,加3mol·L-1HCl溶液2mL,25%KSCN溶液1mL,待溶解后用无氧蒸馏水定容并摇匀,与标准色阶比较,从而确定莫尔盐的纯度等级。
2 结果讨论
在温度高于80℃时,硫酸亚铁的溶解度与温度成反比,温度越高,溶解度越低,并且,硫酸亚铁一旦以晶体的形式析出,便不易再溶解。
通过控制反应的水浴温度,得到的产品产率及级别如表1所示.

表1 铁与硫酸在不同的水浴温度下对莫尔盐产率及纯度的影响
虽然随着温度的升高,反应速率在不断加快,但温度升高更有利于二价铁被化为三价铁从而使产品纯度等级降低,而且当温度高于80℃,硫酸亚铁会以晶体的形式析出,从而降低莫尔盐的产率,因此,为保证产品纯度和产率,选择的最佳水浴温度为60℃。
由表2可知,但此时的晶型并不是最好的,当投料比为1∶0.9时,虽产率不是最高,但晶型最好,当投料比为1∶1时,产率最高。
值得注意的是,在硫酸亚铁铵蒸发浓缩的过程中,要水浴加热缓慢浓缩,同时尽可能不要搅拌或偶尔搅拌,这样尽可能有利于晶膜的形成。蒸发浓缩过程中不能将溶液蒸干,因为莫尔盐含有较多的结晶水,蒸干后便得不到浅绿色的莫尔盐晶体。
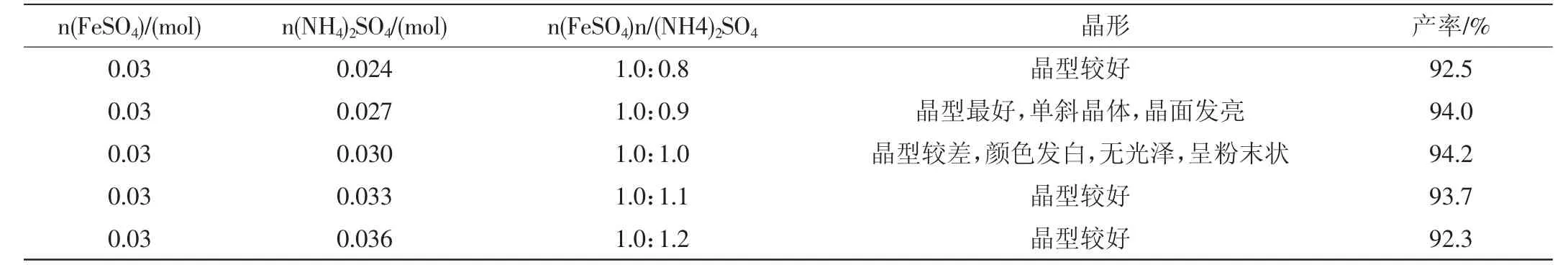
表2 硫酸亚铁和硫酸铵的不同投料比下莫尔盐的产率
3 结语
实验结果表明,以工业废铁屑为原料,以圆底烧瓶为反应容器,水浴60℃加热反应制备莫尔盐,在硫酸亚铁和硫酸铵投料比为1∶0.9的情况下反应,用布氏漏斗减压抽滤,加热浓缩,结晶,可得产率约为94%、纯度为Ⅰ级纯的晶型较好的莫尔盐。
