PS-HQD树脂吸附废水中Cu2+的动力学与热力学研究
2019-03-29周小华周泽仪
周小华,周泽仪
(1.昆明学院 昆明滇池(湖泊)污染防治合作研究中心,云南 昆明 650214;2.华南农业大学,资源环境学院,广东 广州 510642)
铜是一种应用广泛的金属。在化工、电镀、冶金等行业排放的Cu2+严重影响环境水体、土壤质量,对生态环境造成较大的污染[1-2]。Cu2+是对人体健康有重要影响的微量营养素,但是,过量的Cu2+又能诱导疾病的产生[3]。因此如何去除和回收污染水体中的Cu2+是一个亟需解决的问题,学者们也进行了大量研究[4-5]。目前Cu2+处理方法常有吸附法[6]、沉淀法[7]、氧化还原法[8]、膜分离法[9]等,吸附法因其具有耗能少、高效率、可资源化等优点而备受关注[10-11]。因此制备环境友好型和高效低廉型的Cu2+吸附剂成为研究热点。课题组前期以聚苯乙烯为母体,以8-羟基喹哪啶为交联剂,制备了8-羟基喹哪啶树脂(PS-HQD),研究了树脂吸附Cu2+的最佳吸附条件、吸附容量及吸附选择性,本研究在此基础上,采用静态法进一步探讨PS-HQD的吸附热力学与动力学规律,进一步了解吸附机理,为螯合树脂在Cu2+的资源回收利用提供一定的理论指导和技术支持。
1 实验部分
1.1 试剂和仪器
Cu2+标准溶液按《化学试剂杂质标准溶液制备方法》 (GB602-77)配制,其余试剂除特别注明外,均为分析纯。SHA-C型水浴恒温振荡器;TAS-990原子吸收分光光度计;WGH-30/6型双光束红外分光光度计。
1.2 树脂的合成与预处理
实验自制PS-HQD树脂[12],无水乙醇浸泡24 h后,用2.0mol/L HCl溶液平衡24 h,蒸馏水淋洗至中性,晾干待用。
1.3 Cu2+浓度测定
参照文献 [13]原子吸收法测定溶液的Cu2+浓度。
1.4 Lagergren动力学模型拟合实验
吸附动力学模型常用准一级动力学模型与准二级动力学模型表征。在pH为6.0时,加入定量的树脂与Cu2+标准溶液,室温振荡,每隔一段时间测定溶液中Cu2+的浓度,计算t时刻时树脂的吸附量,按照(1) ~(2) 式Lagergren动力学模型对实验结果进行拟合,判定树脂吸附的动力学反应级数。
准一级动力学方程:
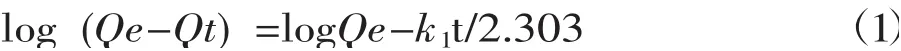
准二级动力学方程:

式中Qe为平衡吸附容量,mg/g;k1是准一级吸附速率常数,/min;h为初始吸附速率常数,mmol/(g·min);k2是准二级吸附速率常数,g/(mmol·min)。
1.5 扩散动力学分析
液膜扩散到吸附剂表面(液膜扩散)、吸附剂表面渗入吸附剂内部(颗粒内扩散)和活性基团发生交换(化学反应扩散)3个过程直接影响树脂吸附反应速率[14],处理室温下的动力学实验数据,液膜扩散、颗粒内扩散和化学反应模型(3) ~(5)式,判定树脂吸附的主要控速模型。

式中:F为离子交换度,Qt是吸附时间为t时的吸附量,kt为扩散系数。
1.6 温度对吸附的热力学分析
准确称取100 mg干树脂,加入20 mL pH=6.0的缓冲液预先浸泡,各加入2.0 mL的Cu2+标准溶液,分别于15℃、25℃、35℃和45℃恒温振荡12小时,测其平衡时Cu2+浓度,根据van't Hoff方程求出相关参数。
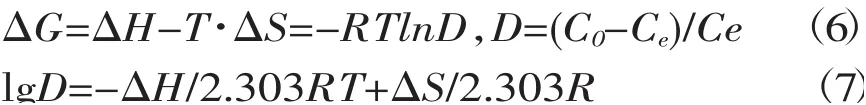
式中C0和Ce为吸附前、平衡时溶液中Cu2+浓度,mg/mL;ΔG为自由能变;ΔH为焓变;T为热力学温度 (K),ΔS为熵变;D为平衡分配常数,R 为气体常数,8.314J/(mol·K)。
2 结果与讨论
2.1 Lgergren动力学研究
吸附动力学是研究吸附平衡与吸附速率的相关性,即吸附时间与吸附过程的相关理论[15]。通过改变吸附时间,测定溶液中Cu2+的浓度,计算不同时间时树脂的吸附量,采用Lgergren准一级动力学模型和准二级动力学模型进行线性拟合分析,结果如图1、图2所示。2种动力学模型都能拟合树脂吸附Cu2+的过程。

图1 Lgergren准一级动力学模型
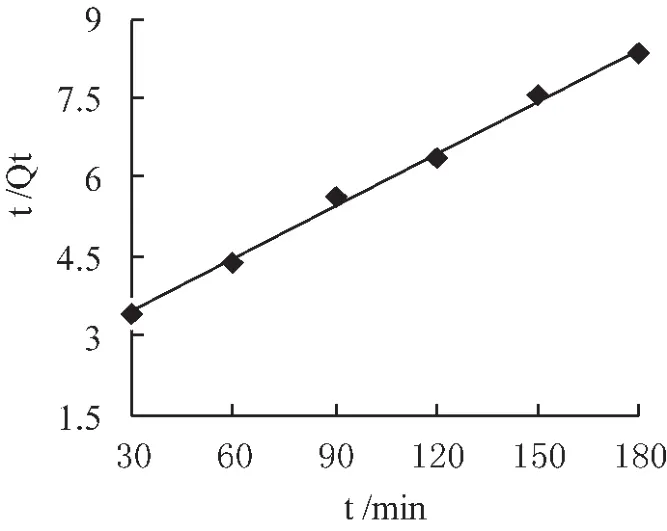
图2 Lgergren准二级动力学模型
动力学模型的基本参数如表1所示。准二级动力学模型的相关系数高于准一级动力学模型的相关系数,准二级动力学模型拟合的理论吸附量(Qe.cal)与实验平衡吸附量(Qe.exp)接近,故准二级动力学模型拟合果更好。
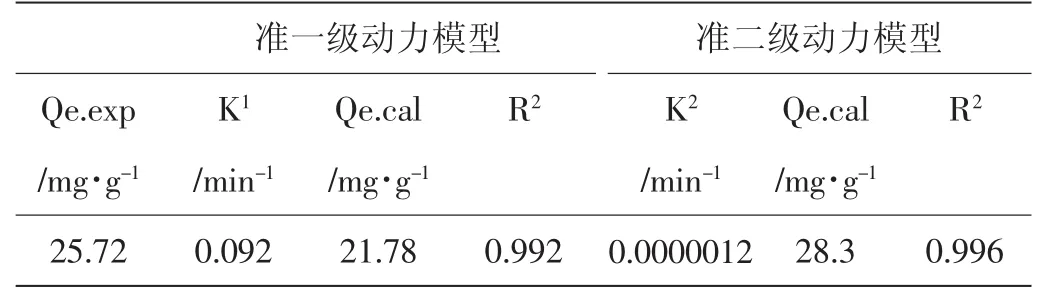
表1 Lagergren动力学模型基本参数与相关系数准一级动力模型 准二级动力模型
2.2 扩散动力学分析
以-ln(1-F)对t作图 (图3),所示成一直线,其相关系数R2=0.998;以1-3(1-F)2/3+2(1-F)对 t作图 (图4),其相关系数 R2=0.722;以1-(1-F)1/3对t作图 (图5),其相关系数 R2=0.847;本研究扩散动力学拟合图能较好的符合液膜扩散模型,树脂的吸附表观速率常数k为9.2×10-3s-1,Boyd.C.E.等认为,若-ln(1-F)~t成线性关系,说明液膜扩散为吸附过程的主控步骤[16],表明树脂对Cu2+的吸附是以液膜扩散为主控步骤过程。
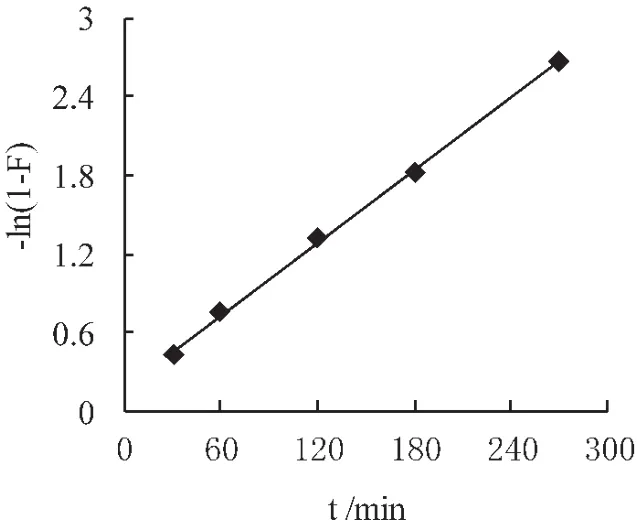
图3 液膜扩散模型
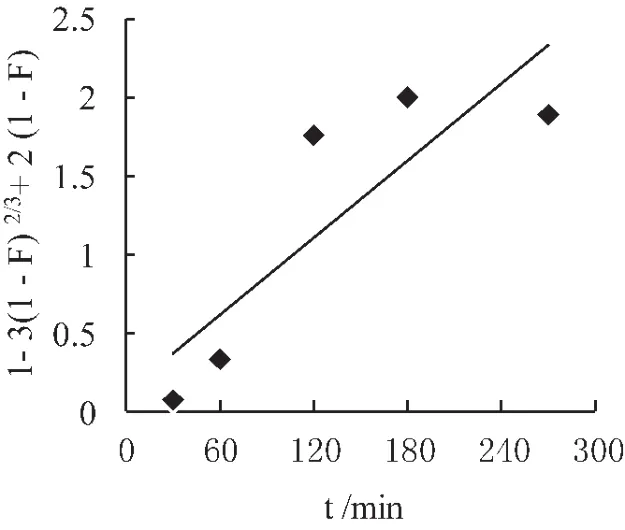
图4 颗粒内扩散模型

图5 化学反应扩散模型
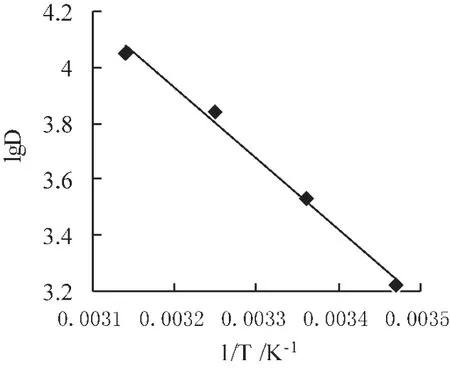
图6 温度对分配比的影响
2.3 温度对吸附的影响吸附热力学
以 lgD对 1/T作图得一直线 (图 6),R2=0.9924。直 线 斜 率 为 K斜=-2.546×103,根 据van'tHoff方程计算不同温度的ΔG值、ΔH值和ΔS值,结果如表2所示。根据直线斜率与截距,得 ΔH=48.74 kJ/mol,ΔS=0.2312 kJ/(mol·K),△H与ΔS均为正值,说明树脂吸附Cu2+的过程是混乱程度增大的吸热过程[17-18],树脂在不同温度的ΔG均为负值,一般认为ΔG在-20~0 kJ/mol为物理吸附,-40~-800 kJ/mol为化学吸附[19],实验所得 ΔG 分别为-17.84、-20.07、-22.46、-24.77 kJ/mol,随着温度的递增,ΔG值下降,表明吸附是同时包含物理吸附与化学吸附的自发过程;TΔS>ΔH,说明吸附是由熵变控制的过程[20]。上述分析表明PS-HQD树脂对Cu2+的吸附是吸热、无序、自发的过程。

表2 热力学函数
2.4 树脂的再生性能
将吸附了Cu2+的树脂洗脱后过滤,分别用10%HCl溶液反复清洗,最后用蒸馏水清洗至中性,然后再称取回收的树脂100 mg,加入20 mL pH为6.0缓冲液和5.0 mLCu2+标准溶液,在25℃下恒温振荡12 h,测定吸附后的Cu2+浓度,反复吸附-洗脱过程4次后,根据第5次吸附前后废水中Cu2+浓度的差异计算吸附量,再生效率按(8)式计算,以此评价该树脂的再生性能。

式中Qr和Qe分别代表再生后和再生前的树脂的饱和吸附容量,mg/g。

表3 第5次吸附时,树脂对Cu2+的吸附性能
由表3可知,PS-HQD的第5次吸附量仍可达到21.15 mg/g,虽然比第一次的吸附容量在所下降,但是RE仍可达到83.84%,表明树脂的再生性能较好。
3 结论
在pH为6.0时,PS-HQD树脂对Cu2+的准二级动力学模型相关系数在0.99以上,能很好拟合树脂吸附Cu2+的过程;Cu2+吸附的液膜扩散方程呈直线,其相关系数为0.998,表明Cu2+的吸附以液膜扩散为主控步骤过程;热力学参数ΔH为48.74 kJ/mol,ΔS 为 0.2312 kJ/(mol·K),ΔH 与 ΔS均为正值,而ΔG为负值,且ΔH小于TΔS,表明树脂对Cu2+的吸附过程为熵驱动的吸热、熵增的自发过程;树脂对Cu2+的第5次的吸附容量仍可达到21.15 mg/g,RE为 83.84%,树脂有较好的再生性能。
