桃SERK2的克隆及其在不同状态愈伤组织中的表达分析
2019-03-29谭彬陈谭星韩亚萍张亚如郑先波程钧王伟冯建灿
谭彬,陈谭星,韩亚萍,张亚如,郑先波,程钧,王伟,冯建灿
桃的克隆及其在不同状态愈伤组织中的表达分析
谭彬1,2,陈谭星1,韩亚萍1,张亚如1,郑先波1,2,程钧1,2,王伟1,2,冯建灿1,2
(1河南农业大学园艺学院,郑州 450002;2河南省果树瓜类生物学重点实验室,郑州 450002)
【目的】分离克隆桃(L.)体细胞胚胎发生相关类受体蛋白激酶(somatic embryogenesis receptor-like kinases,SERKs)基因,检测其在不同状态桃愈伤组织中的表达差异,分析与胚性愈伤组织发生的关系,为揭示组织培养困难树种桃胚性愈伤组织产生的分子机理奠定基础。【方法】采用同源克隆法获得的cDNA全长序列,运用TMPred、DNAMAN和MEGA 5.0等生物信息学软件对序列进行分析;以‘秋蜜红’花药为外植体,接种至添加2.0 mg·L-16-BA和1.0 mg·L-12,4-D的NN69培养基诱导愈伤组织;将获得的不同状态愈伤组织制作石蜡切片并进行组织细胞学观察;通过实时荧光定量PCR(qRT-PCR)对在4种不同状态愈伤组织中的表达进行分析。【结果】克隆获得‘秋蜜红’的cDNA全长序列1 881 bp,编码626个氨基酸,其蛋白质理论分子量为68.99 kD,理论等电点为5.38,具有完整的SERK蛋白的保守结构域,与牡丹()等物种的同源性为67.88%—92.71%,且与秘鲁番茄()和温州蜜柑()的相似性最高。在与其他物种的SERK蛋白构建的系统进化树中,PpSERK2与SpSERK1、CitSERK1和PsSERK2等聚在一起,与同源性比对结果一致。以‘秋蜜红’花药为外植体诱导获得4种不同状态的愈伤组织,组织细胞学观察发现黄色疏松状(球形胚出现)、绿色紧实状(心形胚出现)和浅黄色透明状(尚未完全形成的鱼雷形胚结构出现)的3种状态的愈伤组织细胞小、排列紧密;而黄白色水渍状愈伤组织细胞体积大、排列不规则,细胞质稀且染色浅。根据形态学和组织学的鉴定结果,可知黄色疏松状、绿色紧实状和浅黄色透明状的3种状态的愈伤组织均为胚性愈伤组织,而黄白色水渍状愈伤组织为非胚性愈伤组织。实时荧光定量PCR(qRT-PCR)结果表明,在‘秋蜜红’3种状态的胚性愈伤组织中的表达量显著高于非胚性愈伤组织,且在3种胚性愈伤组织中的表达量有差异,其中在黄色疏松状愈伤组织中表达量最高,绿色紧实状次之,浅黄色透明状中最低。【结论】克隆获得的cDNA全长序列,其在3种状态的胚性愈伤组织中的表达量明显高于非胚性愈伤组织,且在黄色疏松状胚性愈伤组织中的表达量最高,在桃体细胞胚发育的早期发挥作用。
桃;体细胞胚发生;;胚性愈伤组织
0 引言
【研究意义】植物体细胞胚胎发生指外植体的体细胞在离体条件下,经过特定培养,发生与合子胚相类似的发育途径,最终形成新个体的过程[1]。植物遗传转化的众多研究已经证明通过胚性愈伤组织诱导体细胞胚再生系统转化率较高且稳定,因此,胚状体再生系统是最为理想的遗传转化受体系统[2]。桃是重要的果树之一,目前,制约现代生物技术应用于桃上的关键环节就是缺乏成熟的离体再生和遗传转化体系[3]。基于此,开展桃胚性愈伤组织和体细胞胚的诱导及研究控制体细胞胚发生的相关基因对成功获得桃胚状体再生系统具有重要意义。【前人研究进展】已成功离体培养获得体细胞胚的植物,大多数为草本植物,木本植物中仅有核桃、落叶松、板栗、乌桕、柑橘、葡萄等体细胞胚诱导获得成功[4-10],其中,柑橘和葡萄还利用胚状体再生途径建立了稳定高效的遗传转化体系[11-12]。已经克隆的与植物体细胞胚发生相关的基因有()、()、()和(somatic embryogenesis receptor-like kinases,SERKs)等,、和等能提高体细胞胚发生率或维持体细胞胚发生[13-15],在体细胞胚产生后才发挥作用,不能促使体细胞从营养生长向胚性生长的转化。SERK蛋白广泛存在于植物当中,Schmidt等[16]首先从胡萝卜组织中获得第一个,并发现它只在胚性细胞内表达。随后,相继在拟南芥[17]、玉米[18]、苜蓿[19]、向日葵[20]、水稻[21]、小麦[22]、棉花[23]等植物中获得,且在体胚发生过程中均可以检测到它们的表达。拟南芥在花芽和发育初期的合子胚中表达显著高于叶、根和茎[17, 24]。Andrea等[25]研究表明甘蓝型油菜(和)在小孢子培养1—5 d后表达量明显上调,在整个小孢子胚期(microspore-derived embryos,MDEs)表达量持续上升。Péreznúñez等[26]研究表明的表达与椰子体细胞胚的产生有关,它在胚性愈伤组织中表达,而在非胚性愈伤组织中低表达或检测不到。相似的结果在香蕉和棉花中发现,其中香蕉体细胞胚的发生频率与的表达量呈正相关[24];过量表达使棉花体胚发生能力增强[27],而在生殖器官中表达量明显高于营养器官,在体胚发生过程中在球形胚中的表达量最高[23]。以上结果表明不仅能促进体细胞胚的发生,还标志着体细胞从营养生长向胚性生长转变,预示可能会被发展成为体细胞胚发生的标记基因[16]。【本研究切入点】桃离体再生体系研究进展极其缓慢,有关体细胞胚的诱导及体细胞胚发生相关基因的研究报道较少。通过对桃的克隆和表达分析,有助于从分子水平了解在桃胚性愈伤组织及体胚发生过程中的作用,探究桃再生体系建立困难的原因。【拟解决的关键问题】本研究通过克隆桃,分析其在不同状态愈伤组织中的表达,揭示在桃胚性愈伤组织及体细胞胚胎发生中的作用,为提高桃胚性愈伤组织的体细胞胚胎发生能力提供理论指导。
1 材料与方法
1.1 植物材料
‘秋蜜红’(‘Qiumihong’)茎尖取自河南农业大学果树种质资源圃,样品采集后迅速放入液氮速冻并带回实验室,-80℃保存。
以‘秋蜜红’花药为外植体诱导愈伤组织,‘秋蜜红’花蕾采摘于河南农业大学果树种质资源圃,采回后取花药在无菌条件下进行培养,获得的不同状态的愈伤组织,用于后续的石蜡切片制作和表达分析。
1.2 PpSERK2的克隆
采用改良的CTAB法[28]提取桃茎尖及愈伤组织RNA,用1.5%琼脂糖凝胶电泳检测RNA的质量。利用反转录试剂盒(High Capacity cDNAReverse Transcription Kit,ABI)合成cDNA,-20℃保存备用。
根据目标研究基因在GenBank(登录号为XP_007201734.1)中已知的cDNA序列,利用Vector NTI软件设计特异性引物(上游引物5′-ATGGAGAG CAAGGTAGGGAA-3′,下游引物5′-TCACCTTGGA CCAGATAATTCA-3′),以桃茎尖RNA反转录合成的cDNA为模板进行PCR反应,PCR反应体系(20 μL)为1 µL cDNA、上下游引物(10 µmol·L-1)各1 µL、10 µL 2×Plus Mster Mix(Dye Plus),补ddH2O至20 µL。PCR反应条件为95℃4 min;95℃ 30 s,57℃30 s,72℃ 110 s,30个循环;72℃10 min。扩增产物经1.5%琼脂糖凝胶电泳检测,回收目的片段,连接至PMD 20-T载体,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
1.3 PpSERK2的生物信息学分析
所有序列均来自于NCBI(http://www.ncbi.nlm. nih.gov/);运用Expy Protparatam(http://www.expasy. ch//tools/protparam.htmL)在线预测编码蛋白质的理化性质;运用TMPred(http://embnet.vital-it. ch/software/TMPRED_form.html)进行PpSERK2跨膜区的预测;利用plant-mPloc(http://www.csbio.sjtu.edu. cn/bioinf/plant-multi/)预测亚细胞定位;采用InterProScan(http://www.ebi.ac.uk/InterProScan/)程序分析保守结构域;用DNAMAN软件对不同植物的氨基酸序列进行同源比对;利用MEGA 5.0软件对不同植物的SERK序列构建系统进化树。
1.4 ‘秋蜜红’花药愈伤组织的诱导
将田间采集的‘秋蜜红’小花蕾期花蕾去除下部芽鳞片,在洗涤剂中浸泡15—30 min,流水冲洗0.5—1 h。在无菌条件下,首先将花蕾用75%酒精进行消毒,无菌水冲洗3次;然后用0.1%NaClO消毒处理5 min,无菌水冲洗5—6次;在超净工作台内将花药接种到NN69+6-BA 2.0 mg·L-1+2,4-D 1.0 mg·L-1+蔗糖60 g·L-1培养基,于25℃暗培养至愈伤组织长出,每4周继代一次。
1.5 石蜡切片的制作及镜检
将需要固定的花药愈伤组织放入盛有FAA固定液的标本瓶中,盖上橡胶盖,用注射器缓慢抽气,除去材料表面的气泡直至材料沉于瓶子底部,不再有气泡冒出为止,4℃固定24—72 h。参照李和平[29]的方法制作石蜡切片,在正置光学显微镜(Nikon Eclipse E100,日本)下采集图像信息。
1.6 实时荧光定量PCR分析
根据已得到的全长,利用Primer 3.0在线工具(http://primer3.ut.ee/)设计实时荧光定量PCR引物(F:5′-TGTTGCTTGATTGGGTGAAA-3′;R:5′-CATTGGAGAACCTTGTGC-3′),以桃为内参基因(F:5′-AGCTGGTCATGTCAAAGTCCA-3′;R:5′-ACAAGCCAACTCGGAACT-3′),引物由生工生物工程(上海)股份有限公司合成。以‘秋蜜红’不同状态的愈伤组织cDNA为模板,对进行qRT-PCR分析。实时荧光定量PCR体系为SYBR Premix(2×)10.0 μL、上下游引物(10 μmol·L-1)各1.0 μL、cDNA 2.0 μL和DEPC H2O 6.0 μL。qRT-PCR反应条件参照韩亚萍[30]方法,每处理重复3次,以2-ΔΔCT法进行数据分析。
1.7 数据统计与分析
运用SPSS17.0软件进行试验数据的统计学分析,采用邓肯式新复极差法进行处理间差异分析(<0.05)。
2 结果
2.1 PpSERK2的克隆
用1.5%琼脂糖凝胶电泳检测‘秋蜜红’茎尖RNA,28S和18S条带清晰,且28S条带比18S的条带亮,结果表明,RNA的质量和浓度均可用于下一步的试验(图1-A)。以‘秋蜜红’茎尖cDNA为模板进行PCR扩增,获得一条约为1 881 bp的目的片段(图1-B)。
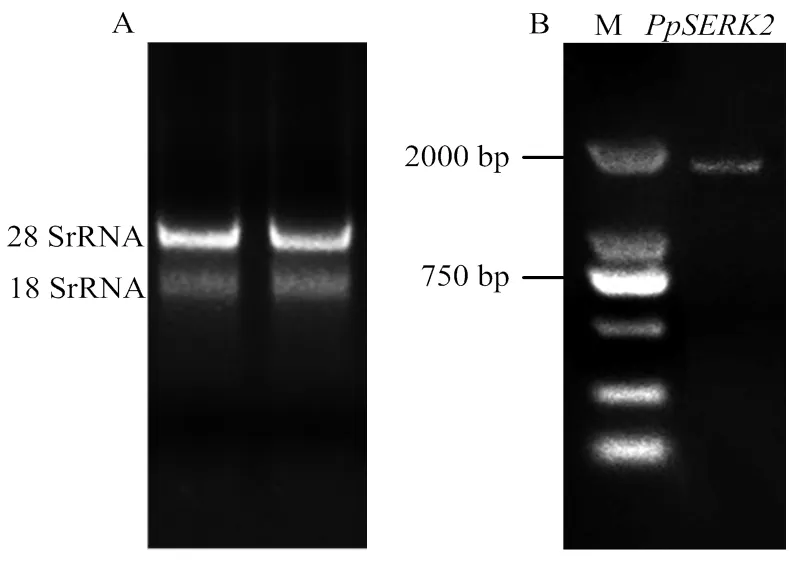
A:‘秋蜜红’茎尖RNA;B:PpSERK2的PCR扩增,M:DNA marker DL2000
2.2 PpSERK2的生物信息学分析
全长1 881 bp,编码626个氨基酸(图2)。运用Protparatam在线预测其蛋白质的理论分子量为68.99 kD,为5.38,不稳定系数是41.73(不稳定),分子式为C3084H4873N837O907S25,脂融指数为91.71,总平均疏水指数为-0.115,具疏水性。蛋白由22种氨基酸组成,其中亮氨酸(14.2%)含量最多,其次是甘氨酸(7.5%),半胱氨酸(1.4%)含量最少。TMpred预测结果推测PpSERK2具备跨膜结构,属于跨膜蛋白。亚细胞定位预测结果显示PpSERK2定位于细胞膜。
用DNAMAN软件将PpSERK2氨基酸序列与已知不同植物的SERK序列进行同源性比对。结果显示,PpSERK2氨基酸序列与秘鲁番茄()SpSERK1相似性最高,为92.71%,与温州蜜柑()CitSERK1次之,为92.01%,与拟南芥()AtSERK5的最低,为67.88%(图3)。InterProScan分析PpSERK2结果显示,其含有多个保守区典型SERK结构,N端存在1个编码信号肽(signal peptide,SP),紧接着是1个亮氨酸拉链结构(leu zipper,ZIP)、5个富亮氨酸重复序列(leu-rich repeat,LRR)、1个编码SPP(Ser-Pro-Pro)基序的富脯氨酸结构域、1个跨膜结构域(transmembrane region,TM)和11个亚区的激酶结构域(kinase domains)。此外,PpSERK2蛋白还存在1个C端结构域(图3)。
利用MEGA5.0软件对不同植物的SERK氨基酸序列构建系统进化树(图4),结果显示,PpSERK2与SpSERK1、CitSERK1、PsSERK2、AtSERK1、AtSERK2等双子叶植物同源性较高;二穗短柄草()、菠萝()、水稻()、玉米()等单子叶植物聚为一类,进化树结果与同源性比对结果一致;拟南芥AtSERK3、AtSERK4、AtSERK5独处于一个分支。
2.3 PpSERK2在不同状态‘秋蜜红’桃愈伤组织中的表达分析
将‘秋蜜红’花药接种到添加6-BA和2,4-D的NN69培养基,培养1周后,花药颜色逐渐变为褐色;培养15 d后,有的在其中部或端部的药室内形成裂缝,从中长出黄色的颗粒状愈伤组织。继续培养2周,对获得的愈伤组织进行形态学观察,可将花药培养获得的愈伤组织分为4类,黄色疏松状、绿色紧实状、浅黄色透明状和黄白色水渍状(图5)。组织细胞学观察发现黄色疏松状和绿色紧实状的愈伤组织细胞小、排列紧密且染色比较深(图5-E和图5-F),分别出现球形胚和心形胚结构;浅黄色透明状愈伤组织细胞排列紧密、细胞体积小,靠近愈伤组织边缘的细胞排列比较紧密且细胞体积小(图5-G),疑似鱼雷形胚结构尚未完全形成;而黄白色水渍状愈伤组织细胞体积大、排列不规则,细胞质稀且染色浅(图5-H)。根据形态学和组织学的鉴定结果,可知黄色疏松状、绿色紧实状和浅黄色透明状的3种状态愈伤组织均为胚性愈伤组织,而黄白色水渍状愈伤组织为非胚性愈伤组织。
通过对‘秋蜜红’4种状态愈伤组织中的表达分析(图6),结果表明,在‘秋蜜红’3种状态胚性愈伤组织中的表达量均显著高于黄白色水渍状非胚性愈伤组织,且在3种胚性愈伤组织中,在黄色疏松状愈伤组织中的表达量最高,结合组织细胞学观察发现黄色疏松状愈伤组织中有球形胚出现,其表达量明显高于绿色紧实状(心形胚)和浅黄色透明状(疑似鱼雷形胚出现),球形胚为体细胞胚发育过程的第一个阶段,即在桃体细胞胚发生的早期高表达。
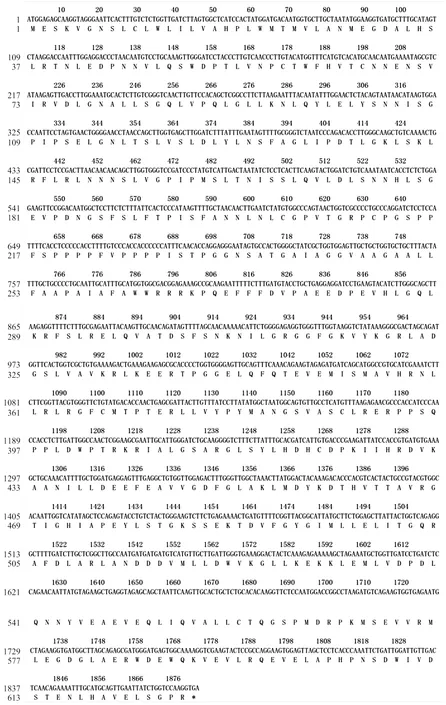
图2 PpSERK2的cDNA序列及其推导的氨基酸序列

PpSERK2:桃Prunus persica,XP_007201734.1;PsSERK2:牡丹Paeonia suffruticosa,KY200849.1;CitSERK1:温州蜜柑Citrus unshiu,AB115767.1;BdSERK2:二穗短柄草Brachypodium distachyon,XP_003571417.2;SpSERK1:秘鲁番茄Solanum peruvianu,EF623824.1;AcSERK1:菠萝Ananas comosus,HM236375.2;AcSERK2:菠萝Ananas comosus,HM236376.1;HvSERK1:大麦Prunus persica,AK372118.1;OsSERK1:水稻Oryza sativa,AB188247.1;OsSERK2:水稻Oryza sativa,XP_015636497.1;ZmSERK1:玉米Zea mays,AJ277702.1;ZmSERK2:玉米Zea mays,AJ277703.1;
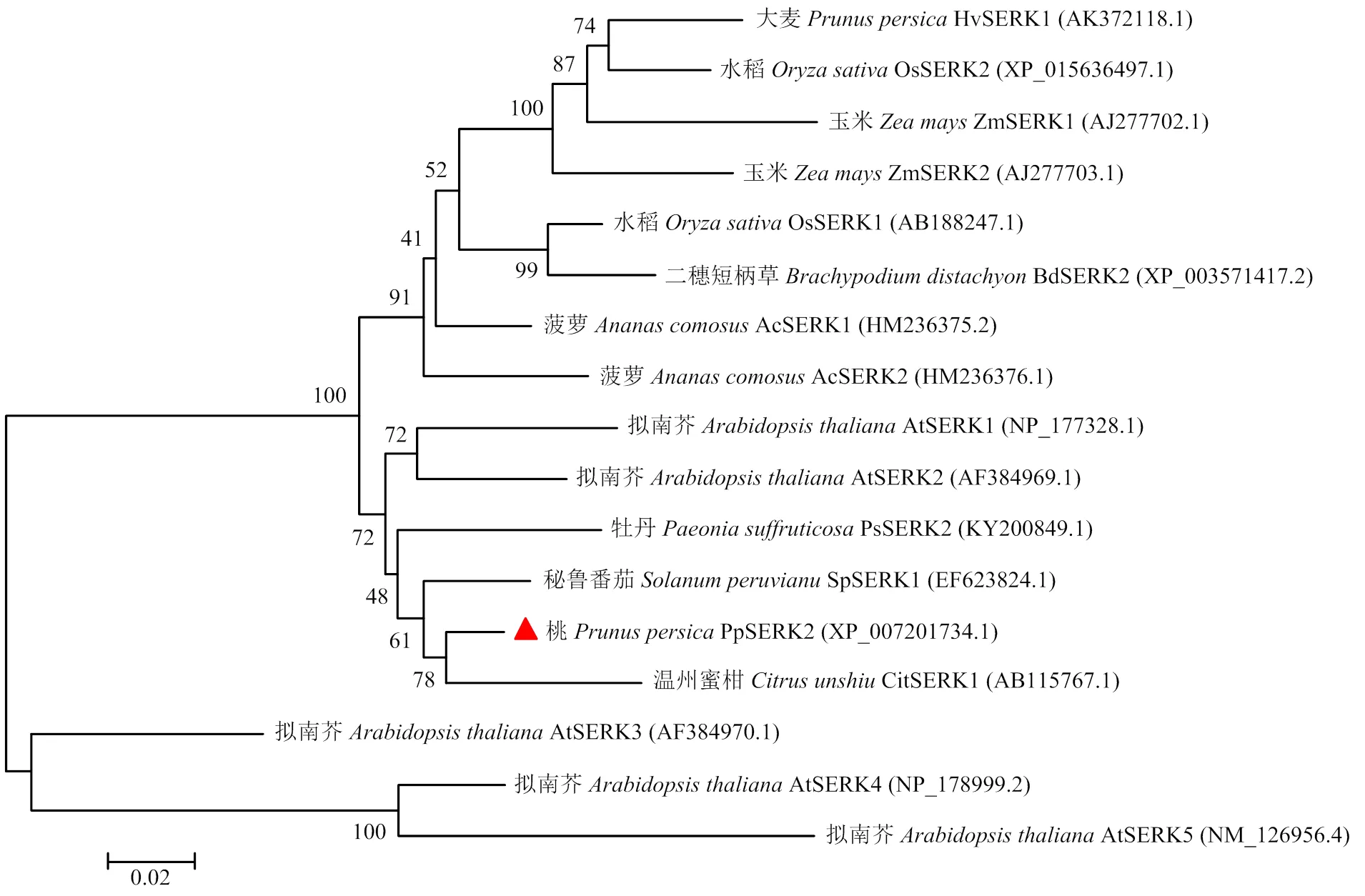
图4 PpSERK2与其他植物的SERK蛋白系统进化树
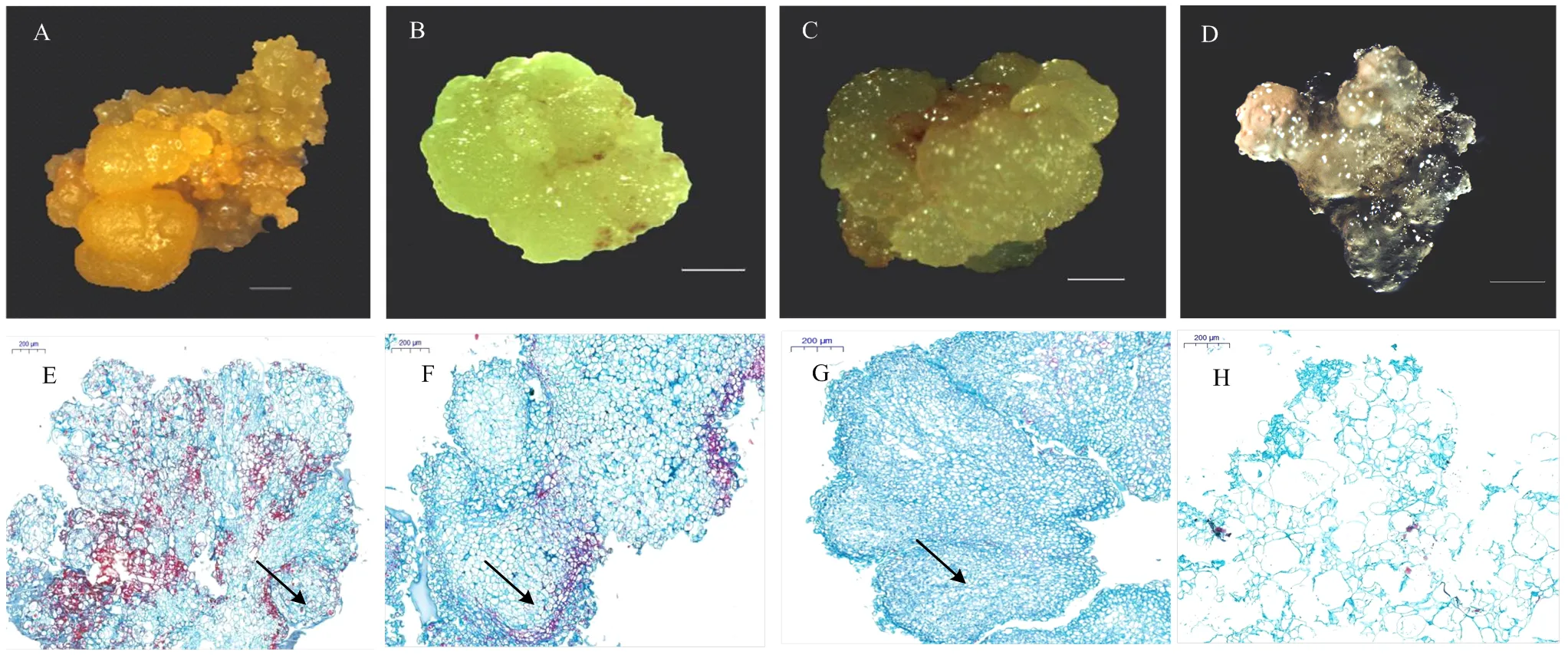
A:黄色疏松状胚性愈伤组织;B:绿色紧实状胚性愈伤组织;C:浅黄色透明状胚性愈伤组织;D:黄白色水渍状非胚性愈伤组织;E:黄色疏松状胚性愈伤组织细胞组织切片(箭头所示为球形胚结构);F:绿色紧实状胚性愈伤组织细胞组织切片(箭头所示为心形胚结构);G:浅黄色透明状胚性愈伤组织细胞组织切片(箭头所示为尚未完全形成的鱼雷形胚结构);H:黄白色水渍状非胚性愈伤组织细胞组织切片。A—D:图标比例尺为1 mm;E—H:图标比例尺为200 μm
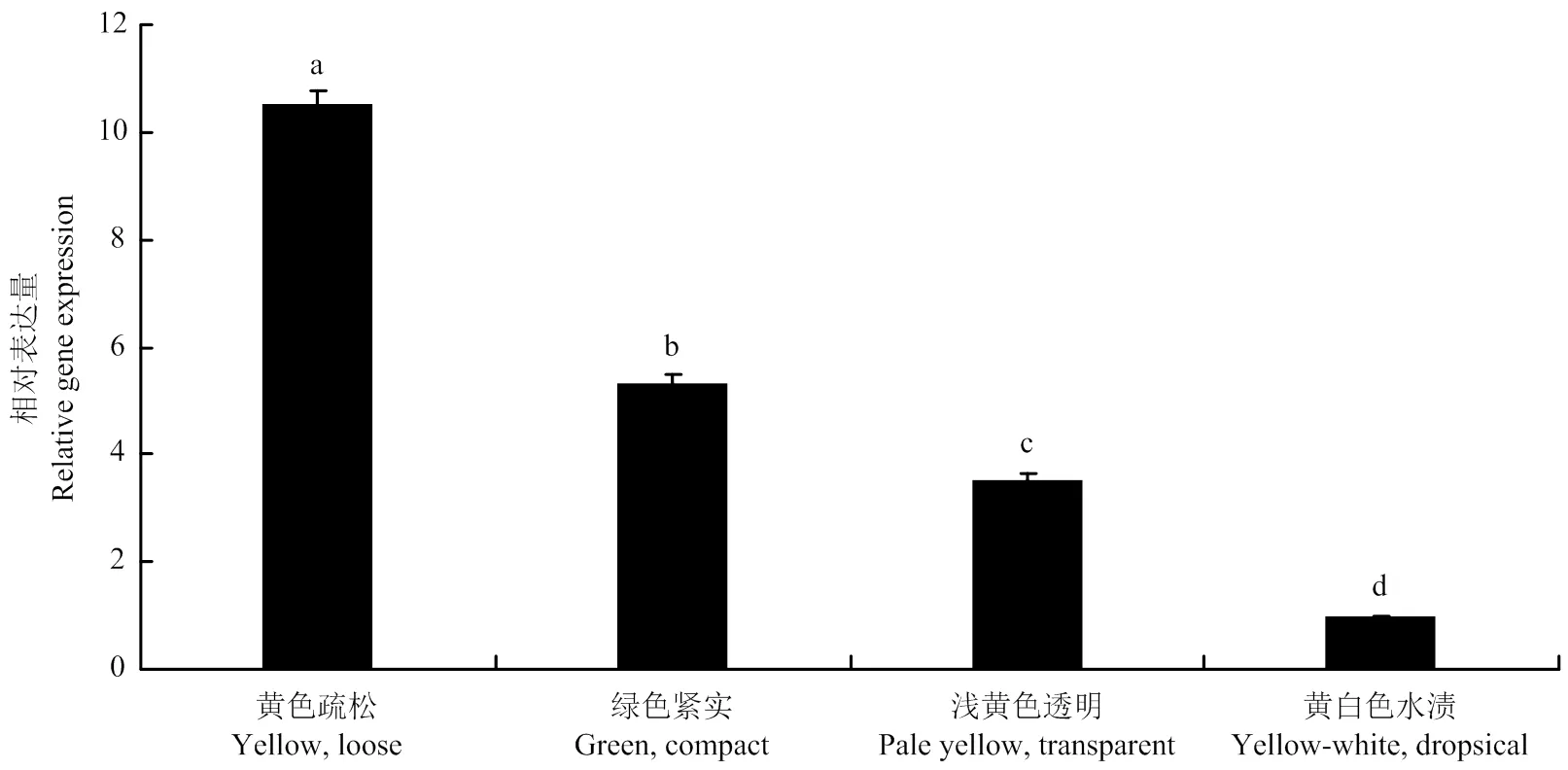
数据为平均值±标准误(n=3);不同小写字母表示差异显著(P<0.05)
3 讨论
体细胞胚发生途径是植物离体再生的一条重要途径,而体细胞胚是研究植物胚胎发育和遗传转化的良好受体。在体细胞胚发生过程中,体细胞胚不仅生理生化及形态发生变化,它的基因表达方式也发生变化。
3.1 PpSERK2的克隆与分析
SERKs基因属于膜富亮氨酸重复序列类受体蛋白激酶(leucinerich repeat receptor-like kinases,LRR-RLKs)家族[31]。根据胞外LRR结构和数量的差异,LRR-RLKs可分为13个亚类,而SERK蛋白属于第2类[32]。SERK结构保守,具LRR结构域、富含丝氨酸-脯氨酸结构域(SPP)、跨膜结构域和胞内激酶活性结构域[33-34]。本研究从桃茎尖中克隆了的cDNA全长,编码626个氨基酸,生物信息学分析表明其具有完整的SERK蛋白的保守结构域,因而能独立完成信号的接收、跨膜转导和胞内传递,将其命名为PpSERK2。PpSERK2与双子叶植物秘鲁番茄和温州蜜柑的SERK蛋白同源性较高,与单子叶植物的水稻、玉米、菠萝等同源性较低。
3.2 桃花药胚性愈伤组织的诱导及鉴定
桃胚性愈伤组织诱导及体细胞胚发生获得成功的报道较少[35-36]。Hammerschlag等[35]从白色、紧密、节球状胚性愈伤组织中诱导出胚状体结构;刘航空等[36]以‘华光’叶片为外植体诱导出黄绿色疏松状胚性愈伤组织。以桃花药为外植体诱导获得胚性愈伤组织鲜有报道。本研究以‘秋蜜红’花药为外植体诱导出4种状态的愈伤组织,组织细胞学观察到2种细胞形态,其中黄色疏松状、绿色紧实状和浅黄色透明状3种状态的愈伤组织细胞小,排列紧密且染色深,为胚性愈伤组织;而黄白色水渍状愈伤组织细胞体积大,不规则排列,细胞质稀且染色浅,为非胚性愈伤组织。表明胚性愈伤组织和非胚性愈伤组织在形态上和细胞水平均表现明显差异。本研究诱导出的胚性愈伤组织状态与前人不同[35-36],这可能是由于基因型、外植体、培养基和培养条件不同导致的;而组织细胞学观察结果与前人研究结果一致[37]。胚性愈伤组织的成功获得是进行体细胞胚诱导的关键因素。体细胞胚发生一般经历球形胚、心形胚、鱼雷形胚和子叶形胚4个阶段。本研究获得的黄色疏松状、绿色紧实状和浅黄色透明状3种状态愈伤组织均为胚性愈伤组织,且分别出现球形胚、心形胚和尚未完全形成的鱼雷形胚结构,这3种状态胚性愈伤组织的获得为后续体细胞胚再生途径的建立提供保障。
3.3 PpSERK2在桃胚性愈伤组织和体细胞胚发生中的作用
目前,植物中已经分离出许多与体细胞胚胎发生相关的基因,如[17]、[14]、[13]、[38]等,但只有[16,39]是在体细胞由营养生长向胚性生长的转化中以及早期的体细胞胚胎发生中起作用。基于此,推测可能是一些植物体细胞胚胎发生的标记基因[31]。本研究中在桃3种状态胚性愈伤组织中表达量均显著高于非胚性愈伤组织,且在体细胞胚发育的早期(黄色疏松状愈伤组织,出现球形胚)表达量最高,这与棉花[23]、椰子[26]、葡萄[40]、二穗短柄草[41]等研究结果相似。在棉花生殖器官中表达量明显高于营养器官,且在体胚发生过程中在球形胚中的表达量最高[23];在椰子胚性愈伤组织中表达,而在非胚性愈伤组织中低表达或检测不到[26];Schellenbaum等[40]研究发现在葡萄花药诱导愈伤组织和体胚发生的过程中稳定表达;原位杂交结果表明的转录本在二穗短柄草胚状体整个发生过程均可检测到[41]。由此认为桃在桃胚性愈伤组织中表达,而在非胚性愈伤组织中低表达,且在体细胞胚发育的早期发挥作用。
4 结论
克隆获得,其cDNA全长1 881 bp,编码626个氨基酸。PpSERK2与秘鲁番茄和温州蜜柑相似性最高,分别为92.71%和92.01%,拥有SERK蛋白保守结构域。在桃胚性愈伤组织中表达,在非胚性愈伤组织中低表达,且在体细胞胚发育的早期发挥作用。
[1] Rai V R, McComb J. Direct somatic embryogenesis from mature embryos of sandalwood., 2002, 69(1): 65-70.
[2] 吴延军, 徐昌杰, 张上隆. 桃组织培养和遗传转化研究现状及展望. 果树学报, 2002, 19(2): 123-127.
Wu Y J, Xu C J, Zhang S L. Status and prospect of research in peach tissue culture and genetic transformation., 2002, 19(2): 123-127. (in Chinese)
[3] Srinivasan C, Scorza R. The influence of genotype on the induction of somatic embryos fromcultured zygotic embryos and adventitious shoot regeneration from cotyledons of peach and nectarine., 2007, 738: 691-696.
[4] 汤浩茹, 王永清, 任正隆. 核桃体细胞胚发生与转基因研究进展. 林业科学, 2000, 36(3): 102-110.
Tang H R, Wang Y Q, Ren Z L. An overview of progress in somatic embryogenesis and transformation in walnut., 2000, 36(3): 102-110. (in Chinese)
[5] 宋跃, 甄成, 张含国, 李淑娟. 长白落叶松胚性愈伤组织诱导及体细胞胚胎发生. 林业科学, 2016, 52(10): 45-54.
Song Y, Zhen C, Zhang H G, Li S J. Embryogenic callus induction and somatic embryogenesis from immature zygotic embryos of., 2016, 52(10): 45-54. (in Chinese)
[6] Li Z X, Fan Y R, Dang S F, Li W F, Qi L W, Han S Y.-mediated auxin biosynthesis and signalling affect somatic embryogenesis in., 2018, 293(6): 1355-1363.
[7] Sezgin M, Dumanoğlu H. Somatic embryogenesis and plant regeneration from immature cotyledons of European chestnut (Mill.)., 2014, 50(1): 58-68.
[8] Hou J Y, Wu Y, Shen Y C, Mao Y J, Liu W B, Zhao W W, Mu Y, Li M H, Yang M L, Wu L F. Plant regeneration through somatic embryogenesis and shoot organogenesis from immature zygotic embryos ofRoxb., 2015, 197: 218-225.
[9] Kazmi S K, Khan S, Mirbamar A A, Kabir N. Micropropagation of nucellar embryos and their histological comparative study for regeneration ability with other explants of kinnow mandarin (Blanco)., 2018, 50(1): 345-353.
[10] Ji W, Luo Y X, Guo R R, Li X X, Zhou Q, Ma X H, Wang Y J. Abnormal somatic embryo reduction and recycling in grapevine regeneration., 2017, 36(4): 912-918.
[11] Dutt M, Zambon F T, Erpen L, Soriano L, Grosser J. Embryo-specific expression of a visual reporter gene as a selection system for citrus transformation., 2018, 13(1): e0190413.
[12] Iocco P, Franks T, Thomas M R. Genetic transformation of major wine grape cultivars ofL.., 2001, 10(2): 105.
[13] Boutilier K, Offringa R, Sharma V K, Kieft H, Ouellet T, Zhang L, Hattori J, Liu C M, van Lammeren A A M, Miki B L A, Custers J B M, van Lookeren Campagne M M. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth., 2002, 14(8): 1737-1749.
[14] Stone S L, Kwong L W, Yee K M, Pelletier J, Lepiniec L, Fischer R L, Goldberg R B, Harada J J.encodes a B3 domain transcription factor that induces embryo development., 2001, 98(20): 11806-11811.
[15] Zuo J, Niu Q W, Frugis G, Chua N HThegene promotes vegetative-to-embryonic transition in., 2002, 30(3): 349-359.
[16] Schmidt E D L, Guzzo F, Toonen M A J, de Vries S C. A leucine-rich repeat containing receptor-like kinase marks somatic plant cells competent to form embryos., 1997, 124(10): 2049-2062.
[17] Hecht V, Vielle-Calzada J P, Hartog M V, Schmidt E D L, Boutilier K, Grossniklaus U, de Vries S C. Thegene is expressed in developing ovules and embryos and enhances embryogenic competence in culture., 2001, 127(3): 803-816.
[18] Baudino S, Hansen S, Brettschneider R, Hecht V F G, Dresselhaus T, Lörz H, Dumas C, Rogowsky P M. Molecular characterisation of two novel maize LRR receptor-like kinases, which belong to thegene family., 2001, 213(1): 1-10.
[19] Nolan K E, Irwanto R R, Rose R J. Auxin up-regulatesexpression in bothroot-forming and embryogenic cultures., 2003, 133(1): 218-230.
[20] Thomas C, Meyer D, Himber C, Steinmetz A. Spatial expression of a sunflowergene during induction of somatic embryogenesis and shoot organogenesis., 2004, 42(1): 35-42.
[21] Hu H, Xiong L, Yang Y. Ricegene positively regulates somatic embryogenesis of cultured cell and host defense response against fungal infection., 2005, 222(1): 107-117.
[22] Singh A, Khurana P. Ectopic expression ofgenes (TaSERKs) control plant growth and development in., 2017, 7(1): 12368.
[23] Liu Z J, Zhao Y P, Zeng L H, Zhang Y, Wang Y M, Hua J P. Characterization ofand its expression associated with somatic embryogenesis and hormones level in Upland cotton, 2018, 17(3): 517-529.
[24] Huang X, Lu X Y, Zhao J T, Zhao J T, Chen J K, Dai X M, Xiao W, Chen Y P, Chen Y F, Huang X L.Gene expression associated with somatic embryogenic competence and disease resistance response in banana (.)., 2010, 28(2): 309-316.
[25] Ahmadi B, Masoomi-aladizgeh F, Shariatpanahi M E, Azadi P, Keshavarz-Alizadeh M. Molecular characterization and expression analysis ofandL.: implication for microspore embryogenesis and plant regeneration., 2016, 35(1): 185-193.
[26] Péreznúñez M T, Souza R, Sáenz L, Chan J L, Zúñiga-Aguilar J J, Oropeza C. Detection of a SERK-like gene in coconut and analysis of its expression during the formation of embryogenic callus and somatic embryos., 2009, 28(1): 11-19.
[27] da Cunha Soares T, da Silva C R C, Carvalho J M F C, Cavalcanti J J V, de Lima L M, de Albuquerque Melo Filho P, Severino L S, dos Santos R CValidating a probe fromgene for selection of cotton genotypes with somatic embryogenic capacity., 2018, 270: 44-50.
[28] 王其海, 王裔娜, 刘晓华, 吴文江, 丁宁, 牛洪斌, 王林忠, 吴国良. 桃不同发育时期叶片总RNA提取方法的比较. 河南农业科学, 2014, 43(3): 116-120.
Wang Q H, Wang Y N, Liu X H, Wu W J, Ding N, Niu H B, Wang L Z, Wu G L. Comparative analysis of total RNA extraction methods for leaves of peach at different development stages., 2014, 43(3): 116-120. (in Chinese)
[29] 李和平. 植物显微技术: 第二版. 北京: 科学出版社, 2009.
Li H P.. Beijing: Science Press, 2009. (in Chinese)
[30] 韩亚萍. 桃体细胞胚发生相关基因的克隆与表达分析[D]. 郑州: 河南农业大学, 2017.
HAN Y P. Cloning and expression analysis of somatic embryogenesis related gene
[31] Li Y B, Liu C H, Guo G M, He T, Chen Z W, Gao R H, Xu H W, Faheem M, Lu R J, Huang J H. Expression analysis of three SERK-like genes in barley under abiotic and biotic stresses., 2017, 12(1): 279-285.
[32] Shiu S H, Bleecker A B. Receptor-like kinases fromform a monophyletic gene family related to animal receptor kinases., 2001, 98(19): 10763-10768
[33] Becraft P W. Receptor kinases in plant development., 1998, 3(10): 384-388.
[34] Zhang X R. Leucine-rich repeat receptor-like kinases in plants., 1998, 16(4): 301-311.
[35] Hammerschlag F A, Bauchan G, Scourza R. Regeneration of peach plant from callus derived from immature embryos., 1985, 70(3): 248-251.
[36] 刘航空, 韩明玉, 禹婷, 赵彩平. 影响油桃叶片产生胚性愈伤组织的因素. 果树学报, 2006, 23(3): 370-374.
Liu H K, Han M Y, Yu T, Zhao C P. Factors affecting embryonic callus from leaves of early season nectarine cultivars., 2006, 23(3): 370-374. (in Chinese)
[37] 鲁娇娇, 严瑞, 何香杉, 靳宏梅, 王锦霞, 王春夏, 孙红梅. 朱顶红‘Red Lion’胚性愈伤组织诱导及体细胞胚发生. 园艺学报, 2016, 43(12): 2451-2460.
LU J J, YAN R, HE X S, JIN H M, WANG J X, WANG C X, SUN H M. The embryonic callus induction and somatic embryogenesis of hippeastrum vittatum‘Red Lion’., 2016, 43(12): 2451-2460. (in Chinese)
[38] 林丽霞, 屈莹, 徐洋, 林玉玲, 赖钟雄. 龙眼体胚发生过程生长素响应因子的克隆及表达分析. 西北植物学报, 2014, 34(6): 1075-1082.
Lin L X, Qu Y, Xu Y, Lai Z X. Cloning and expression analysis ofin the process of somatic embryogenesis inLour.., 2014, 34(6): 1075-1082. (in Chinese)
[39] Thomas T L. Gene expression during plant embryogenesis and germination: an overview., 1993, 5(10): 1401-1410.
[40] Schellenbaum P, Jacques A, Maillot P, Bertsch C, Mazet F, Farine S, Walter B. Characterization of,,, and, genes and their expression during somatic embryogenesis of grapevine (L.)., 2008, 27(12): 1799-1809.
[41] Oliveira E J, Koehler A D, Rocha D I, Vieira L M,Marques Pinheiro M V, de Matos E M, da Cruz A C F, Ferreira da Cruz A C, Ribeiro da Silva T C, Ossamu Tanaka F A, Silveira Nogueira F T, Otoni W C. Morpho-histological, histochemical, and molecular evidences related to cellular reprogramming during somatic embryogenesis of the model grass., 2017, 254(11): 2017-2024.
Cloning and Expression Analysis ofGene in Different Forms of Calli on Peach (L.)
TAN Bin1,2, CHEN TanXing1, HAN YaPing1, ZHANG YaRu1, Zheng XianBo1,2, Cheng Jun1,2, Wang Wei1,2, Feng JianCan1,2
(1College of Horticulture, Henan Agricultural University, Zhengzhou 450002;2Henan Key Laboratory of Fruit and Cucurbit Biology, Zhengzhou 450002)
【Objective】The somatic embryogenesis receptor-like kinase 2 () gene was isolated and cloned from peach (L.). Here, we detected the expression profile ofand the regeneration of embryonic callus. This research will shed on uncovering the molecular mechanism of embryonic callus induction and regeneration in peach with difficulty on tissue culture. 【Method】The full-length cDNA sequence ofgene was obtained by homologous cloning. Then the sequence was analyzed by a series of bioinformatical software packages, including TMPred, DNAMAN and MEGA 5.0 etc. The callus of ‘Qiumihong’ was obtained by using anthers as explants inoculated into NN69 medium supplemented with 2.0 mg·L-16-BA and 1.0 mg·L-12,4-D. Then the different forms of calli were observed by production of paraffin section. Real-time quantitative PCR (qRT-PCR) was used to analyze the expression ofgene in four forms of ‘Qiumihong’ calli. 【Result】The full-length cDNA sequence ofgene was 1 881 bp. It encodes 626 amino acids and contains SERK conserved function domains. The theoretical isoelectric point of PpSERK2 is 5.38 and its molecular weight is 68.99 KD. The PpSERK2 has the high homology similarity from 67.88% to 92.71% at protein level, especially the highest similarity toand. The phylogenetic analysis of SERK proteins from various plant species indicated that PpSERK2, SpSERK1, CitSERK1 and PsSERK2 were clustered together, which showing the consistent result with above protein similarity analysis. Four different forms of calli were obtained from anther of ‘Qiumihong’. The results of histocytology showed that the cells of three forms of calli, including the yellow, loose callus (global embryo), green, compact callus (heart embryo) and pale yellow, transparent callus (suspected torpedo embryo), were small and closely arranged. While the cells of yellow-white, dropsical callus was large and with irregular shapes. Based on histomorphology results, this demonstrated that the yellow, loose callus, green, compact callus and pale yellow, transparent callus were embryonic calli, while yellow-white, dropsical callus was non-embryonic callus. The results of qRT-PCR showed that transcriptional level ofgene in three forms of embryonic calli was remarkably higher than non-embryonic callus. Meanwhile, the transcriptional level ofgene was highest in the yellow, loose callus, followed by the green, compact callus, and lowest in the pale yellow and transparent callus of ‘Qiumihong’. 【Conclusion】The full-length cDNA of thegene was successfully obtained. According to the results ofexpression in four forms calli of ‘Qiumihong’, we speculated thatgene might play a pivotal role on the early stage during the somatic embryogenesis in peach.
peach; somatic embryogenesis;; embryonic callus
10.3864/j.issn.0578-1752.2019.05.010
2018-10-10;
2018-11-17
河南省重大科技专项(151100110900)、河南省现代农业产业技术体系建设专项(S2014-11-G02)、河南省科技攻关计划(172102410049)、河南省高等学校重点科研项目(17A210001)
谭彬,E-mail:btan@henau.edu.cn。通信作者冯建灿,E-mail:jcfeng@henau.edu.cn
(责任编辑 李莉)
