硫酸卡那霉素注射液及滴眼液的质量评价
2019-03-29蒋孟虹裘亚张杨慧赵敬丹张含智秦峰刘浩
蒋孟虹 裘亚 张杨慧,2 赵敬丹 张含智 秦峰,3 刘浩,*
(1 上海市食品药品检验所,上海 201203;2 中国医药工业研究总院,上海 201203;3 复旦大学化学系,上海 200433)
卡那霉素(kanamycin)是α-去氧链胺衍生物组的氨基糖苷类广谱抗生素,由日本明治制果药业株式会社于1958年首次上市[1-2],我国于1966年开始投入生产。本品适用于敏感肠杆菌科细菌如大肠埃希菌、克雷伯菌属、变形杆菌属、产气肠杆菌、志贺菌属等引起的感染,如肺炎、败血症、腹腔感染等,其主要不良反应表现为耳毒性和肾毒性[2-4]。
卡那霉素制剂的原料根据硫酸盐数目不同分为单硫酸卡那霉素(C18H36N4O11·H2SO4)和硫酸卡那霉素(C18H36N4O11·nH2SO4)两种。目前,单硫酸卡那霉素收载于中国药典2000年版(ChP2000),硫酸卡那霉素收载于ChP2015,其余各国药典均收录至少一种原料[5-10];ChP2015和美国药典收载硫酸卡那霉素注射液;硫酸卡那霉素滴眼液仅收载于ChP2015。现行标准对原料与制剂的检验方法不统一,缺乏对有关物质全面系统的评价,难以真实反映产品的质量。
为加强对国家药物质量的监督管理,客观地评价药品的质量现状,分析产品的主要质量问题,进而明确提高产品质量的方向[11-12]。硫酸卡那霉素注射液/滴眼液为2017年国家药品评价性抽验品种,共计抽样112批次(其中注射液102批,滴眼液8批)。注射液生产单位均采用单硫酸卡那霉素为原料,加入抗氧剂、络合剂等辅料搅拌溶解,调节pH值,过滤后灌封。滴眼液生产单位则采用硫酸卡那霉素为原料,加入抗氧剂、防腐剂等辅料搅拌溶解,调节pH值,过滤后灌装。本文依据现行药品质量标准的检验结果结合探索性研究,评价国产硫酸卡那霉素注射液/滴眼液的质量现状,对比原研制剂的质量,并从安全性和有效性的角度出发对企业的生产工艺和现行法定标准提出建议。
1 仪器与试药
1.1 仪器
Agilent 1100型高效液相色谱仪;Vector PCX型柱后衍生化仪;Agilent 1260-6550型四级杆/飞行时间质谱联用仪;Dionex ICS5000型离子色谱仪,配备EGC淋洗液自动发生器和电导检测器,ASRS 500(4mm)阴离子抑制器。
1.2 试药
112批硫酸卡那霉素注射液/滴眼液均为2017年国家评价性抽验样品,来自国内的9个生产企业;卡那霉素对照品(批号130556-201502,纯度67.9%)、卡那霉素B(批号130548-200501,纯度100%)、羟苯甲酯(批号100278-201404,纯度100.0%)、羟苯乙酯(批号100847-201604,纯度99.9%)、羟苯丙酯(批号100444-201403,纯度99.6%)、醋酸氯己定(批号100183-201003,纯度96.2%)、苯扎氯铵(批号135051-201401,含n-C12H25为66.04%,含n-C14H29为33.96%)和苯甲酸钠(批号100433-200301,纯度100%)均由中国食品药品检定研究院提供;2-脱氧链霉胺(批号101838279,纯度≥97%)由美国Aldrich公司提供;6-O-(3-氨基-3-脱氧-α-D-葡吡喃糖基)脱氧链霉胺(批号D26351,纯度95%)由加拿大TRC公司提供;苯甲醇(批号20150906,纯度99.0%)由上海凌峰化学试剂有限公司提供;山梨酸(批号:1362218,纯度99%)由Fluka提供;三氯叔丁醇(批号20140610,纯度98.0%)由国药集团化学试剂有限公司提供;硫柳汞钠(批号L990N32,纯度98%)由北京百灵威科技有限公司提供;(单)硫酸卡那霉素原料药和相关辅料均由各制剂生产企业提供;原研注射液样品(日本明治制果药业株式会社,批号1103)自购;邻苯二甲醛、四氢呋喃、甲酸、邻苯二甲醛、乙腈和甲醇均为色谱纯;2-巯基乙醇、硼酸、亚硝酸钠、硝酸钠、氢氧化钠、冰醋酸、硫酸、醋酸钠、无水硫酸钠、磷酸钠、氯化钠、硫代硫酸钠均为分析纯。
2 实验方法
2.1 法定检验方法
根据各企业样品的生产日期,按照ChP2010二部或ChP2015二部进行法定标准检验。
2.2 探索性研究方法
在法定检验结果及注射剂、眼用制剂重点关注项目的基础上,以完善质量标准为中心,并结合药品的安全性和有效性等方面,进一步开展杂质谱,防腐剂含量,氯离子、硫酸根离子及硫代硫酸根离子含量等项目的探索性研究。
2.2.1 有关物质[2]
(1)有关物质的测定:色谱柱:Agilent Zorbax Eclipse Plus C18柱(4.6mm×100mm,3.5μm);流动相:以pH3.4缓冲液(冰醋酸调节)[含0.02mol/L庚烷磺酸钠溶液和0.11mol/L硫酸钠溶液]:甲醇(95:5, V/V)为流动相A,pH3.4缓冲液:甲醇(60:40, V/V)为流动相B,按表1进行线性梯度洗脱;柱温35℃;流速1.0mL/min;进样体积5μL;样品浓度0.5mg/mL。取0.8g邻苯二甲醛、2mL 2-硫基乙醇、300mL甲醇和700mL硼酸盐缓冲液(pH10.4)[含10.8g/L氢氧化钠溶液和18g/L硼酸溶液],混匀,用0.45μm滤膜过滤,作为柱后衍生化试液;衍生化反应温度35℃;衍生化试液流速为0.8mL/min;荧光检测器,激发波长为340nm,发射波长为455nm。

表1 流动相梯度洗脱程序Tab.1 The program of gradient elution
(2)杂质鉴定
色谱柱:DionexIonPacTMCG17弱阳离子交换柱(0.4cm×5cm);柱温30℃;流速为1.0mL/min;进样体积5μL;流动相为0.1%甲酸水溶液:0.1%甲酸乙腈溶液(1:1, V/V);离子源:电喷雾电离源(ESI),正离子模式扫描;扫描范围:m/z 50~1700;喷雾电压:3000V;雾化器温度:220℃;雾化器流速:19L/min。
2.2.2 滴眼液中防腐剂含量的测定
色谱柱:Waters XBridge C18柱(4.6cm×250mm,5μm);以0.1%磷酸溶液为流动相A;甲醇为流动相B;四氢呋喃为流动相C;流速1.0mL/min;检测波长214nm;取原液直接进样;进样体积5µL;按表2进行线性梯度洗脱。
2.2.3 滴眼液中氯离子、硫酸根离子及硫代硫酸根离子含量的测定
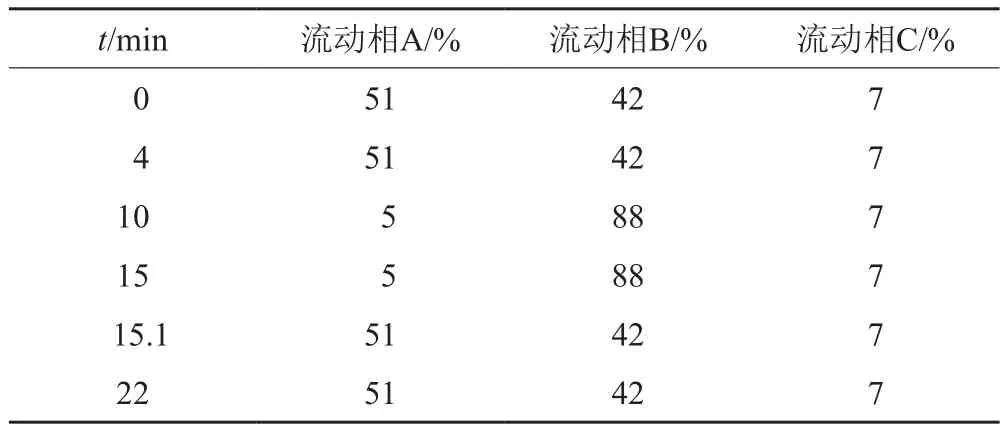
表2 流动相梯度洗脱程序Tab.2 The program of gradient elution
色谱柱:IonPac AS 11-H C型分离柱(250mm×4mm);IonPac AG11-HC型保护柱(50mm×4mm);流动相:KOH梯度淋洗液;流速:1.0mL/min;电导检测器检测;进样体积:25µL;样品浓度:0.5mg/mL;按表3进行线性梯度洗脱

表3 梯度洗脱程序Tab.3 Linear gradient elution procedure
3 结果与讨论
3.1 法定检验方法及结果
3.1.1 法定检验方法及存在问题
通过对比、调研及实验发现,现行法定药品标准存在以下问题:(1)标准不统一:注射液的原料单硫酸卡那霉素仅收载于ChP2000,其中卡那霉素B和含量测定方法分别为薄层色谱法和抗生素微生物检定法,而ChP2015中硫酸卡那霉素标准相应项目的检测方法均为液相色谱-蒸发光散射检测法(ELSD),方法之间的可比性差,需统一标准。(2)检验项目缺失:原料药和制剂的标准均缺少有关物质检查项,硫酸卡那霉素滴眼液缺乏防腐剂检查项,无法全面表征产品质量。(3)限度制定不合理:硫酸卡那霉素注射液中卡那霉素B组分的控制限度为不得过4.0%,其原料药标准中(ChP2000)规定卡那霉素B的限度为不得过2.0%。由于卡那霉素B组分为发酵副产物,其含量在制剂过程和贮藏等条件下会下降,其限度不应高于原料药的控制限度。
3.1.2 法定检验结果及发现问题
按现行质量标准检验,104批硫酸卡那霉素注射液检验结果均符合规定,合格率为100%。8批硫酸卡那霉素滴眼液中2批检验结果不符合规定,合格率为75%;不合格项目为装量、渗透压摩尔浓度、可见异物(表4)。不符合产品集中在个别企业,提示个别企业的GMP管理仍存在缺陷。

表4 不合格样品的详细信息Tab.4 Results of the unquali fi ed samples
3.2 探索性研究结果
基于硫酸卡那霉素注射液/滴眼液不合格样品的原因分析及质量标准现状,对其杂质谱,滴眼液中防腐剂含量和氯离子、硫酸根离子及硫代硫酸根离子含量等进行研究,以进一步评价各生产企业产品的质量。
3.2.1 杂质谱分析[2]
卡那霉素是由卡那链霉菌发酵生产,在发酵和纯化工艺中,生物合成主要有效成分卡那霉素A的同时可能生成卡那霉素B、卡那霉素C、卡那霉素D等发酵副产物和降解产物[2,13]。现行质量标准缺少有关物质检查方法,而ChP2015仅采用HPLC-ELSD法测定卡那霉素B,该方法对杂质的分离能力较差,杂质的控制不全面,且ELSD系统流动相需具有挥发性,使得色谱系统的优化受到限制。
在本部分探索性研究中,我们从中国药典分离系统出发,对HPLC-ELSD法、HPLC-脉冲安培电化学检测法和HPLC-柱后衍生化-荧光检测法进行对比分析,比较不同色谱系统的杂质检出数量及分离能力,并对其进行优化和改进,最终建立了简便、快捷的HPLC-柱后衍生化-荧光检测法,弥补了采用现行中国药典卡那霉素B测定方法重现性差、灵敏度低、分离能力弱,不能有效控制副产物和降解杂质等问题,供试品溶液的典型色谱图见图1。
比较卡那霉素的杂质谱有利于评价不同企业产品的质量。探索性研究采用新建HPLC-柱后衍生化-荧光检测法,通过半制备色谱对样品和破坏性试验中的主要杂质进行分离和富集(系统适用性图谱见图2),应用高效液相色谱-四级杆-飞行时间质谱分析技术进行杂质结构推测和来源归属(表5)。
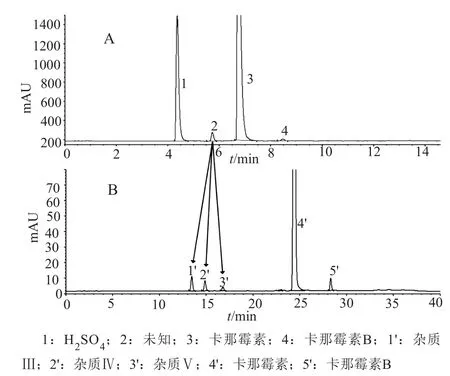
图1 HPLC-ELSD系统(A)与HPLC-柱后衍生化-荧光检测系统(B)供试品溶液的典型色谱图Fig.1 HPLC chromatograms of samples in ELSD (A)and post column derivatization systems (B)
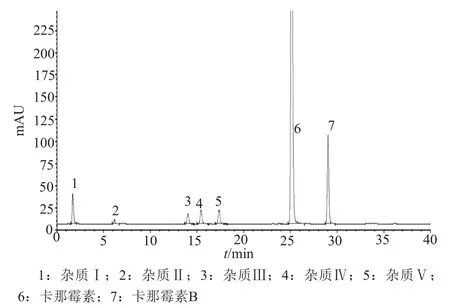
图2 HPLC-柱后衍生化-荧光检测法系统适用性典型色谱图Fig.2 Chromatograms of HPLC-post-column derivatizationfl uorescent detection
采用新建HPLC-柱后衍生化-荧光检测法,对国内不同来源的原料药、2个企业8批滴眼液、7个企业104批注射液及1批次原研注射液(日本明治制果药业株式会社)的有关物质进行测定。对不同来源样品的分析结果(表6)显示,原料药中杂质检出个数差别不大,但不同企业样品中卡那霉素B(0.6%~1.6%)和杂质Ⅲ(0.7%~1.9%)的结果差异显著;降解产物杂质Ⅳ的最低含量为0.5%,而最高含量可达1.8%。这些杂质与发酵条件和纯化工艺有关,精制有利于提高产品质量。建议原料生产厂家对生产工艺参数进行优化,加强控制关键技术指标,从源头确保下游产品的质量。

表5 杂质谱研究中杂质的LC-Q-TOF-MS测定数据及解析Tab.5 LC-Q-TOF-MS data and proposed chemical structures of impurities

表6 样品测定结果Tab.6 Determination results of samples
通过对杂质谱的研究发现,原研注射液中各杂质含量和杂质总量均远远低于国产注射液,国产产品的质量显著低于原研产品;而且国内同一个厂家不同批次及不同厂家之间制剂样品的的杂质谱均存在较大差异,特别是卡那霉素B和杂质Ⅲ的结果差异显著(卡那霉素B在0.8%~2.4%之间、杂质Ⅲ在0.8%~2.2%之间)。由于卡那霉素B和杂质Ⅲ均为发酵副产物,并非制剂过程中产生,故提示目前卡那霉素原料药的生产工艺尚不稳定。建议企业严格控制发酵条件,进一步优化分离纯化方法,提高产品的批间稳定性和产品质量,降低安全风险。稳定性试验(温度40℃,相对湿度75%)结果显示,温湿度升高条件下,降解杂质Ⅳ和杂质Ⅴ以及杂质总量增加趋势明显,故杂质Ⅳ和杂质Ⅴ可以作为反映制剂内在质量的关键指标。
综上所述,不同厂家杂质情况差异较大的主要原因可能是生产工艺、原料来源、贮藏条件等因素,建议生产企业在我国现有的制剂水平条件下优化生产工艺。
3.2.2 防腐剂含量
为了减小多剂量包装眼用制剂在使用中被污染的风险,通常需要添加防腐剂,而防腐剂长时间大剂量使用可能造成角膜上皮细胞损伤,甚至产生毒性反应,故需考察评价防腐剂的浓度[14-16]。国产硫酸卡那霉素滴眼液的处方中均含有防腐剂,但现行标准未设置防腐剂检查项,故本研究建立了HPLC法测定滴眼液中常用防腐剂(季铵盐类、尼泊金酯类、醇类、有机酸类、有机胍类、有机汞类)的高通量测定方法(系统适用性典型色谱图见图3)。对涵盖2个生产企业抽验的8批滴眼液进行了防腐剂含量测定。8批硫酸卡那霉素滴眼液检出的防腐剂种类与产品标签一致,含量分布在92.5%~104.9%,说明生产企业对防腐剂投料及工艺控制较为理想。
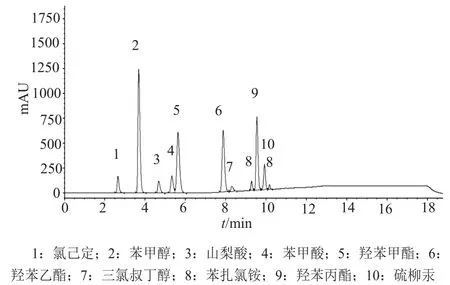
图3 防腐剂测定系统适用性溶液的典型色谱图Fig.3 Typical chromatogram of the system suitability solution for preservatives
3.2.3 滴眼液中氯离子、硫酸根离子及硫代硫酸根离子含量
渗透压摩尔浓度反映溶液中各种溶质对溶液渗透压贡献的总和。法定检验结果显示批号为151201的硫酸卡那霉素滴眼液不符合规定项目为装量和渗透压摩尔浓度。其中,渗透压摩尔浓度高出上限值的6.6%。为了考察渗透压偏高的原因,探索性研究建立了测定硫酸卡那霉素滴眼液中Cl-、SO42-和S2O32-的离子色谱法。I企业批号为151201的样品中Cl-和SO42-的含量较同来源其他批号样品略高。结合该批次样品装量和渗透压摩尔浓度的检验结果,分析原因可能和储藏过程中包装材料的密封性不佳,导致水分挥发。提示生产企业应采用密闭性良好的包装材料,保证药品在储藏及运输过程产品的安全性。
4 结论
本次评价性抽验采用法定检验结合探索性研究对国产硫酸卡那霉素注射液/滴眼液的法定标准和质量现状进行了分析和评价。
按照法定检验标准,本次抽验样品合格率为98.2%。不合格项目为装量、渗透压摩尔浓度、可见异物,均来自同一生产企业。其中1批的不合格原因可能与储藏过程中包装材料的密封性有关,建议生产企业对包装材料的密封性进行再评价。
通过探索性研究,对产品中的主要杂质结构和来源进行了归属,分析不同厂家杂质情况差异较大的原因,主要是生产原料来源、工艺和贮藏条件等因素造成,建议原料生产企业对生产工艺参数进行优化,加强控制关键技术指标,从源头控制产品的质量;建议制剂生产企业在我国现有的制剂水平条件下优化生产工艺。通过探索性研究还进一步完善了卡那霉素原料药和制剂的法定质量标准:(1)新建有关物质测定方法,弥补了现行卡那霉素B测定方法重现性差、灵敏度低的缺陷以及分离能力弱,不能有效控制副产物和降解杂质的问题,填补了各国药典无有关物质测定仪器分析方法的空白;(2)建议硫酸卡那霉素滴眼液的质量标准中增加对有关物质、防腐剂含量的控制;(3)建议新版药典重新收载单硫酸卡那霉素质量标准,对单硫酸卡那霉素和硫酸卡那霉素现行标准进行统一。
